干旱胁迫与复水对苗期玉米光合特性的影响
刘乔斐,周自云,杜妮妮
(1.安康学院现代农业与生物科技学院,陕西 安康725000; 2.西北农林科技大学生命科学学院,陕西 杨凌712100)
0 引言
我国降水时空分布不均,土壤干旱与湿润交替变化是农业生产中作物经常面临的实际田间环境。土壤缺水和干湿交替的现象不仅在干旱半干旱地区经常出现,在南方等非干旱地区也经常出现季节性干旱[1]。随着全球气候干暖化的加剧,玉米季节性干旱和间歇性干旱时常发生,使得玉米经常处于干旱和复水交替的生境中[2]。因此,干旱后恢复能力也是评价玉米抗旱性强弱的重要方面。植物经历一定强度的干旱胁迫后复水在农艺和生理功能上会产生显著的补偿效应,但其恢复程度仍低于正常灌水的水平[3]。因此,研究干旱胁迫与复水处理后植物体内的生理变化,可以了解植物在长期进化过程中的耐旱策略。
光合作用是植物生长发育的基础,水分亏缺将极大地抑制植物的光合作用。玉米受旱后的第一响应是气孔开度减小甚至关闭,CO2进入叶片受阻,羧化中心对CO2的利用受到影响,光合速率降低,光合电子传递受到抑制,导致光系统Ⅱ光能过剩,最终降低光合作用而减产[4]。前人关于干旱胁迫下玉米光合作用的相关报道在光合色素、光合参数、光响应曲线和叶绿素荧光参数等方面都有所涉及,然而只是报道其中的1~2个方面,而关于上述光合生理指标的系统报道比较少见[5-6]。因此,有必要进一步通过测定光合生理指标,系统地分析玉米的抗旱生理策略。本文研究不同干旱胁迫与复水周期对玉米幼苗光合色素、光合参数、光响应曲线,以及叶绿素荧光参数的影响,分析光合生理指标与干旱胁迫和复水之间的关系,掌握玉米幼苗对干旱胁迫的响应策略,为进一步科学合理地优化玉米生产苗期管理措施提供技术支撑。
1 材料与方法
1.1试验设计
试验采用抗旱玉米品种郑单958,于2018年在西北农林科技大学进行。选取饱满玉米籽粒200粒,配置1/8MS营养液,采用水培法培养,每个培养箱面积30 cm×15 cm。待幼苗长到3叶1心时挑选长势一致的植株120株,配置20% PEG-6000溶液进行干旱胁迫处理。
试验设置4个处理,每处理3次重复,每组幼苗10株。各处理分别如下。①不胁迫处理(CK):一直使用1/8MS营养液培养。②1次干旱胁迫与复水周期(Ⅰ):用20% PEG-6000溶液干旱处理2 d,之后恢复1/8MS营养液培养1 d。③2次干旱胁迫与复水周期(Ⅱ):用20% PEG-6000溶液干旱处理2 d,之后恢复1/8MS营养液培养1 d,重复2个周期。④3次干旱胁迫与复水周期(Ⅲ):用20% PEG-6000溶液干旱处理2 d,之后恢复1/8MS营养液培养1 d,重复3个周期。首先进行处理Ⅲ组玉米幼苗的干旱胁迫,待处理Ⅲ组第一个干旱胁迫和复水周期进行完后,同步进行处理Ⅱ组玉米幼苗的干旱胁迫与复水,最后进行处理Ⅰ组玉米幼苗的干旱胁迫与复水。各处理采样时间统一为最后1次干旱胁迫的复水前和复水后。
1.2测试项目与方法
1.2.1光合色素
随机采集玉米幼苗的自上而下第2~3片完全展开叶用于光合色素的测定。参考高俊凤[7]的方法:叶绿素a、b及类胡萝卜素含量的测定采用丙酮提取,紫外-可见分光光度计比色法。
1.2.2光合参数
选距生长点第2片完全展开叶,使用Li-6400便携式光合测定仪(Li-COR Inc.,USA)于上午9∶00—11∶00测定叶片光合特征参数。测定前先用1 400 μmol/(m2·s)光强光诱导15 min,然后测定净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr),并计算水分利用率(Water Use Efficiency)WUE=Pn/Tr[7]。每组测定5个单植株,每次测量6次重复。干旱胁迫结束后立即测量,并于复水后连续测量3 d,测量时间分别标记为复水前和复水后1、2、3 d。
1.2.3光响应曲线
采用Li-6400便携式光合测定仪于晴天8∶00—11∶00对玉米幼苗进行光响应曲线(Pn-PAR)的测定。找出生长状况良好的植株,每处理测定3株植株,每处理选取长势相同的叶片重复测定3次,取平均值进行分析。测定时叶片温度控制在25 ℃左右,相对湿度70%左右,光合仪中CO2浓度设置为400 μmol/mol,测定时采用红蓝光源,设置2 000、1 800、1 600、1 400、1 200、1 000、800、600、400、200、100、50、20和0 μmol/(m2·s)共14个递减光合有效辐射(Photosynthetically active radiation,PAR)梯度,每个光强梯度下测定2 min。干旱处理结束后测定1次,复水后1 d再测定1次。根据得到的不同光合有效辐射的净光合速率绘制光合速率的光响应(Pn-PAR)曲线,参考李英浩等[8]的方法采用非直角双曲线模型对光响应曲线进行拟合分析。根据实测数据点的走势,参考刘明等[9]的方法计算最大净光合速率(Pnmax)、光饱和点(LSP)、光补偿点(LCP)和暗呼吸速率(Rd)等参数。
1.2.4叶绿素荧光参数
选取生长状况良好的叶片,暗适应30 min后用Li-6400便携式光合测定仪上的荧光探头测定暗适应下最小初始荧光(F0)、最大荧光(Fm)、光化学量子效率(Fv/Fm)。测定完后用1 400 μmol/m2·s光强照射叶片进行光适应,等待读数稳定后测定光适应下最小荧光(F0′)、最大荧光(Fm′)、PSⅡ反应中心实际的光化学效率(Fv′/Fm′)、稳态荧光(Fs)。每组测定5个单植株,每次测6次以上重复。从干旱处理结束后测量1次,然后进行复水,复水后1~2 d每天各测1次。参照BRUGNOLI E等[10]的方法,由以上测定的荧光参数计算PSⅡ最大光化学效率:Fv/Fm=(Fm-F0)/Fm;PSⅡ实际光化学效率:ΦPSⅡ=(Fm′-Fs)/Fm′;光化学猝灭系数:qP=(Fm′-Fs)/(Fm′-F0′);非光化学猝灭系数:qN=(Fm-Fm′)/(Fm-F0′)。
1.3数据处理
数据应用SPSS 22.0软件进行单因素方差分析,并采用LSD和Duncan多重比较法进行显著差异性检验;采用SigmaPlot 12.0作图。
2 结果与分析
2.1光合色素
由图1可知,各处理下玉米幼苗的叶绿素a、叶绿素b和叶绿素总量在复水前、后差异均显著,类胡萝卜素变化较小。复水前,与处理CK相比,不同干旱胁迫周期下叶绿素a均显著降低,处理Ⅱ下降最多为68.57%,处理Ⅰ、Ⅲ分别下降31.43%和28.57%;处理Ⅰ、Ⅱ的叶绿素b较处理CK显著降低23.68%和62.28%;处理Ⅰ、Ⅱ的叶绿素总量较处理CK显著降低25.50%和63.76%;处理Ⅱ的类胡萝卜素较处理CK显著提高29.58%。复水后,处理Ⅰ、Ⅲ的叶绿素a、叶绿素b、叶绿素总量均显著恢复到处理CK水平。处理Ⅱ复水后各指标与处理CK均有显著差异,叶绿素a较处理CK低22.86%,叶绿素b低21.93%,叶绿素总量低49.66%。各处理的类胡萝卜素复水后差异不显著。与复水前相比,复水后处理Ⅰ、Ⅱ的叶绿素a、叶绿素b和叶绿素总量均有所升高,增幅分别占处理CK的40.00%和37.14%,31.58%和40.35%,33.56%和41.61%;处理Ⅲ在复水前后叶绿素a、叶绿素b和叶绿素总量的增幅均最小。以上说明,干旱胁迫处理中,叶绿素a、叶绿素b、叶绿素总量均下降,类胡萝卜素变化相对稳定,其中处理Ⅱ的变化最大。
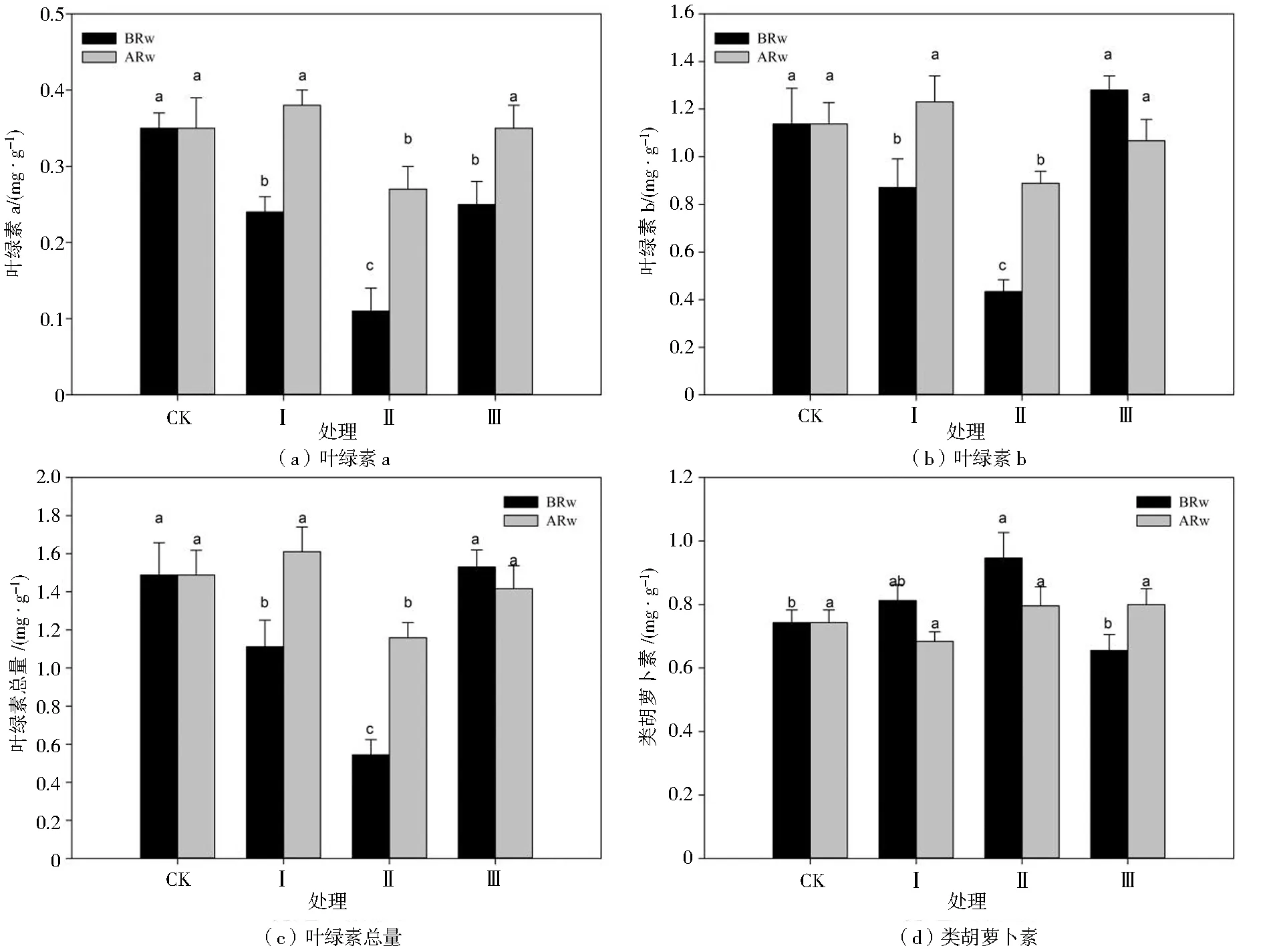
注:BRw为复水前,ARw为复水后;同列不同小写字母表示0.05水平上差异显著(P<0.05),下(图/表)同。图1 不同处理对玉米幼苗叶绿素a、叶绿素b、叶绿素总量和类胡萝卜素含量的影响Fig.1 Effects of different treatments on content of chlorophyll a,chlorophyll b, total chlorophyll and carotenoid of maize seedlings
2.2光合参数
由图2可知,不同干旱胁迫与复水周期对复水前、复水1 d、复水2 d和复水3 d后玉米幼苗Pn、Gs、Ci和Tr的影响显著。玉米幼苗Pn随着干旱胁迫次数的增加逐渐降低,处理Ⅰ、Ⅱ、Ⅲ的Pn分别较处理CK显著降低52.58%、69.07%和78.56%;复水后,各处理的Pn呈现不同的变化趋势,处理Ⅰ逐渐增加,处理Ⅱ先增加后降低,处理Ⅲ持续降低,在复水3 d后出现负值;复水1 d后,处理Ⅰ、Ⅱ、Ⅲ的Pn仍然分别较处理CK显著降低31.79%、27.18%和52.31%;复水2 d后,处理Ⅰ的Pn增加至处理CK水平,处理Ⅱ的Pn较处理CK显著提高29.96%;复水3 d后,处理Ⅰ的Pn继续增加,较处理CK显著提高26.15%,处理Ⅱ的Pn反而大幅度降低,较处理CK显著降低50.77%。
玉米幼苗Gs随着干旱胁迫次数的增加逐渐降低,处理Ⅰ、Ⅱ、Ⅲ的Gs分别较处理CK显著降低17.39%、56.52%和56.52%;复水后,处理Ⅰ、Ⅱ的Gs在复水1 d后稍微降低,而在复水2 和3 d后持续增大,处理Ⅲ的Gs则随着复水时间的延长不断增大。处理CK的Gs在干旱胁迫时期和复水后均显著高于其他处理组。
与Pn和Gs不同的是,处理Ⅲ的Ci在干旱胁迫时期和复水后均显著大于其他处理组。干旱时期,玉米幼苗Ci随着干旱胁迫次数的增加而增大,处理Ⅰ、Ⅱ、Ⅲ的Ci分别较处理CK显著提高154.53%、219.08%和305.69%;复水后,各处理的Ci呈现不同的变化趋势,处理Ⅰ和Ⅱ先降低后增加,处理Ⅲ持续增加;复水3 d后,处理Ⅰ、Ⅱ、Ⅲ的Ci分别较干旱时期增加72.08%、76.50%和123.55%。
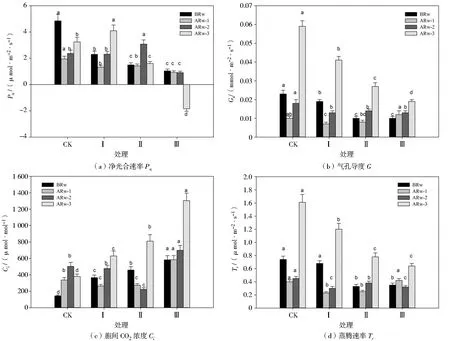
注:ARw-1为复水1 d,ARw-2为复水2 d,ARw-3为复水3 d,下图同。图2 不同处理对玉米幼苗净光合速率、气孔导度、胞间CO2浓度和蒸腾速率的影响Fig.2 Effects of different treatments on content of net photosynthetic rate(Pn),stomatal conductance(Gs), intelcellular CO2 concentration(Ci)and transpiration rate(Tr)of maize seedlings
Tr随着干旱胁迫次数的增加而降低,复水后,处理Ⅰ、Ⅱ的Tr随着复水时间的延长逐渐增加,处理Ⅲ的Tr在复水1 d后恢复到处理CK水平,之后随着复水时间的延长呈现先降低后增加的趋势。处理CK的Tr在干旱胁迫时期和复水后均显著高于其他处理组。
2.3水分利用率
由图3可知,不同干旱胁迫与复水周期对复水前、复水1 d、复水2 d和复水3 d后玉米幼苗叶片水分利用效率WUE的影响均显著。干旱时期,各处理下玉米幼苗WUE均显著降低,处理Ⅰ、Ⅱ、Ⅲ的WUE分别较处理CK显著降低48.17%、30.79%和54.73%;复水后,各处理下的WUE均呈现先增加后降低的趋势。复水1 d后,处理Ⅱ、Ⅰ的WUE较处理CK显著提高15.26%和20.21%,处理Ⅲ的WUE较处理CK降低54.23%;复水2 d后,处理Ⅱ、Ⅰ的WUE较处理CK显著提高53.79%和43.94%,处理Ⅲ的WUE较CK降低46.59%;复水3 d后,处理Ⅰ的WUE较处理CK显著提高70.65%,处理Ⅱ的WUE与处理CK无显著差异,处理Ⅲ的WUE出现负值,较处理CK降低242.29%。总体上,处理Ⅱ的WUE在干旱时期和复水后显著高于其他处理组。
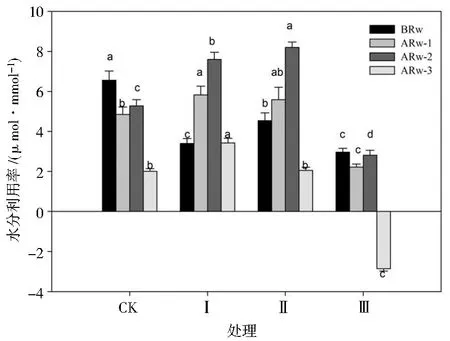
图3 不同处理对玉米幼苗水分利用率的影响Fig.3 Effects of different treatments on water use efficiency of maize seedlings
2.4光响应曲线
由图4可知,干旱胁迫下各处理玉米幼苗的Pn值降低,复水后Pn值总体升高。干旱胁迫下,处理Ⅰ、Ⅱ、Ⅲ的光响应曲线均位于上控制线之下,其Pn值显著小于处理CK,处理CK的光响应曲线总体上位于上控制线之上;处理Ⅰ的光响应曲线全部位于平均线之下,可以看出处理Ⅰ各PAR下玉米幼苗的Pn值均最小;当PAR>800时,Pn随着PAR的增强基本保持平稳,这与处理CK的趋势基本相同;处理Ⅱ的Pn随着PAR的增强基本保持稳定,其光响应曲线在平均线上下波动,但是幅度不大,表明玉米幼苗光能利用能力对轻度、中度干旱胁迫有一定的耐受性。复水后,各处理的光响应曲线均上移,表现出一定的光补偿效应。总体上,处理Ⅱ的光响应曲线位于上控制线之上,处理CK的光响应曲线位于上控制线和平均线之间,处理Ⅲ的光响应曲线在平均线上下小幅度波动,处理Ⅰ的光响应曲线总体上位于平均线以下,各处理Pn随着PAR的增强基本符合处理Ⅱ>处理CK>处理Ⅲ>处理Ⅰ的规律。
表1为通过对光强响应曲线进行回归分析求得的干旱-复水条件下玉米幼苗的光合参数。随着干旱胁迫程度的增强,Pnmax、AQE和Rd呈降低趋势,LCP和LSP呈升高趋势。干旱胁迫下,处理Ⅰ、Ⅱ、Ⅲ的Pnmax分别较处理CK显著降低95.07%、66.69%和75.66%;AQE分别较处理CK显著降低81.55%、63.74%和96.73%;Rd分别较处理CK显著降低11.92%、37.69%和112.31%;处理Ⅰ、Ⅱ、Ⅲ的复水后各处理玉米幼苗的Pnmax显著提高,处理Ⅱ、Ⅲ的Pnmax分别较处理CK显著增大39.05%、22.70%,处理Ⅰ较处理CK显著低26.83%;各处理下玉米幼苗的AQE、LCP、LSP和Rd在复水后则表现出不同的变化趋势,处理Ⅰ、Ⅲ的AQE分别较处理CK显著提高493.84%和191.0%,处理Ⅱ则降低到处理CK水平;处理Ⅰ、Ⅱ的LCP在复水后下降,分别较处理CK显著降低69.47%、40.21%,处理Ⅲ的LCP则较处理CK显著增加280.43%;处理Ⅰ、Ⅱ的LSP在复水后显著提高,分别较处理CK提高81.83%、33.17%,处理Ⅲ显著降低51.97%;处理Ⅰ、Ⅱ的Rd在复水后显著降低,分别较处理CK降低253.57%、10.71%,处理Ⅲ显著提高1246.43%。
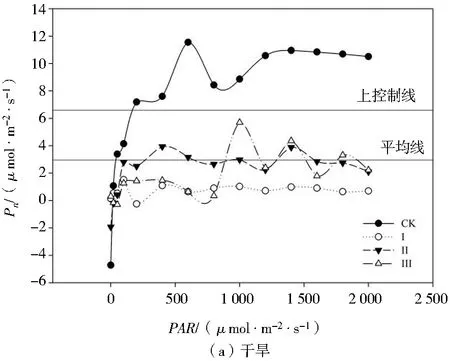
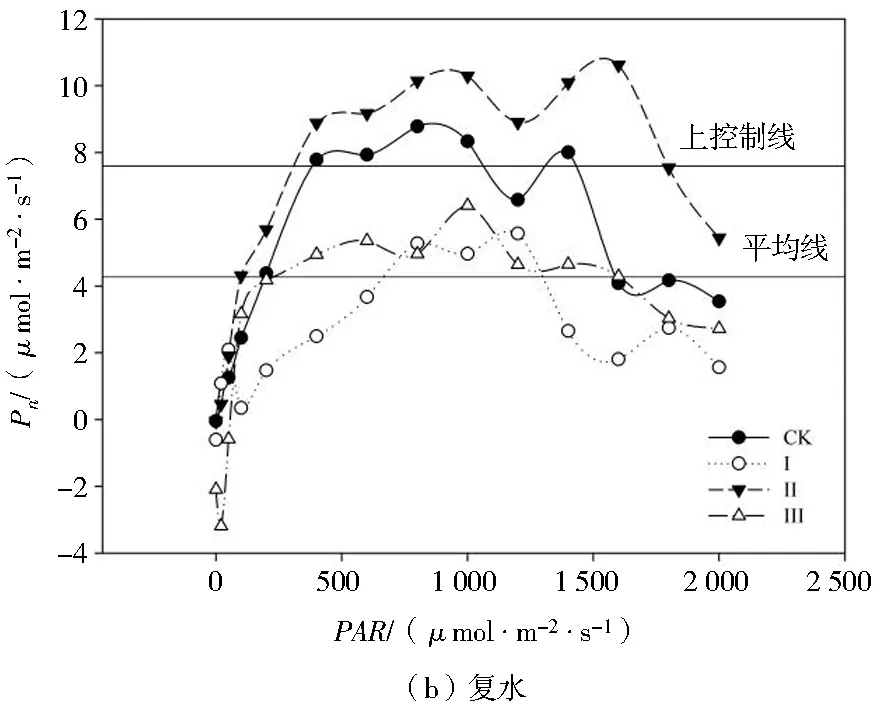
注:上控制线和平均线为SigmaPlot 12.0作图软件自带的基准线,协助用于比较各组数据之间的差异。图4 不同处理对玉米幼苗光响应曲线的影响Fig.4 Effects of different treatments on light response curves of maize seedlings

表1 干旱-复水条件下各处理玉米幼苗的光响应特征参数值
LCP分别较处理CK显著提高265.55%、303.58%和298.43%;LSP分别较处理CK显著提高94.09%、152.46%和391.79%。
2.5光合荧光参数
图5为不同干旱胁迫与复水周期对玉米幼苗叶绿素荧光参数的影响。Fv/Fm是PSⅡ反应中内禀光能的转化效率,能反映PSⅡ利用光能的能力。干旱胁迫时期,处理Ⅰ的Fv/Fm比处理CK显著降低38.15%,复水后恢复到处理CK水平;处理Ⅱ、Ⅲ的Fv/Fm在复水前后与处理CK无显著差异。
ΦPSⅡ能反映植物对吸收的太阳光能的转换能力。qP表示PSⅡ天线色素吸收的光能用于光化学电子传递的份额,反映PSⅡ反应中心的开放程度。图5显示不同干旱复水周期对ΦPSⅡ和qP的影响趋势一致。干旱时期,处理Ⅰ、Ⅱ的ΦPSⅡ和qP分别比处理CK显著降低84.42%、45.66%和46.80%、23.81%,处理Ⅲ的ΦPSⅡ和qP比处理CK显著增加36.11%和27.91%;复水后ΦPSⅡ和qP逐渐回升,处理Ⅰ的ΦPSⅡ和qP在复水后随着时间的延长而逐渐升高,处理Ⅱ、Ⅲ的ΦPSⅡ和qP在复水后均呈现“先升后降”的趋势,处理Ⅱ的ΦPSⅡ和qP在复水后1 d提高到处理CK水平,而复水后2 d的ΦPSⅡ却比处理CK显著降低23.90%,qP与处理CK无显著差异;处理Ⅲ的ΦPSⅡ和qP在复水后1 d分别较处理CK显著提高42.03%和36.28%,复水后2 d的ΦPSⅡ降低到处理CK水平,qP有所降低,但仍比处理CK显著高26.93%。
qN表示天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的部分,是一种保护机制,对植物光合机构免受破坏起到积极的推动作用。玉米幼苗的qN在复水前后均显著提高。复水前,各处理的qN呈现处理Ⅰ>处理Ⅱ>处理Ⅲ>处理CK的规律;复水后qN继续升高,于复水后1 d升高到最高水平,处理Ⅰ、Ⅱ、Ⅲ的qN分别比处理CK显著提高34.96%、18.41%和12.15%;各处理qN于复水后2 d有所降低,但仍显著高于处理CK水平。
3 讨论与结论
光合作用是玉米生长发育和产量形成最重要的生理代谢过程,分析干旱胁迫和复水条件下光合作用的可塑性是确定作物对水分敏感性的有效方法[11]。光合色素具有吸收和传递光能的作用,其含量的变化在一定程度上反映出植物的光合特性[12]。水分利用效率(WUE)能够反映出植物光合和蒸腾之间的关系。干旱胁迫下植物体内水分亏缺会降低WUE,引起植物体内光合色素减少,光合速率和蒸腾速率降低,导致光系统Ⅱ受损,抑制光合作用[13]。
本试验中,随着干旱胁迫周期的增加,玉米幼苗叶绿素和类胡萝卜素含量分别呈现先减少后增加和先增加后减少的趋势;Pn、Gs和Tr显著下降,Ci显著升高,说明干旱胁迫下Pn降低主要是由叶肉细胞光合能力降低引起的非气孔因素导致的,这与杨建伟等[14]对麻叶绣线菊的研究结果一致。Pn和Tr的显著下降导致WUE显著降低,说明干旱胁迫抑制了叶绿素的合成,进而抑制了玉米幼苗的光合作用,导致同化物减少,抑制了玉米幼苗的生长[15]。复水后,处理Ⅰ的1次干旱后恢复供水对植物的损伤可在2~3 d内得到恢复,叶绿体色素含量与对照没有显著差异。处理Ⅱ的2次持续的干旱周期在恢复供水后造成的损伤体现在叶绿素含量的显著降低和气孔在恢复供水后的控制,其恢复供水后的补偿性吸水更显著。此时,植物不得不通过保护性物质,如胡萝卜素含量的提升来抵御干旱胁迫,这种适应使得植物在复水后有更快的恢复光合的能力,但这种损伤程度较重,因此恢复光合的能力也不具备持续性[16]。而处理Ⅲ的3次连续的干旱周期下,玉米幼苗在完成了保护性物质积累后依然无法抵御干旱逆境而表现出:叶绿素含量弥补性恢复,保护性物质胡萝卜素含量降低,复水3 d后各处理Gs和Ci呈现出显著差异,说明植物对严重干旱胁迫的记忆持续时间较长,且反复的干旱胁迫会加重对叶片气孔的控制,植物不得不以降低Tr的方式来控制Gs,进而造成光合的损失[17]。细胞间CO2积累,表明即使有足够的CO2植物也无法提升光合速率,因此Pn依然非常低,WUE也不断降低,甚至出现负值。说明,轻度和适度干旱胁迫后恢复供水对植物具有一定的补偿效应,而重度干旱胁迫可能对植物造成不可逆的伤害,导致植物体内代谢紊乱,即使恢复供水也难以补救[18-19]。
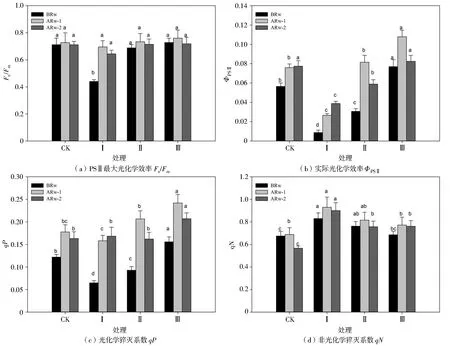
图5 不同处理对玉米幼苗叶绿素荧光参数的影响Fig.5 Effects of different treatments on chlorophyll fluorescence parameters of maize seedlings
通过Pn-PAR曲线回归分析计算的Pnmax、AQE、LCP、LSP和Rd等光合参数也可以用来反映植物对光能的利用能力[20]。表观量子效率AQE越大,植物对光能的利用能力越高;LCP越小,植物对弱光的利用能力越强;LSP越大,植物对强光的利用能力越强[21]。邓沛怡等[13]研究表明,干旱胁迫下6种藤本植物的Pnmax、AQE、LCP、LSP和Rd的值随着干旱胁迫的加重整体降低。本试验中,干旱胁迫导致玉米幼苗Pnmax、AQE和Rd显著降低,LCP明显增加,表明干旱胁迫下玉米幼苗的光合生态幅会收窄,对光能的利用效率会降低,这与王彬等[22]的研究结果一致。此外,玉米通过减弱呼吸作用,可以在一定程度上减少对光合产物的消耗,从而积累有机物去抵御干旱胁迫,这些可能是玉米幼苗适应干旱逆境的光合生理策略[23]。
叶绿素荧光参数作为光合作用内在的有效探针,可以直接反映干旱胁迫下植物的叶绿体功能和光合特性,是研究植物抗旱性的良好指标[24]。叶绿素荧光技术所检测到的叶绿素荧光信息主要是来自于植物叶绿体PSⅡ反应中心天线色素蛋白复合体中的叶绿素a分子[25]。植物在干旱胁迫下,光系统Ⅱ被破坏后,进行光化学反应的质体醌数量减少,降低了相对电子传递速率和植物叶片细胞产生电子的能力,导致最大光化学效率(Fv/Fm)和实际光化学效率(ΦPSⅡ)降低,进而限制了叶片的CO2同化作用,降低光能利用率,产生过剩光能,为避免过量的光能带来的伤害,植物体通过增加qN以热的形式来猝灭多余的能量,从而起到保护的作用,增强光系统Ⅱ对环境的适应性[26]。本试验中,处理Ⅰ下玉米幼苗的Fv/Fm、ΦPSⅡ和qP在干旱胁迫下均显著降低,qN显著增加;复水后,Fv/Fm在复水后1 d就恢复到对照水平,ΦPSⅡ和qP逐渐增加,说明1次干旱复水周期下玉米幼苗出现光抑制现象,但这种现象是可逆的,此时玉米幼苗能够通过快速增加qN来启动光保护系统,减轻过量光能对光系统的伤害,这与张玉玉等[27]对侧柏幼苗叶绿素荧光参数的研究结果一致。处理Ⅱ下玉米幼苗的ΦPSⅡ和qP在干旱胁迫下显著降低,复水后2 d呈现先增加后降低的趋势,与处理Ⅰ相比,处理Ⅱ的qN在复水前后的变化幅度也较小,说明2次干旱胁迫周期下玉米幼苗光保护机制可能出现一定破坏,复水后没有及时恢复,进一步说明2次干旱胁迫周期可能将要超过植株对逆境胁迫的耐受生态幅[28]。经过前面连续2次的干旱胁迫与复水周期,玉米幼苗体内已经出现一定的“胁迫记忆”,在面对第3次干旱胁迫时,植株调动所有能量来面对干旱胁迫,因此,处理Ⅲ的实际光化学效率ΦPSⅡ和qP显著升高,但Fv/Fm和qN变化都不显著[17]。连续3次的干旱胁迫导致玉米幼苗PSⅡ活性中心受损更加严重,叶片光合活性进一步降低,植物体内出现严重的生理紊乱,导致PSⅡ光合中心光抑制严重。这一结论刚好与叶绿素含量的变化相呼应,进一步说明重度干旱胁迫对植物造成了不可逆的伤害,即使恢复供水也难以补救。
综上表明,复水对少量干旱胁迫次数下玉米幼苗干旱锻炼具有正向补偿效应;玉米在蹲苗时应严格控制干旱胁迫的次数,避免因干旱次数太过对玉米造成损伤,影响幼苗生长。

