AcMNPV LEF-10第21位突变对其活性的影响
王 鑫,许晓东
(西北农林科技大学 生命科学学院,陕西 杨凌 712100)
杆状病毒(baculoviruses)是一类具有囊膜包被的DNA病毒,编码90~180个基因,是目前研究发现的最大一类节肢动物特异性病毒[1]。同其他大型DNA病毒一样,杆状病毒基因表达也具有时序性[2]。根据表达时间的先后,将杆状病毒基因分为早期基因、晚期基因和极晚期基因3种。其中早期基因表达依赖于宿主的RNA聚合酶Ⅱ转录,晚期基因表达依赖于杆状病毒自身编码的RNA聚合酶转录[3]。
苜蓿银纹夜蛾核型多角体病毒(Autographacalifornicamultiple nucleopolyhedrovirus,AcMNPV)是杆状病毒的模式种,编码154个基因。20世纪90年代,科学家通过瞬时表达试验鉴定出能够参与AcMNPV晚期表达调控的基因。到目前为止,已经鉴定出19个晚期表达因子(late expression factor,LEF)[4-5]。其中,LEF-1[6]、LEF-2[7]、LEF-3[8-9]、lef-7[10]、LEF-11[11]、IE1[12]、ie2[13]、p35[14]、P143[8]、dnapol[14]与DNA复制相关,lef-4[15]、LEF-5[16]、LEF-6[17]、lef-8[15]、lef-9[15]、LEF-10[18]、lef-12[19]、p47[15]和pp31[20]与晚期基因转录相关。
所有Group Ⅰ组和大部分Group Ⅱ的nuclear polyhedroviruses(NPVs)和granulosis viruses(GVs)基因组中均鉴定出LEF-10的同源基因[5]。AcMNPV编码的LEF-10由78个氨基酸组成,分子质量为8.6 ku。在AcMNPV bacmid和家蚕核型多角体病毒(Bombyxmorinuclear polyhydrosis virus,BmNPV) bacmid中,敲除lef-10基因后病毒无法存活[21-22],表明lef-10是病毒复制的必需基因。研究发现LEF-10具有朊病毒特性,其保守的第21位氨基酸残基突变成丙氨酸残基时能降低LEF-10蛋白的聚集倾向,并最终影响晚期报告基因的表达[23]。即以高感染复数(MOI)感染宿主细胞时,晚期报告基因的表达效率大大提高。
研究发现,LEF-10蛋白的氨基末端是必需的[24],而其第21位氨基酸残基突变为丙氨酸残基时影响LEF-10蛋白的聚集状态[23]。为了探究LEF-10第21位不同氨基酸残基对AcMNPV活性的影响,本研究对该位点进行饱和突变,并通过异位回补和原位突变两种方式构建重组苜蓿银纹夜蛾核型多角体病毒,检测重组病毒的活性,为深入研究LEF-10的朊病毒特性及其在病毒复制周期中的作用奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌株、质粒、细胞系 大肠杆菌HS996(EscherichiacoliHS996)(含有AcMNPV bacmid和pSC101重组酶质粒),由英国雷丁大学(University of Reading)Prof. Ian Jones实验室馈赠;pTriEx-p(lef-10)-LEF-10-GFP-p(p10)-dsRed质粒、BacmidΔlef-10、prpsL-AMP质粒、pTriEx-p(p10)-dsRed质粒、大肠杆菌Top10(EscherichiacoliTop10)和草地贪夜蛾Sf9细胞系,均由西北农林科技大学生命科学学院分子病毒学实验室保存。
1.1.2 主要试剂 SanPrep柱式质粒DNA小量抽提试剂盒、SanPrep柱式DNA胶回收试剂盒,购于上海生工生物工程有限公司;2×EsTaqMaster Mix,购于康维世纪公司;T4 DNA连接酶、BamH Ⅰ、PshA Ⅰ、Bsu36 Ⅰ、RNaseA酶,购于美国纽英伦生物技术公司(NEB);DL5000 DNA Marker,购于北京擎科生物科技有限公司;蛋白胨、酵母浸粉,购于北京奥博星生物技术有限公司;琼脂粉、DNA抽提试剂(体积比苯酚∶氯仿∶异戊醇=25∶24∶1,pH>7.8),购于北京索莱宝科技有限公司;L-阿拉伯糖,购于Wolsen公司;SFX-INSECT培养基、胎牛血清,购于Thermo Fisher公司;FuGENE HD转染试剂,购于Promega公司。
1.1.3 引物的设计与合成 本试验所用引物(表1)均用SnapGene软件设计,由苏州金维智生物科技有限公司和北京擎科生物科技有限公司合成。

表1 研究所用PCR引物Table 1 PCR primers used in this study

表1(续) Continued table 1
1.2 构建异位回补lef-10L21X的重组病毒(X代表19种不同的氨基酸残基)
为了检测LEF-10第21位对AcMNPV活性的影响,本试验将pTriEx-p(lef-10)-LEF-10-GFP-p(p10)-dsRed质粒上LEF-10的第21位亮氨酸残基饱和突变为其他19种氨基酸残基,再与敲除了lef-10的Bacmid(BacmidΔlef-10)进行共转染,得到重组病毒lef-10L21XBacmid,检测第21位上不同氨基酸残基能否回补缺陷的BacmidΔlef-10。
1.2.1 19种lef-10L21X片段的PCR扩增 LEF-10第21位的点突变通过PCR引物引入。以pTriEx-p(lef-10)-LEF-10-GFP-p(p10)-dsRed质粒为模板,分别用上游引物(PshAI_G、PshAI_I、PshAI_P、PshAI_V、PshAI_F、PshAI_W、PshAI_Y、PshAI_D、PshAI_E、PshAI_R、PshAI_H、PshAI_K、PshAI_S、PshAI_T、PshAI_C、PshAI_M、PshAI_N、PshAI_Q、PshAI_A)和下游引物(BamHI-lef10-R)进行PCR扩增。PCR扩增体系为:2×EsTaqMaster Mix 10 μL,10 μmol/L的上游引物1 μL,10 μmol/L的下游引物1 μL,模板1 μL,ddH2O 7 μL。PCR反应条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸20 s,35个循环;72 ℃再延伸10 min。用SanPrep柱式DNA胶回收试剂盒对PCR产物进行回收,用1%琼脂糖凝胶电泳检测回收片段,将回收后的PCR产物置于-20 ℃保存。
1.2.2 pTriEx-p(lef-10)-LEF-10L21X-GFP-p(p10)-dsRed质粒的构建 使用限制性内切酶PshA Ⅰ、BamH Ⅰ对1.2.1节中回收的PCR产物和pTriEx-p(lef-10)-LEF-10-GFP-p(p10)-dsRed质粒进行双酶切,用SanPrep柱式DNA胶回收试剂盒对酶切产物进行回收。使用T4 DNA连接酶将适宜浓度的片段与载体进行连接,将连接产物用热激法转入大肠杆菌Top10感受态并进行复苏。复苏完成后,将细胞涂布于含有氨苄青霉素(终质量浓度为50 μg/mL)的平板,倒置,37 ℃培养箱培养过夜。因点突变不会改变基因片段的大小,故无法通过双酶切验证。使用SanPrep柱式质粒DNA小量抽提试剂盒提取质粒,将提取好的质粒送北京擎科生物科技有限公司进行测序鉴定,构建正确的质粒命名为pTriEx-p(lef-10)-LEF-10L21X-GFP-p(p10)-dsRed。
1.2.3 异位回补重组病毒的构建 将构建好的pTriEx-p(lef-10)-LEF-10L21X-GFP-p(p10)-dsRed质粒与线性化的BacmidΔlef-10共转染草地贪夜蛾Sf9细胞,获得重组病毒。转染步骤为:将Sf9细胞铺入12孔板中,细胞汇合度约为70%。分别向两个无菌的1.5 mL离心管加入70 μL ddH2O,再向其中一管中加入5 μL的转染试剂,向另一管中加入5 μL线性化BacmidΔlef-10和2 μL pTriEx-p(lef-10)-LEF-10L21X-GFP-p(p10)-dsRed质粒。将两管分别混匀后,再将前管混合物加入后管再次混匀,室温静置15~20 min后逐滴加入到细胞培养皿中,28 ℃静置培养5~7 d。使用荧光倒置显微镜进行观察并拍照,收集病毒上清,传代2次,得到P2代重组病毒,于-4 ℃保存。
1.3 原位突变lef-10L21X重组病毒的构建
为避免异位回补产生位置效应,本试验直接在Bacmid上进行原位突变,构建重组病毒(Bacmidlef-10L21X),检测LEF-10第21位氨基酸残基对AcMNPV活性的影响。
1.3.1 含lef-10两侧同源臂的rpsL-AMP DNA片段的PCR扩增 以prpsL-AMP质粒为模板,用上游引物Bac-lef10-F和下游引物Bac-lef10-R进行PCR扩增,扩增体系和反应条件同1.2.1节(延伸时间改为60 s)。用SanPrep柱式DNA胶回收试剂盒对PCR产物进行回收,用1%琼脂糖凝胶电泳检测回收片段,置于-20 ℃保存。
1.3.2 AcMNPV中lef-10基因的敲除 将-80 ℃冻存的大肠杆菌HS996(含有AcMNPV bacmid和pSC101重组质粒)菌液在含有四环素(3 μg/mL)和卡那霉素(15 μg/mL)的LB固体培养基上进行划线,30 ℃避光过夜培养。挑取单克隆至含四环素(3 μg/mL)和卡那霉素(15 μg/mL)的5 mL LB液体培养基,于30 ℃、250 r/min避光过夜培养。以体积比1∶100将菌液转接到含卡那霉素和四环素的5 mL LB液体培养基中,于30 ℃、250 r/min避光培养至OD600值为0.2~0.3时,向离心管中加入50 μL质量分数为10%的L-阿拉伯糖诱导表达重组酶,继续于37 ℃、250 r/min避光培养45 min。根据Counter-Selection BAC Modification Kit手册制备EscherichiacoliHS996感受态[25]。吸取1 μL 1.3.1节中所得PCR片段与E.coliHS996感受态混匀后,加入预冷的电转杯中进行转化,电压设置为1 300 V。电击后向电转杯中加入1 mL LB液体培养基重悬菌液进行复苏,于37 ℃、220 r/min避光培养60 min。最后涂布于含有氨苄青霉素(50 μg/mL)、卡那霉素(15 μg/mL)和四环素(3 μg/mL)的LB固体培养基上,倒置,于30 ℃培养箱避光培养36~48 h。
1.3.3 敲除lef-10基因菌落的筛选 挑取单克隆进行菌落PCR筛选。以UT-LEF10和1stUT作为筛选引物。PCR反应体系与条件同1.2.1节。用1%琼脂糖凝胶电泳检测,将阳性菌落接种于5 mL含氨苄青霉素(50 μg/mL)、卡那霉素(15 μg/mL)和四环素(3 μg/mL)的液体培养基中,30 ℃、250 r/min避光过夜培养,将菌液在终体积分数为25%的甘油中,于-80 ℃保存。
1.3.4 含有同源臂lef-10L21X片段的PCR扩增 以不同的pTriEx-p(lef-10)-LEF-10L21X-GFP-p(p10)-dsRed质粒为模板,用上游引物FS-L21-F和下游引物FS-L21-R进行PCR扩增。PCR反应体系与条件同1.2.1节。用SanPrep柱式DNA胶回收试剂盒对PCR产物进行回收,用1%琼脂糖凝胶电泳检测回收片段,于-20 ℃保存。
1.3.5 将lef-10L21X片段反筛回AcMNPV 将1.3.3 节中得到的阳性菌落与1.3.4节中得到的lef-10L21X片段进行同源重组,摇菌时使用含有氨苄青霉素(50 μg/mL)、卡那霉素(15 μg/mL)和四环素(3 μg/mL)的液体培养基,最后涂布于含有卡那霉素(15 μg/mL)、四环素(3 μg/mL)和链霉素(50 μg/mL)的平板上,其他步骤同1.3.2节。
1.3.6 反筛lef-10L21XAcMNPV的筛选 挑取菌苔上的单克隆进行菌落PCR筛选。以PshAI-G和BamHⅠ-lef10-R作为筛选引物。PCR反应体系与条件同1.2.1节。用1%琼脂糖凝胶电泳检测,并将PCR产物送北京擎科生物科技有限公司进行测序,以确定插入片段的序列。将测序正确的阳性菌落接种于5 mL含卡那霉素(15 μg/mL)、四环素(3 μg/mL)和链霉素(50 μg/mL)的LB液体培养基中,于30 ℃、250 r/min避光过夜培养,将菌液在终体积分数为25%的甘油中,于-80 ℃保存。
1.3.7 原位突变重组病毒的构建 提取20种Bacmidlef-10L21X杆粒,用Bsu36 Ⅰ酶切线性化并用0.7%琼脂糖凝胶电泳检测后,分别与pTriEx-p(p10)-dsRed质粒共转染草地贪夜蛾Sf9细胞。转染步骤同1.2.3节。传代2次,得到P2代重组病毒,于4 ℃保存。
1.4 病毒滴度测定
采用极限稀释法[26]测定重组病毒的滴度。将Sf9细胞铺入96孔板,每孔100 μL培养基。将1.3.7节中的重组病毒依次10倍稀释至10-9稀释度。将10 μL重组病毒稀释液加入96孔板中,每种病毒3个技术重复和3个生物学重复。28 ℃培养7 d,通过荧光显微镜观察96孔板中细胞产生荧光孔的数目,并根据Reed-Muench两氏法计算病毒的滴度TCID50。
1.5 重组病毒对外源蛋白表达影响的检测
将Sf9细胞铺入12孔板,将1.3.7节中的重组病毒P2分别以MOI=1和MOI=10感染草地贪夜蛾Sf9细胞,28 ℃培养3 d后收集细胞,通过流式细胞仪检测dsRed荧光蛋白的表达情况,并用NovoExpress软件分析数据和作图。
2 结果与分析
2.1 lef-10L21X Bacmid转染和感染Sf9细胞
将构建好的pTriEx-p(lef-10)-LEF-10L21X-GFP-p(p10)-dsRed质粒与线性化的BacmidΔlef-10共转染Sf9细胞,通过同源重组产生重组病毒。其中绿色荧光蛋白(GFP)由lef-10启动子启动(信号弱),红色荧光蛋白(dsRed)由p10启动子启动(信号强),故本试验利用红色荧光蛋白的表达及病毒能否传代,检测判断LEF-10第21位上突变的不同氨基酸残基对AcMNPV活性的影响,结果如图1所示。从图1可以看出,lef-10 Bacmid、lef-10L21IBacmid、lef-10L21ABacmid、lef-10L21FBacmid、lef-10L21CBacmid、lef-10L21MBacmid、lef-10L21VBacmid 7种异位突变型重组病毒出现二次感染。

图1 20种异位回补重组病毒转染Sf9细胞荧光显微观察Fig.1 Fluorescence microscopic observation of Sf9 cells transfected by 20 ectopic backfilling recombinant viruses
用20种重组病毒感染Sf9细胞时,与预期一致,只有上述7种重组病毒产生荧光信号,即成功感染Sf9细胞(图2)。

图2 异位回补重组病毒感染Sf9细胞荧光显微观察Fig.2 Fluorescence microscopic observation of Sf9 cells infected by ectopic backfilling recombinant viruses
2.2 rpsL-AMP DNA片段的扩增
以prpsL-AMP质粒为模板,通过PCR扩增含有lef-10基因两侧同源臂的rpsL-AMP DNA片段,得到1 493 bp的特异性片段(图3),与预期结果一致。
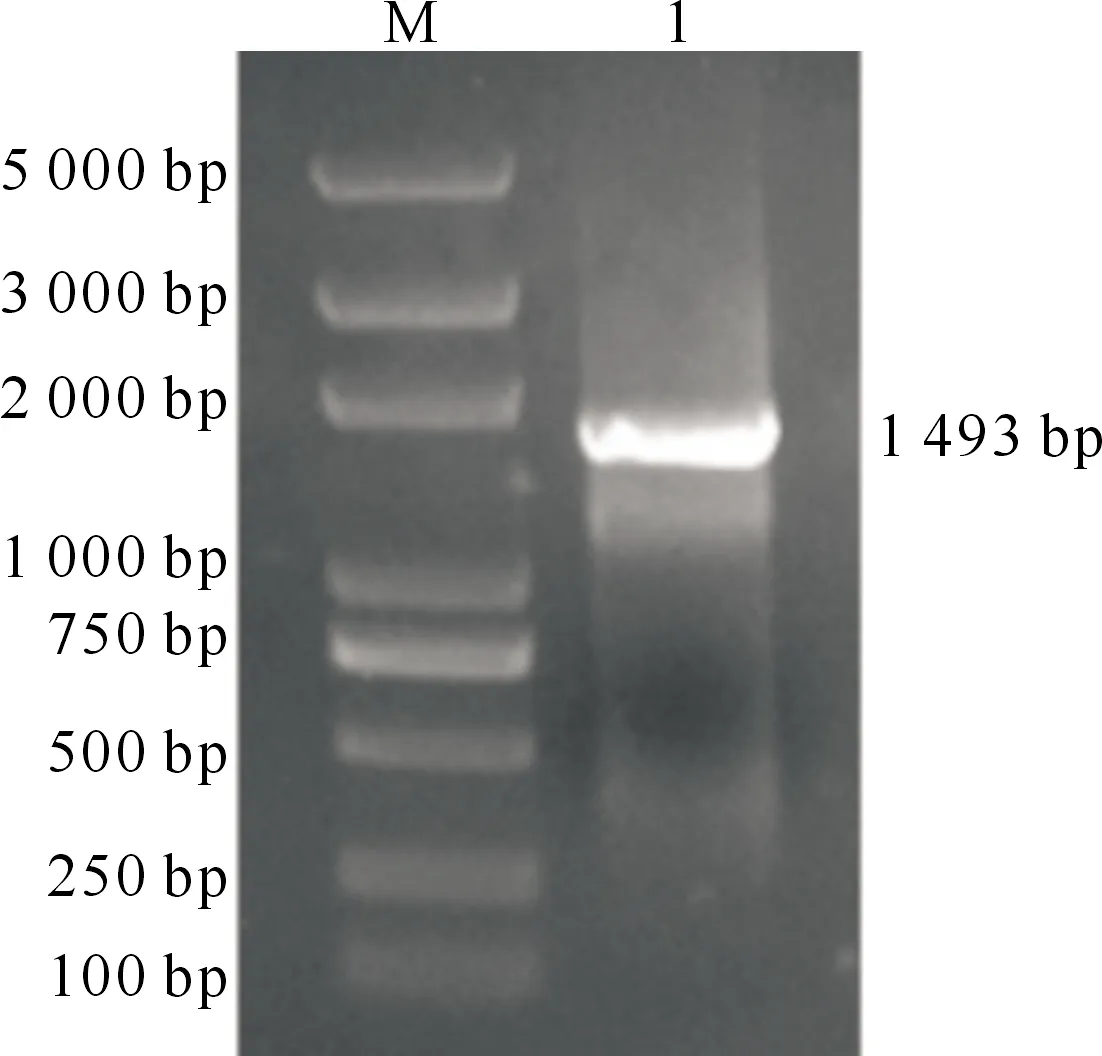
M.DNA Marker;1.rpsL-AMP DNA片段M.DNA Marker;1.rpsL-AMP DNA fragment图3 rpsL-AMP DNA片段的PCR扩增Fig.3 PCR amplification of rpsL-AMP DNA fragment
2.3 敲除lef-10基因的AcMNPV阳性菌落鉴定
通过菌落PCR筛选在氨苄青霉素抗性平板上的阳性菌落,引物设计原则为2条引物分别结合敲除位点的上游/下游和插入基因,因此如无扩增条带则说明敲除失败,如扩增出与预期大小一致的条带则说明敲除成功。PCR扩增得到的DNA片段大小为328 bp(图4),与预期相符,证明筛选结果为阳性的菌落中,lef-10基因已被rpsL-AMP DNA片段成功替换。

M.DNA Marker;1~2.敲除lef-10基因的阳性菌落M.DNA Marker;1-2.Positive colonyof knock-out lef-10 gene图4 敲除lef-10基因的阳性菌落PCR鉴定Fig.4 Identification of positive colonies knock-out lef-10 gene by PCR
2.4 反筛AcMNPV lef-10L21X阳性菌落的鉴定
通过菌落PCR筛选在链霉素抗性平板中的阳性菌落。引物设计原则同2.3节。PCR扩增的DNA片段大小为216 bp,符合预期大小(图5),且PCR产物测序结果也符合预期,表明rpsL-AMP DNA片段成功被lef-10L21X片段替换。

M.DNA Marker;1~19.依次为lef-10L21G、lef-10L21I、lef-10L21P、lef-10L21V、lef-10L21F、lef-10L21W、lef-10L21Y、lef-10L21D、lef-10L21E、lef-10L21R、lef-10L21H、lef-10L21K、lef-10L21S、lef-10L21T、lef-10L21C、lef-10L21M、lef-10L21N、lef-10L21Q、lef-10L21A的阳性菌落M.DNA Marker;1-19.In order of lef-10L21G,lef-10L21I,lef-10L21P,lef-10L21V,lef-10L21F,lef-10L21W,lef-10L21Y,lef-10L21D,lef-10L21E,lef-10L21R,lef-10L21H,lef-10L21K,lef-10L21S,lef-10L21T,lef-10L21C,lef-10L21M,lef-10L21N,lef-10L21Q,lef-10L21A positive colony,respectively图5 lef-10L21X反筛阳性菌落的PCR鉴定Fig.5 Identification of lef-10L21X reverse sieving positive colony
2.5 Bacmid lef-10L21X重组病毒的检测
将Bacmidlef-10L21X与pTriEx-p(p10)-dsRed质粒共转染Sf9细胞,通过同源重组产生重组杆状病毒,利用红色荧光蛋白(dsRed)的表达和病毒能否传代来判断LEF-10第21位不同氨基酸残基原位突变是否会影响AcMNPV的活性。从图6和图7可以看出,Bacmidlef-10、Bacmidlef-10L21I、Bacmidlef-10L21A、Bacmidlef-10L21F、Bacmidlef-10L21C、Bacmidlef-10L21M、Bacmidlef-10L21V7种原位突变型重组病毒能产生有感染活性的子代病毒。这与2.1节中异位突变型重组病毒的结果一致,说明当LEF-10第21位突变为除上述7种氨基酸残基外的其他氨基酸残基时,无法获得重组病毒,即为致死突变。同时说明第21位不同氨基酸残基对LEF-10活性的影响无位置效应。

图6 20种原位突变重组病毒转染Sf9细胞荧光显微观察Fig.6 Fluorescence microscopic observation of Sf9 cells transfected by 20 situ mutant recombinant viruses
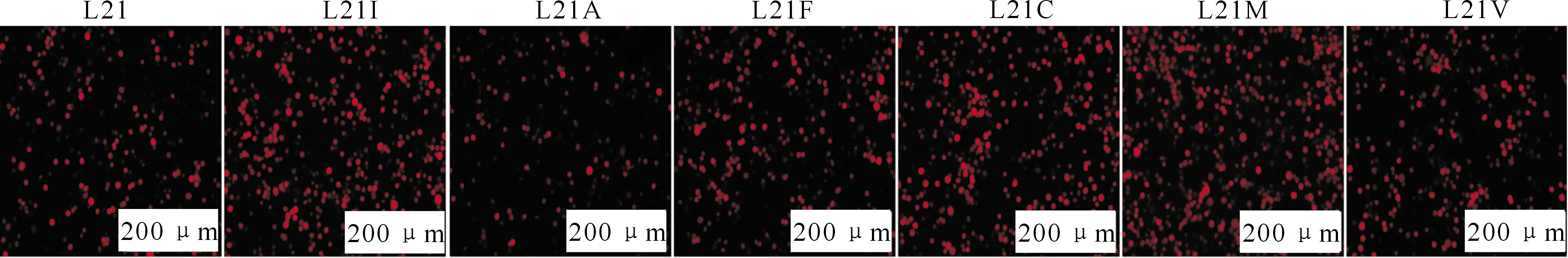
图7 原位突变重组病毒感染Sf9细胞荧光显微观察Fig.7 Fluorescence microscopic observation of Sf9 cells infected by situ mutant recombinant viruses
2.6 Bacmid lef-10L21X重组病毒对外源蛋白表达的影响
利用极限稀释法测定7种原位突变重组病毒的病毒滴度,结果如下:
Bacmidlef-10(TCID50)=1.2×108/mL-1;
Bacmidlef-10L21A(TCID50)=8×107/mL-1;
Bacmidlef-10L21F(TCID50)=1.1×108/mL-1;
Bacmidlef-10L21M(TCID50)=8.8×107/mL-1;
Bacmidlef-10L21V(TCID50)=9.7×107/mL-1;
Bacmidlef-10L21C(TCID50)=7×107/mL-1;
Bacmidlef-10L21I(TCID50)=8.4×107/mL-1。
将7种原位突变重组病毒分别以MOI=1和MOI=10感染Sf9细胞,并通过流式细胞仪检测dsRed荧光蛋白的表达量,检测结果(图8)表明:将7种重组病毒以低MOI(MOI=1)感染Sf9细胞时,晚期基因的表达量差异较小;将7种重组病毒以高MOI(MOI=10)感染Sf9细胞时,Bacmidlef-10、Bacmidlef-10L21M、Bacmidlef-10L21V的外源蛋白表达量明显低于其他4种重组病毒;其中Bacmidlef-10L21A重组病毒的外源蛋白表达量维持在较高水平上。上述结果表明,Bacmidlef-10L21A重组病毒可能在表达外源蛋白时具有优势。

A.以MOI=1感染Sf9细胞;B.以MOI=10感染Sf9细胞SF9为未感染的Sf9细胞;L21~L21I分别为7种重组病毒感染的Sf9细胞A.Infect Sf9 cells with MOI=1;B.Infect Sf9 cells with MOI=10 SF9 is uninfected Sf9 cells;L21-L21I are Sf9 cells infected by 7 recombinant viruses,respectively图8 Bacmid lef-10L21X重组病毒表达外源蛋白的流式细胞仪检测结果Fig.8 Flow cytometry results of foreign proteins expression of Bacmid lef-10L21X recombinant viruses
3 讨 论
作为最小的杆状病毒晚期表达因子,LEF-10与杆状病毒晚期基因的转录有关[24]。但目前为止对于LEF-10的研究较少,对LEF-10调节病毒晚期基因表达的机制尚不清楚。敲除AcMNPV中的lef-10不能获得重组病毒,这一现象在BmNPV中也同样存在[18],这暗示着lef-10是一个必需基因。已有研究表明,LEF-10是第一个被发现的由病毒编码的朊病毒,具有朊病毒特性。当LEF-10高表达时会诱导自身聚集,这种聚集会导致部分LEF-10功能的丧失,进而影响病毒晚期基因的表达[23]。序列分析表明,LEF-10序列中,47%的氨基酸残基是疏水性氨基酸残基,且保守氨基酸残基多为疏水性氨基酸残基[24],这可能与其聚集现象有关。当蛋白质发生聚集时,其疏水氨基酸会呈现在聚集体表面,加剧蛋白质聚集,故改变蛋白质的疏水性也许能调节蛋白质的聚集倾向。针对28种LEF-10的同源基因进行序列比对后得知,LEF-10第21位的亮氨酸(疏水氨基酸)残基为完全保守的位点,将其突变为丙氨酸(疏水氨基酸)残基时,LEF-10的聚集倾向降低,但这只是疏水氨基酸之间的替换,所以对第21位氨基酸残基进行饱和突变将更具说服力。本研究发现,当将LEF-10第21位氨基酸残基进行饱和突变后外源过表达回补缺陷型病毒时,大多数突变体对AcMNPV来说是致死的,只有野生型及突变为I、V、F、C、M和A的6种氨基酸残基能够获得有活性的重组病毒。为了避免异位回补引入的位置效应,笔者还对lef-10进行内源原位回补突变,且得到一致的结论。值得注意的是,7种氨基酸中除半胱氨酸为亲水氨基酸外其他均为疏水氨基酸。这个结果证实第21位氨基酸残基位对LEF-10的功能起着至关重要的作用,且从活性上讲该位点可能需要一个疏水氨基酸残基,虽然该位点为半胱氨酸残基时也能拯救病毒,但具体机制尚不清楚。
LEF-10作为晚期表达因子,能够调控其他晚期基因的表达,因此以LEF-10突变体作为研究对象对LEF-10功能的研究具有重要意义。本研究构建原位突变重组病毒后通过p10启动子启动报告基因的表达,以此检测不同LEF-10突变体对晚期基因表达的影响。当将病毒以1 MOI感染Sf9细胞时,7种不同氨基酸残基对晚期基因表达的影响无显著差异;当将病毒以10 MOI感染Sf9细胞时,报告基因的表达量均有不同程度下降,但6个突变型病毒的活性均明显高于野生型病毒,其中突变成丙氨酸残基的重组病毒(Bacmidlef-10L21A)报告基因表达量仍维持在较高水平,这与之前报道相符[23]。这可能是因为丙氨酸短侧链降低了蛋白质的聚集倾向,进而提高了报告基因的表达量。杆状病毒表达系统存在一个不可忽视的局限,即在一定的MOI范围内,外源蛋白的产量随着MOI的提高而增加,但当MOI提高到一定程度后,外源蛋白的产量反而会随MOI的提高而下降。LEF-10L21A聚集倾向的降低,很可能是突破高MOI下杆状病毒表达系统限制的有效方法。通过研究LEF-10第21位点突变对AcMNPV活性的影响,为进一步探究LEF-10的朊病毒特性及其在病毒复制中的作用奠定了基础,并可为优化杆状病毒表达载体提供参考。

