分蘖洋葱微鳞茎盘快繁技术体系建立
苏雪娇,王秀峰,张 悦,王学国,王健鹂,藤 巍,宋述尧
(1吉林农业大学 园艺学院,吉林 长春 130118;2吉林省蔬菜花卉科学研究院,吉林 长春 130033)
分蘖洋葱(AlliumcepaL.varagrogatum Don.)别名毛葱、鬼子葱、分蘖葱头等,为葱科葱属草本植物,其营养成分丰富,具有良好的保健功能,能提高人体免疫力和抗癌能力[1-4]。分蘖洋葱是黑龙江省和吉林省重要的优势蔬菜品种之一,对农民增收起到了积极的促进作用[5]。然而由于其主要繁殖方式为营养繁殖,易受植物病毒病侵染,品种退化严重,很大程度上制约了分蘖洋葱产业的健康发展[6-7]。此外,生产上分蘖洋葱利用蘖生小鳞茎进行种苗繁殖,繁殖系数较低[8]。目前关于分蘖洋葱组培快繁技术方面的研究还较少。选择合适的外植体材料是组培快繁成功的关键,一般来说,茎尖组织分生能力较强,且茎尖分生组织中极少甚至无病毒分布[9],徐启江等[10]和陈典等[11]以茎尖组织为外植体经两种不同途径获得了分蘖洋葱再生植株,但增殖系数较低且周期较长,因此开辟葱蒜类植物新的外植体材料受到了广泛关注。孔素萍等[12]以鳞茎盘为外植体诱导出了大蒜的簇生芽;董瑞等[13]研究发现,在MS+2 mg/L NAA+7.5 mg/L 6-BA培养基上,新疆白皮蒜每个鳞茎盘不定芽生长最大值为39.22株,以鳞茎盘为外植体进行快繁不仅可以获得较高的增殖效率,且较茎尖取材操作相对容易。然而,关于利用分蘖洋葱鳞茎为外植体进行快繁的研究目前尚未见报道。为此,本试验拟开展分蘖洋葱茎尖启动、微鳞茎盘增殖及生根驯化等关键技术研究,旨在建立脱毒、较高效的分蘖洋葱快繁体系,为分蘖洋葱种苗的快繁提供参考。
1 材料与方法
1.1 试验材料选取吉林省公主岭市怀德镇地方分蘖洋葱品种为试验材料。
1.2 试验方法
1.2.1 茎尖启动培养 将分蘖洋葱种球外层鳞茎逐层剥下,剥至长度2 cm左右,用自来水冲洗30 min,再于超净工作台内,用体积分数75%乙醇浸泡30 s,质量分数1%次氯酸钠浸泡13 min,无菌水冲洗3~5次,备用。
以MS(蔗糖30 g/L,琼脂7 g/L)为基础培养基,在基础培养基中添加不同激素组成启动培养基,用以诱导成苗,培养基配方共设6个处理,详见表1。将经过消毒的外植体在无菌条件下,利用显微镜剥离出0.3 mm大小的茎尖组织,用于接种。每个处理接种40个茎尖,3次重复。培养35 d后统计成苗数和成苗率并测量株高茎粗。培养条件为:温度20~25 ℃,光照强度2 000 lx,光照时间16 h/d,以下试验的培养条件与此相同。成苗率的计算公式为:

表1 分蘖洋葱茎尖启动培养基配方Table 1 Formula of starter medium for tiller onion stem tip
成苗率=(成苗数/接种个数)×100%。
1.2.2 微鳞茎盘增殖培养 试管鳞茎诱导:待茎尖培养至成苗后,把通过RT-PCR技术检测无洋葱黄矮病毒的植株作为分蘖洋葱快繁体系的原始种苗(试管苗脱毒率约为60%)。将原始种苗转接至鳞茎诱导培养基(MS+0.1 mg/L NAA+45 g/L蔗糖+7 g/L琼脂)中诱导结球。
微鳞茎盘增殖:当脱毒种苗试管微鳞茎直径达到8 mm以上时,切去根及鳞茎盘以上部分,去除主生长点后将鳞茎盘切割成4份,分别接种于以MS(附加蔗糖30 g/L,琼脂7 g/L)为基础培养基,添加不同质量浓度的6-BA(0.1,0.4,1.0 mg/L)与NAA(0.1,1.0,2.0 mg/L)组合和6-BA(0.1,0.4,1.0 mg/L)与IAA(0.1,1.0,2.0 mg/L)组合的增殖培养基中,诱导丛生芽,4周后统计分化芽总数,计算平均增殖系数。每个配方接种20个1/4鳞茎盘,3次重复。平均增殖系数的计算公式为:
平均增殖系数=分化芽总数/接种块数。
1.2.3 生根壮苗与移栽驯化 生根培养基配方设3个处理,分别为MS+0.1 mg/L NAA、1/2 MS+0.1 mg/L NAA和1/4 MS+0.1 mg/L NAA。将增殖后的组培苗分株接种于不同生根培养基中进行生根培养,诱导组培苗进行生根,培养30 d后,统计生根率和生根数并测量根长。每个培养基配方接种30株,3次重复。生根率的计算公式为:
生根率=(已生根株数/接种个数)×100%。
将生根后的分蘖洋葱组培苗移栽至穴盘中驯化,基质配比为V(草炭)∶V(田土)= 2∶1,覆膜保湿,在培养温度20 ℃、相对湿度80%的条件下培养,20 d后统计成活率,并观察后续田间生长情况。
1.3 数据分析
利用Excel 2019进行试验数据统计,采用SPSS 20.0进行数据分析和Duncan’s多重比较分析。
2 结果与分析
2.1 分蘖洋葱茎尖启动培养
由表2可以看出,分蘖洋葱茎尖组织经过35 d培养后,在6种培养基上的成苗率和生长状态有一定差异。分蘖洋葱茎尖组织在A1培养基上的成苗率最高,为87.50%,显著高于其他处理;植株的平均株高和茎粗也最大,分别为3.41和1.17 cm。A2和A3培养基中分别添加了0.4 mg/L 6-BA和0.8 mg/L 6-BA,分蘖洋葱茎尖组织成苗率有所下降,分别为75.00%和67.50%,平均株高和茎粗也有所减小,其中平均株高显著低于A1培养基,平均茎粗与A1培养基差异不显著。A4和A5培养基中分别添加了0.4 mg/L ZT和0.8 mg/L ZT,分蘖洋葱茎尖组织成苗率分别为77.50%和67.50%,平均株高分别为3.17 和2.78 cm,平均茎粗分别为1.06 和0.87 cm。分孽洋葱茎尖组织在A6培养基上的成苗率最低,仅为57.50%,平均株高和茎粗也最小。由于茎尖组织在A1培养基上的成苗率最高且植株生长状态最好,因此A1培养基为分蘖洋葱的最佳茎尖启动培养基。
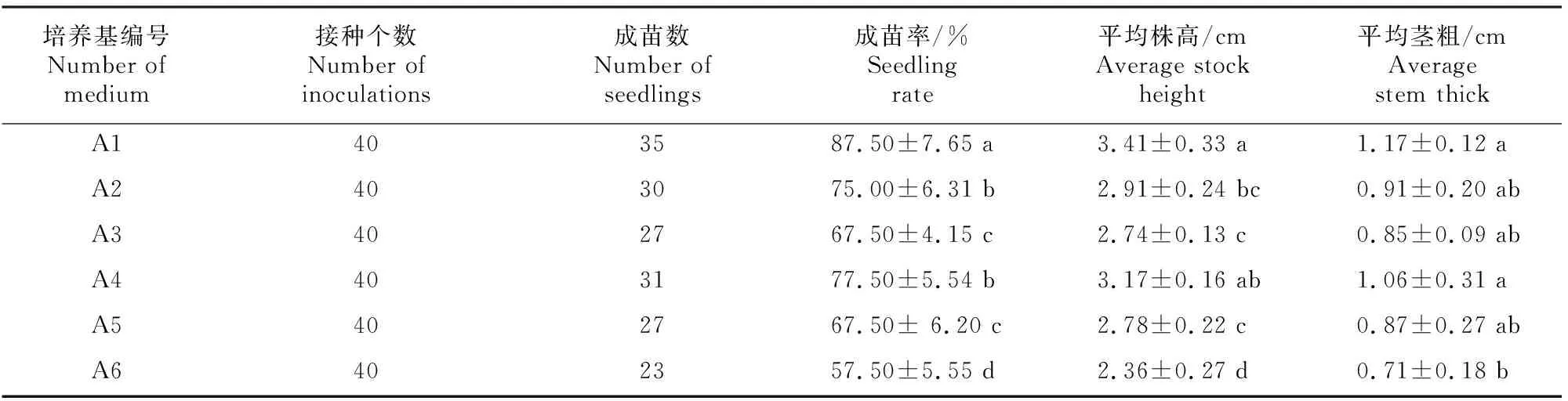
表2 不同培养基对分蘖洋葱茎尖成苗及生长状况的影响Table 2 Effects of different media on seedling formation and growth status of stem tip
2.2 分蘖洋葱微鳞茎盘增殖
2.2.1 微鳞茎盘的获得 本试验分蘖洋葱增殖快繁是以试管微鳞茎盘为外植体进行的,因此需先对分蘖洋葱原始种苗进行试管结球诱导以获得试管微鳞茎。本试验将原始种苗接种于MS+0.1 mg/L NAA+45 g/L蔗糖+7 g/L琼脂的培养基中诱导结球,培养8周后获得了直径大于8 mm的试管微鳞茎。图1为分蘖洋葱微鳞茎盘获得流程,其中图1-a为经结球诱导后的试管微鳞茎,图1-b-d为分蘖洋葱微鳞茎切割过程图。首先将分蘖洋葱试管苗的根部切除,再将鳞茎盘以上部分去除,最后将鳞茎盘上的主生长点去除后切割成4份,分别接种于添加不同质量浓度的6-BA与NAA组合和6-BA与IAA组合的增殖培养基上诱导丛生芽。
2.2.2 不同激素组合对分蘖洋葱微鳞茎盘增殖的影响 将切割后的分蘖洋葱鳞茎盘接种于增殖培养基上,随着诱导时间的延长,微鳞茎盘分化数增加,经2周培养后,在显微镜下观察到了丛生芽的分化;3周后,丛生芽株高最大可达1 cm;4周后丛生芽株高可达3 cm,分化数达到最大值(图2)。

a.试管微鳞茎;b.切除根部;c.切除鳞茎盘以上部分;d.鳞茎盘切割4份a.Micro-squamous tube;b.Removal of roots;c.Removal of upper bulbous disk;d.Scale stalk cut 4 parts图1 分蘖洋葱微鳞茎盘的获得流程Fig.1 Process of obtaining micro-squamous stem disc of tiller onion

a.培养2周;b.培养3周;c.培养4周a.Culture for 2 weeks;b.Culture for 3 weeks;c.Culture for 4 weeks图2 分蘖洋葱微鳞茎盘增殖Fig.2 Multiplication of tiller onion microscale
由表3可知,6-BA与NAA组合对分蘖洋葱微鳞茎盘诱导增殖的效果优于6-BA与IAA组合。不同质量浓度的6-BA与NAA组合对分蘖洋葱微鳞茎盘的增殖诱导效果存在明显差异,随NAA质量浓度增加,分蘖洋葱微鳞茎盘平均增殖系数普遍下降;当6-BA质量浓度为0.4 mg/L时,分蘖洋葱微鳞茎盘平均增值系数普遍较高。6-BA与NAA组合中,分蘖洋葱微鳞茎盘在添加0.4 mg/L 6-BA和0.1 mg/L NAA的培养基上分化芽总数和平均增殖系数最大,平均增殖系数达16.05,显著高于其他处理。

表3 不同激素组合对分蘖洋葱微鳞茎盘增殖的影响Table 3 Effect of different hormone combinations on growth of microscale disk of tiller onion
由表3还可知,不同质量浓度的6-BA与IAA组合也可以诱导出丛生芽,但增殖系数较低,且增殖苗存在畸形苗。同样随IAA质量浓度的增加,分蘖洋葱微鳞茎盘平均增殖系数普遍下降;当6-BA质量浓度为0.4 mg/L时,分蘖洋葱微鳞茎盘平均增殖系数普遍较高;6-BA与IAA组合中分蘖洋葱微鳞茎盘在添加 0.4 mg/L 6-BA和0.1 mg/L IAA的培养基中,分化芽总数和平均增殖系数最大,平均增殖系数达13.05,显著高于其他处理。综合考虑认为MS+0.4 mg/L 6-BA+0.1 mg/L NAA为分蘖洋葱微鳞茎盘增殖的最佳培养基。
2.3 分蘖洋葱生根壮苗与移栽驯化
由表4可知,将增殖后的分蘖洋葱苗分株接种于不同生根培养基中进行生根培养,培养30 d后各培养基上分蘖洋葱的生根率均达100%,但根的生长状况存在一定差异。D1培养基上的组培苗平均生根数较多,但根长较短;D2培养基上的组培苗平均生根数最多,显著高于D1和D3培养基;D3培养基上的组培苗平均根长最大,与D2培养基差异不显著,但D3和D2培养基均显著高于D1培养基。综合分析认为,D2培养基为分蘖洋葱组培苗的最佳生根培养基。
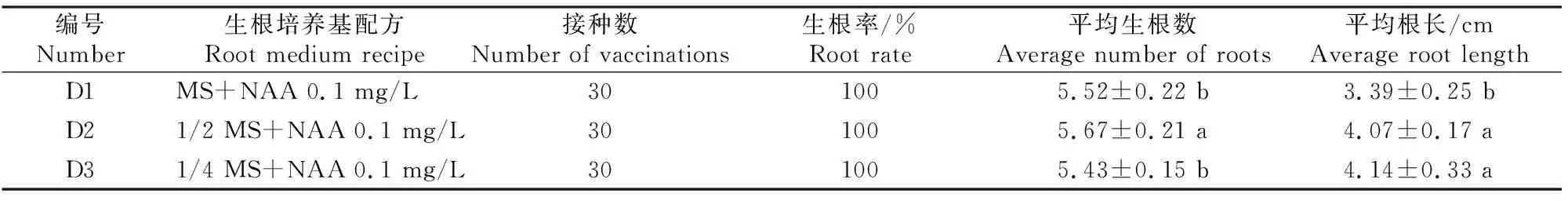
表4 不同生根培养基对分蘖洋葱生根的影响Table 4 Effect of different rooting medium on rooting of tiller onion
图3为分蘖洋葱组培苗田间驯化结果,图3-a为生根后的分蘖洋葱组培苗,图3-b为移栽至穴盘的组培苗。将生根后的分蘖洋葱组培苗移栽到穴盘中,基质为V(草炭)∶V(田土)=2∶1,覆膜保湿,在20 ℃、相对湿度80%条件下培养20 d后,分蘖洋葱组培苗成活率在95%以上。与正常鳞茎种植相比,组培苗后续田间长势较好,且生长期相对延长,分蘖数4~6个,鳞茎平均质量为25~30 g。

a.分蘖洋葱组培苗;b.组培苗穴盘栽培a.Seedling culture of tiller onion;b.Cultivation of tissue culture图3 分蘖洋葱组培苗的田间驯化栽培Fig.3 Field domestication cultivation of tiller onion tissue culture seedlings
3 讨论与结论
在本试验条件下,分蘖洋葱最佳茎尖启动培养基为MS+0.1 mg /L NAA,成苗率为87.50%。关于分蘖洋葱最佳茎尖启动培养基已有一些报道,徐启江[8]研究表明,分蘖洋葱最佳诱芽培养基为 MS+0.1 mg/L NAA+0.4 mg/L BA。姜玉东[14]研究表明,MS+0.1 mg/L NAA+0.7 mg/L BA和MS+0.1 mg/L NAA+0.7 mg/L zip培养基都适合分蘖洋葱的诱芽培养。王健鹂等[15]研究表明,分蘖洋葱最佳茎尖启动培养基为MS+0.1 mg/L NAA+0.4 mg/L zip。以上结果说明,分蘖洋葱最佳茎尖启动培养基中的最佳NAA质量浓度均为0.1 mg/L,这与本试验结果相一致,所不同的是添加的其他植物生长调节剂种类和质量浓度有差别,造成这种差异的原因可能与茎尖培养时所采用的分蘖洋葱品种和所处发育时期不同有关,不同的分蘖洋葱品种和所处时期会导致其内源激素水平差异,进而导致茎尖启动培养时选择的培养基激素种类和水平有所差异。本试验进行茎尖启动培养是为了获得生长状况较好的分蘖洋葱植株,在培养基中添加6-BA、ZT等激素会促使茎尖启动时产生芽的分化,影响植株生长状况。因此本试验通过比较确定,只添加0.1 mg/L NAA的培养基为最佳茎尖启动培养基,不仅能有效节约生产成本,同时也提高了诱导效率。
本试验首次利用分蘖洋葱微鳞茎盘为外植体进行增殖,研究结果表明,分蘖洋葱1/4微鳞茎盘在MS+0.4 mg/L 6-BA+0.1 mg/L NAA增殖培养基上的平均增殖系数可达16.05,相当于1个鳞茎盘平均增殖系数可高达64.20。前人研究表明,茎尖外植体分化不定芽平均最大为3.1,茎尖愈伤组织分化形成的芽最多为14个[10-11],因此本试验很大程度上提高了分蘖洋葱的快繁效率。目前,利用鳞茎盘作为外植体增殖在大蒜、朱顶红和洋葱等植物上已有一些报道[16-19]。董瑞等[20]研究表明,在MS+1.799 mg/L NAA+7.50 mg/L 6-BA增殖培养基上,伊宁红皮蒜每个鳞茎盘不定芽生长平均值可达22.92株。陈汉鑫等[21]研究表明,在MS+2.0 mg/L 6-BA+0.2 mg/L NAA增殖培养基上,朱顶红鳞茎盘的增殖系数达5.62倍。潘美红等[19]研究表明,以连葱15号鳞茎盘为外植体,在MS+7 mg/L 6-BA+0.4 mg/L NAA培养基上的增殖效果最好。本试验与前人研究结果均表明,利用鳞茎盘进行快繁可以获得较高的增殖效率。本试验建立的分蘖洋葱微鳞茎盘快繁体系主要流程是分蘖洋葱经茎尖启动后获得组培苗,再经结球诱导后进行鳞茎盘增殖,待鳞茎盘增殖的苗长至3~5 cm时进行分株结球培养,然后再进行鳞茎盘增殖,这样反复循环。此过程不仅可以提高分蘖洋葱的快繁效率,同时能缩短种苗的增殖周期。
试管苗的生根驯化是脱毒种苗生产的最后一步。前人研究表明,MS+1.5 mg/L IBA+0.01 mg/L NAA、MS+2.5 mg/L IBA和1/2 MS+0.1 mg/L PP333+0.01 mg/L NAA+1.5 mg/L IBA等培养基都适合分蘖洋葱的生根培养[6,10,14]。本试验研究表明:在本试验条件下,分蘖洋葱最佳生根培养基为1/2 MS+0.1 mg /L NAA,以单独添加NAA为分蘖洋葱的最佳生根培养基,这与前人研究结果不同。以往研究表明,NAA、IBA和PP333等激素都有促进植物生根的作用,前期诱导组培苗的外植体种类和诱导条件影响组培苗内在激素水平和生长状态,进而导致诱导生根所需要的条件不同[22-25]。本试验在移栽基质为V(草炭)∶V(田土)= 2∶1及覆膜保湿条件下,保持培养温度为20 ℃,相对湿度为80%,经驯化20 d后分蘖洋葱组培苗成活率在95%以上。
本试验以分蘖洋葱鳞茎盘为外植体进行增殖诱导,建立了分蘖洋葱组培苗快繁技术体系,提高了种苗快繁的增殖系数,反复循环结球增殖环节,缩短了种苗增殖周期,可为分蘖洋葱的种苗快繁研究提供一定的参考。

