胰岛素抵抗HepG2细胞模型建立的正交实验研究
王金凤,王芳,王国玉,杨翠燕,赵庆兰(中国人民解放军联勤保障部队第九六四医院,长春 130062)
胰岛素抵抗(IR)是2 型糖尿病、高脂血症、高血压病、冠心病和脂肪肝等一系列代谢相关疾病发生、发展的原动力,是其共同的病理生理基础[1]。肝脏是胰岛素(INS)的主要效应器官,是摄取、储存、合成和代谢葡萄糖的主要场所,在维持血糖稳定中起着最直接和最重要的作用[2]。因此,肝细胞糖代谢紊乱对IR 的发生发展具有重要意义。
HepG2 细胞源于人的肝胚胎瘤细胞,具有类似肝细胞代谢功能,是体外研究IR 发病机制和降糖药物筛选及作用机制最常用的细胞模型[3]。人体IR 最主要的诱发因素是过量的糖和脂肪及继发性高胰岛素血症[4-5],体外细胞学实验亦证明棕榈酸(PA)、INS、高糖可诱导HepG2 细胞建立IR模型[6-7]。然而,研究发现INS 诱导模型稳定性差,PA 对细胞损伤性大,单纯高糖的作用小,并非理想的IR 细胞模型[8]。本文采用高糖培养基,正交实验优选PA、INS 联合应用建立HepG2 细胞IR 模型的最佳条件,为IR 防治药物筛选及其发病机制研究提供良好的细胞模型。
1 材料
1.1 细胞系
人肝癌 HepG2 细胞(中科院上海细胞库)。
1.2 试药
胰岛素注射液(400 U/10 mL,万邦生化医药集团);噻唑蓝(MTT)、二甲基亚砜(DMSO)(美国Sigma 公司);高糖培养基(DMEM,批号:1993859,Gibco 公司);优级胎牛血清(FBS,货号:TBD21HY,灏洋生物制品科技有限公司);葡萄糖测定试剂盒(货号:A031,长春汇力生物技术有限公司);糖原检测试剂盒(货号:A043,南京建成生物研究所)。
1.3 仪器
UV-3200S 紫外分光光度仪(上海美谱达仪器有限公司);MK3 酶标仪(Thermo Labsystems 公司);HF90 CO2培养箱(上海力申科学仪器有限公司);CK40 倒置显微镜(OLYMPUS 公司)。
2 方法
2.1 HepG2 细胞培养
HepG2 细胞复苏后,用含15% FBS 的DMEM高糖培养基,于37℃、5% CO2饱和湿度条件下培养。待细胞贴壁长满后,弃去培养液,用PBS 清洗3 次。加适量0.25%胰蛋白酶消化,按1︰3 的比例传代。取对数生长期细胞用于实验。
2.2 INS、PA 对细胞增殖的影响
根据参考文献[9-10]和预实验结果,将细胞以每孔1×104个接种于96 孔培养板,分为对照组和模型组,每组6 孔。待细胞单层贴壁生长至50%左右,对照组加正常培养液,模型组加新配制的不同浓度的INS 和PA 培养液200 μL(均含10%FBS)。在37℃、5% CO2饱和湿度条件下培养,分别于24、36、48、60 h 倒置显微镜观察细胞形态后,每孔加5 mg·mL-1MTT 10 μL。继续培养4 h 后,弃培养液。每孔加入DMSO 100 μL,充分混匀溶解结晶后,于酶标仪492、630 nm 双波长处测量吸光度值(A492)。
2.3 正交实验优选HepG2 细胞IR 模型培养条件
以INS(A)、PA(B)及孵育时间(C)作为影响因素,选择对细胞损伤较小、浓度较大的3个水平,见表1。按照L9(34)正交表进行实验。
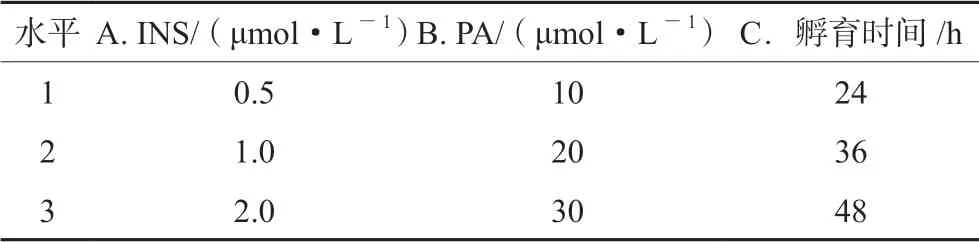
表1 因素水平表Tab 1 Factor and level
将细胞以每孔5×104个接种于3个24孔培养板。每板设1 个对照组和3 个孵育时间相同的模型组,每组6 孔。待细胞单层贴壁生长至50%左右时,对照组加正常培养液,模型组按正交实验表加新配制不同浓度的INS、PA 条件培养液(均含10%FBS)。37℃、5%CO2饱和湿度条件下培养(36 h 和48 h 组次日换相同条件培养液1 次)。培养至预定时间,弃培养液,PBS 洗涤2 遍,换含5%FBS 的DMEM 高糖培养液500 μL。培养24 h 后,应用葡萄糖测定试剂盒检测上清液葡萄糖含量,计算葡萄糖消耗量(GC)[11]。每孔加5 mg·mL-1MTT 40 μL,继续培养4 h。弃培养液,每孔加DMSO 400 μL。充分混匀溶解结晶后,于酶标仪492、630 nm 双波长处测量其吸光度值(A492)。GC/A492为校正葡萄糖消耗量,以消除细胞数量对葡萄糖消耗的影响。
计算模型组与对照组的GC/A492差值(ΔGC/A492),差值最大的即为最佳条件,重复实验3 次。以ΔGC/A492为评价指标,对正交实验结果进行方差分析和显著性检验,确定HepG2 细胞IR 模型建立的最佳条件。
2.4 HepG2 细胞IR 模型持续时间的研究
采用最佳方法造模后,将对照组与模型组细胞同时置于5% FBS 高糖培养液中继续培养24、36、48、60 h,每日换液一次,测定各组细胞在不同时间的GC/A492。
2.5 糖原检测
参考文献[12]并加以改进检测糖原。细胞接种至6 孔培养板,建立IR 细胞模型后,吸弃培养液,PBS 洗涤2 遍。加入胰酶消化后,小心吸弃胰酶,每孔加1 mL PBS 吹打混匀。取200 μL 离心后去上清液,加入50 μL 细胞裂解液,双蒸水定容至2 mL,紫外吸收法测定蛋白浓度[13]。余液取700 μL 加入碱提取液,蒽酮法测定糖原[14],重复实验3 次。计算每克蛋白中的糖原含量。
2.6 HepG2 细胞IR 模型油红O 染色
称取油红O 粉末0.5 g 溶于异丙醇100 mL,制成油红O 储备液。使用时将油红O 储备液与双蒸水按3∶2(V/V)混合,0.45 μm 滤膜过滤制得澄清工作液。细胞接种至6 孔培养板,建立IR细胞模型后,吸弃培养液,PBS 洗涤3 遍;4%多聚甲醛固定15 min,弃多聚甲醛;PBS 再洗涤3 遍,每次5 min;每孔加油红O 工作液500 μL,于室温下染色15 min;弃去油红O 染液,PBS 洗涤3 遍,每次5 min。镜下观察各组细胞形态。
2.7 统计学方法
实验数据用均数±标准差(±s)表示,采用SPSS 24.0 统计软件进行数据分析。两组间计量资料比较采用t检验,P<0.05 为差异有统计学意义。
3 结果
3.1 INS 对细胞增殖的影响
INS 在0.05 ~0.5 μmol·L-1内孵育HepG2细胞60 h,其吸光度值显著高于对照组,表明INS 有促进细胞增殖作用。并且随着INS 浓度的增加和作用时间的延长作用增强;在1.0 ~5.0 μmol·L-1培养48 h,随着INS 浓度的增加促增殖作用强度减小;48 h 内随着作用时间的延长吸光度值增加。但作用60 h 时,吸光度值明显下降,2.0 ~5.0 μmol·L-1组显著低于对照组,呈现抑制作用。表明高浓度INS 长时间作用具有抑制细胞增殖作用。当INS 为10.0 μmol·L-1时,孵育24 h 吸光度值低于对照组,36 h 后差异显著,表现为细胞损伤作用。其中INS 1.0 μmol·L-1作用48 h 的促增殖作用最强。见表2。
表2 INS 浓度、孵育时间对细胞增殖活性的影响(± s,n =6)Tab 2 Effect of INS concentration and time on the cell proliferation (± s,n =6)
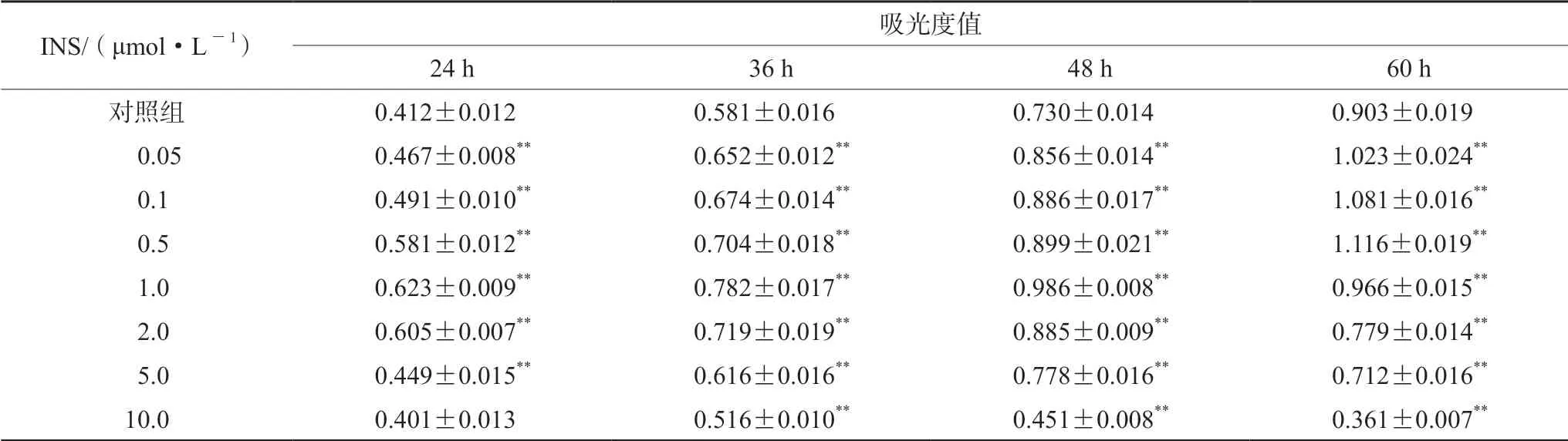
表2 INS 浓度、孵育时间对细胞增殖活性的影响(± s,n =6)Tab 2 Effect of INS concentration and time on the cell proliferation (± s,n =6)
注(Note):与对照组比较,**P <0.01(Compared with the control group,**P <0.01)。
INS/(μmol·L-1) 吸光度值24 h 36 h 48 h 60 h对照组 0.412±0.012 0.581±0.016 0.730±0.014 0.903±0.019 0.05 0.467±0.008** 0.652±0.012** 0.856±0.014** 1.023±0.024**0.1 0.491±0.010** 0.674±0.014** 0.886±0.017** 1.081±0.016**0.5 0.581±0.012** 0.704±0.018** 0.899±0.021** 1.116±0.019**1.0 0.623±0.009** 0.782±0.017** 0.986±0.008** 0.966±0.015**2.0 0.605±0.007** 0.719±0.019** 0.885±0.009** 0.779±0.014**5.0 0.449±0.015** 0.616±0.016** 0.778±0.016** 0.712±0.016**10.0 0.401±0.013 0.516±0.010** 0.451±0.008** 0.361±0.007**
3.2 PA 对细胞增殖的影响
PA 浓度为10 ~40 μmol·L-1时,作用于HepG2 细胞24 h,其吸光度值与对照组相近,对细胞增殖无明显影响。浓度为30、40 μmol·L-1PA 孵育36 h 开始出现显著抑制作用,且随作用时间的延长抑制作用增强。PA 20 μmol·L-1孵育48 h 出现明显抑制作用,PA 为10 μmol·L-1时培养60 h 无明显影响。PA 在60 ~400 μmol·L-1孵育24 h 即有细胞损伤作用,而且随着浓度的增加和时间的延长损伤作用增强。镜下观察受损细胞状态差,表现为细胞体积缩小,由大的多边形变为小的细长条形,折光性差,连接消失,并可见大量脱落细胞(见表3)。
表3 PA 浓度、孵育时间对细胞增殖活性的影响(± s,n =6)Tab 3 Effects of PA concentration and time on the cell proliferation (± s,n =6)
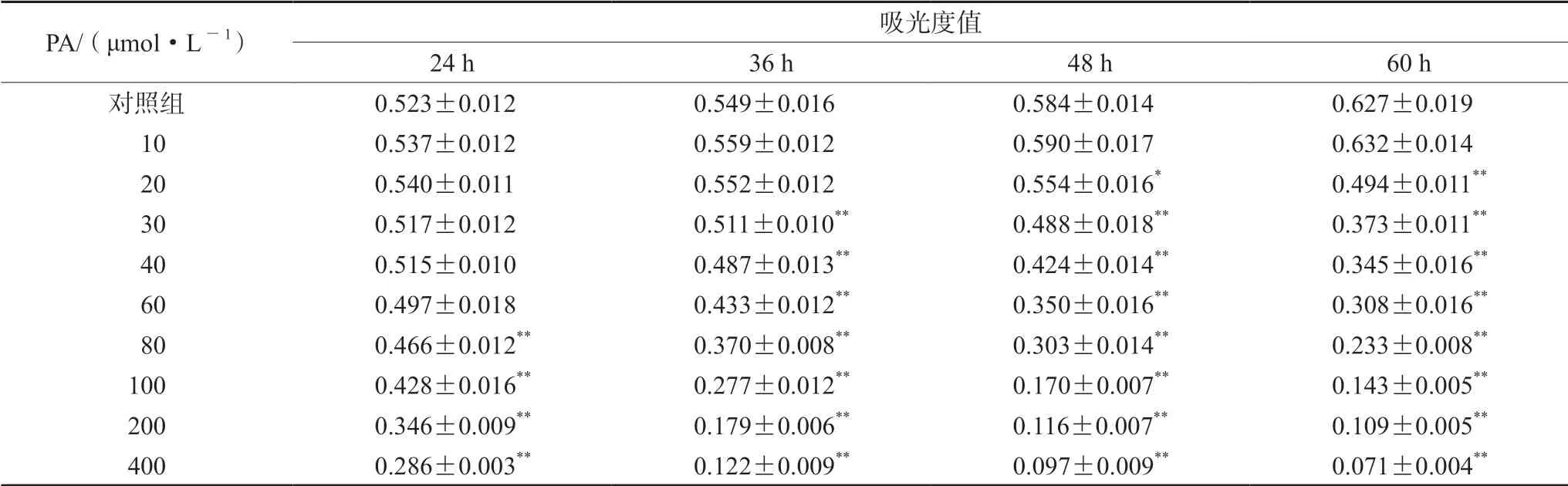
表3 PA 浓度、孵育时间对细胞增殖活性的影响(± s,n =6)Tab 3 Effects of PA concentration and time on the cell proliferation (± s,n =6)
注(Note):与对照组比较,*P <0.05,**P <0.01(Compared with the control group,*P <0.05,**P <0.01)。
PA/(μmol·L-1) 吸光度值images/BZ_75_1597_2361_1949_2376.png24 h 36 h 48 h 60 h对照组 0.523±0.012 0.549±0.016 0.584±0.014 0.627±0.019 10 0.537±0.012 0.559±0.012 0.590±0.017 0.632±0.014 20 0.540±0.011 0.552±0.012 0.554±0.016* 0.494±0.011**30 0.517±0.012 0.511±0.010** 0.488±0.018** 0.373±0.011**40 0.515±0.010 0.487±0.013** 0.424±0.014** 0.345±0.016**60 0.497±0.018 0.433±0.012** 0.350±0.016** 0.308±0.016**80 0.466±0.012** 0.370±0.008** 0.303±0.014** 0.233±0.008**100 0.428±0.016** 0.277±0.012** 0.170±0.007** 0.143±0.005**200 0.346±0.009** 0.179±0.006** 0.116±0.007** 0.109±0.005**400 0.286±0.003** 0.122±0.009** 0.097±0.009** 0.071±0.004**
3.3 正交实验结果
由极差(R)得出,影响葡萄糖消耗的主次因素顺序为 C >B >A,即孵育时间>PA >INS,其中20 μmol·L-1PA 和2.0 μmol·L-1INS 作用最强,孵育最佳时间是 48 h,见表4。联合应用PA 和INS,显示A2B1C2、A2B2C3和A3B1C3作为诱导条件葡萄糖消耗减少明显,均超过20%。把空白作为误差列进行方差分析,见表5。经方差分析和显著性检验结果表明,孵育时间、PA 及INS 对葡萄糖消耗均有显著性影响(P<0.05)。
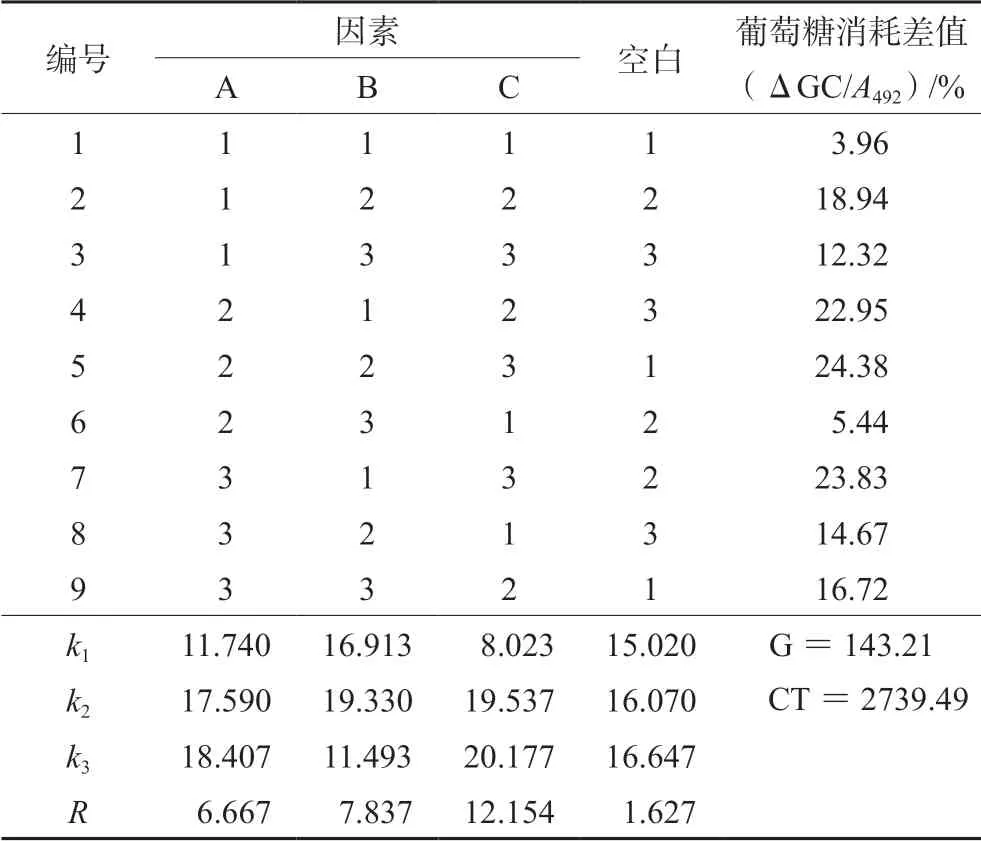
表4 正交实验结果分析Tab 4 Analysis of orthogonal experiment
3.4 验证实验结果
依据正交实验结果进一步比较A2B1C3、A2B2C3、A3B1C3和A3B2C3,结果见表6。A2B1C3葡萄糖消耗最低,A3B2C3最高,且两组之间比较,差异有统计学意义(P<0.05)。A2B1C3虽然与A2B2C3、A3B1C3相近,但差异无统计学意义。考虑低浓度、小剂量、长时间作用,更接近人体IR 形成的病理生理过程,故选用A2B1C3作为联合诱导的造模条件(称为联合诱导组)。3 次验证性实验结果显示,联合诱导组较对照组葡萄糖消耗明显减少,ΔGC/A492分别为20.45%、22.43%和21.19%。表明重复性好,稳定可靠。
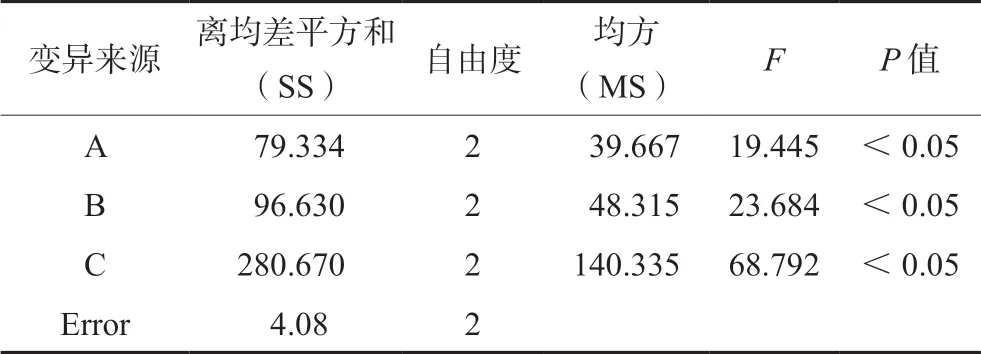
表5 方差分析Tab 5 Analysis of variance
3.5 HepG2 细胞IR 模型的稳定时间
各模型组细胞的葡萄糖消耗量在48 h 内均显著低于对照组细胞(P<0.01),其中以24 h 葡萄糖消耗减少幅度最大,见表7、图1。表明本方法建立的IR HepG2细胞模型24 h 最佳,48 h 内稳定。
表6 作用相近联合诱导条件下葡萄糖消耗量的比较(± s,n =6,%)Tab 6 Glucose consumption under combined induction conditions with similar effects (± s,n =6,%)
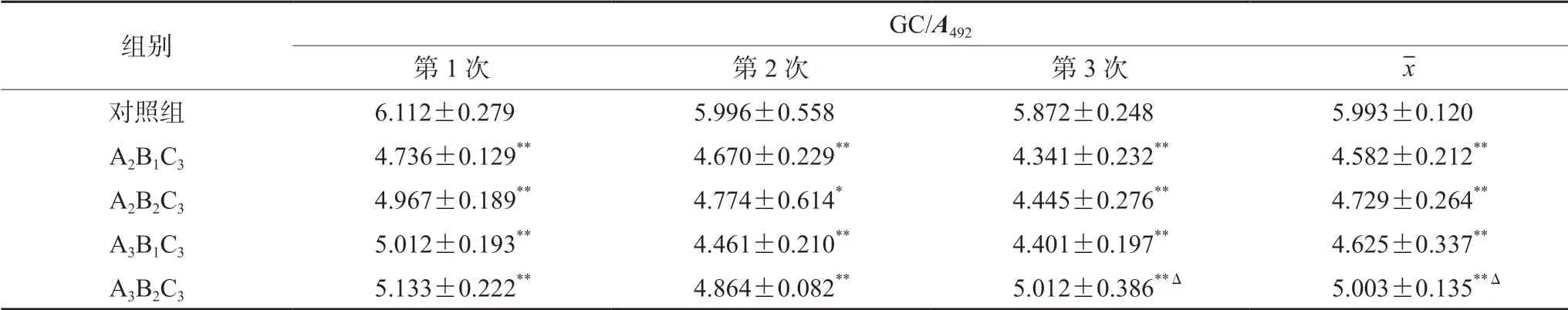
表6 作用相近联合诱导条件下葡萄糖消耗量的比较(± s,n =6,%)Tab 6 Glucose consumption under combined induction conditions with similar effects (± s,n =6,%)
注(Note):与对照组比较,*P <0.05;与A2B1C3 比较,ΔP <0.05(Compared with the control group,*P <0.05;compared with the A2B1C3 group,ΔP <0.05)。
组别 GC/A492第1 次 第2 次 第3 次 x对照组 6.112±0.279 5.996±0.558 5.872±0.248 5.993±0.120 A2B1C3 4.736±0.129** 4.670±0.229** 4.341±0.232** 4.582±0.212**A2B2C3 4.967±0.189** 4.774±0.614* 4.445±0.276** 4.729±0.264**A3B1C3 5.012±0.193** 4.461±0.210** 4.401±0.197** 4.625±0.337**A3B2C3 5.133±0.222** 4.864±0.082** 5.012±0.386**Δ 5.003±0.135**Δ
表7 IR 细胞模型不同时间葡萄糖消耗量的变化(± s,n =6,%)Tab 7 Effect of different time on glucose consumption in IR cell model (± s,n =6,%)

表7 IR 细胞模型不同时间葡萄糖消耗量的变化(± s,n =6,%)Tab 7 Effect of different time on glucose consumption in IR cell model (± s,n =6,%)
注(Note):与对照组比较,**P <0.01(compared with the control group,**P <0.01)。
组别 GC/A492 24 h 36 h 48 h 60 h对照组 6.259±0.229 5.644±0.164 5.622±0.210 5.446±0.329联合诱导组 4.764±0.618** 4.495±0.397** 4.555±0.394** 4.780±0.377
3.6 IR 模型细胞糖原含量的变化
IR 模型建立后,蒽酮法检测HepG2 细胞糖原含量,并用蛋白质浓度进行校准,结果IR 细胞糖原含量显著低于对照组[(63.72±7.29)mg·g-1vs(83.50±5.17)mg·g-1,P<0.01),降低百分比为23.69%。
3.7 IR 模型细胞的形态变化
造模后油红O 染色,倒置显微镜下观察细胞形态,脂肪滴被染成鲜红色。与对照组比较,模型组细胞体积增大,细胞中鲜红色脂滴显著增多,见图2。
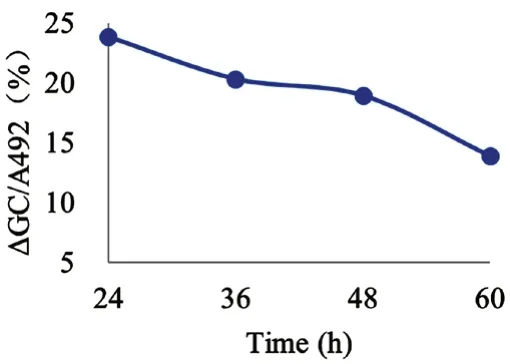
图1 IR 细胞模型不同时间平均葡萄糖消耗减少的百分比(ΔGC/A492,%)Fig 1 Percentage reduction of average glucose consumption at different time in IR cell model(ΔGC/A492,%)
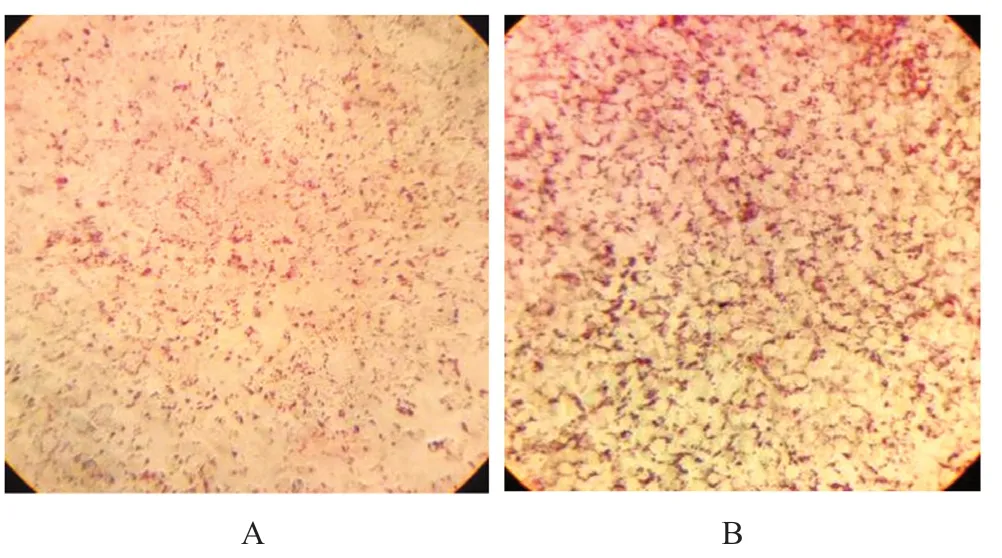
图2 正常HepG2 细胞(A)与IR 细胞(B)的形态比较(×200)Fig 2 Lipid droplet morphology between normal HepG2(A)and IR cells(B)(×200)
4 讨论
4.1 正交实验条件的选择
INS 是具有促进糖原、蛋白、脂肪合成及细胞分裂增殖作用的蛋白质激素[15]。本研究发现1.0 μmol·L-1的INS 孵育HepG2 细胞48 h 促细胞增殖作用最强,小于此浓度其促增殖作用呈剂量依赖性增强,高于此浓度促增殖作用强度进行性减弱,甚至出现抑制现象。因此选择INS 浓度为 0.5、1.0、2.0 μmol·L-1作为正交实验条件。PA 细胞毒性增大,多次反复实验均表明,只有10 μmol·L-1的PA,作用时间在60 h 内,对细胞增殖活性无明显影响。PA 浓度20 μmol·L-1作用48 h 和30 μmol·L-1作用36 h 开始出现抑制现象,随着PA 浓度进一步增加和作用时间延长,细胞损伤作用增强。因此,选择10、20、30 μmol·L-1浓度为PA 的3 个水平,孵育时间设定为24、36 和48 h。
4.2 IR 细胞模型最佳条件的确定
研究选用L9(34)正交表进行实验,验证实验结果显示,INS 1.0 μmol·L-1、PA 10 μmol·L-1,孵育48 h(A2B1C3)更接近人体IR 形成的病理生理过程,葡萄糖消耗减少达22.36%,并且3 次验证实验结果表明重复性好,稳定可靠。而联合应用作用最强的INS 2.0 μmol·L-1和PA 20 μmol·L-1分别培养24 h 和48 h,检测葡萄糖消耗量;结果24 h 葡萄糖消耗减少不明显,而48 h 因细胞死亡明显增加,导致葡萄糖消耗(ΔGC/A492)增加。同时考察了20 μmol·L-1PA 联合1.0 μmol·L-1INS 和10 μmol·L-1PA 联合2.0 μmol·L-1INS,但葡萄糖消耗减少程度并不优于A2B1C3组。故高糖培养基加10 μmol·L-1PA 联合1.0 μmol·L-1INS孵育48 h为建立HepG2 细胞IR 模型的最佳条件。
稳定性实验表明,细胞模型IR 作用可持续存在48 h,24 h 作用最强,结果稳定。糖原检测结果显示,模型组糖原合成显著减少,油红O 染色见模型组细胞脂肪颗粒显著增加,进一步证明此方法建立的IR 细胞模型准确可靠。
4.3 成功建模的关键因素
4.3.1 适宜的细胞密度 研究发现HepG2 细胞呈抱团式生长,细胞稀少时生长缓慢,对条件培养基的耐受性差。细胞过多,因接触性抑制,细胞活力下降,处于低代谢状态[16]。虽然密集的细胞耐受性增强,但对条件培养基的敏感性下降。而且,由于细胞代谢活力下降,葡萄糖消耗减少。因此,细胞密度是葡萄糖消耗的重要影响因素。细胞贴壁50%左右时加条件培养基较为适宜,并可根据培养时间和条件的不同适当调整。
4.3.2 葡萄糖的精准测定 培养上清液中葡萄糖含量是判断模型成败的决定性指标。葡萄糖氧化酶法测定葡萄糖是通过紫外分光光度仪检测其吸光度值而实现。因线性范围限制,高糖培养基只能取15 μL 左右。取样量越小,随机误差越大,导致样本平行性差,影响结果评价。本研究采用24 孔培养板,精密吸取100 μL 上清液,10 倍稀释后,再取150 μL 进行测定,平行检测3 次。可提高检测准确性,使结果更加客观准确。
综上所述,采用较小剂量INS、PA 联合高糖培养基,较长孵育时间建立HepG2 细胞IR 模型。不仅对细胞损伤小,而且接近人体IR 的病理生理过程,为防治IR 药物筛选及发病机制研究奠定基础。

