仿制和原研左氧氟沙星的体外抗菌活性比较
马攀,陈勇川,胡显飞,熊丽蓉,戴青,翁邦碧,冯伟(1.重庆医科大学药学院,重庆 400016;.陆军军医大学第一附属医院药学部,重庆 400038)
左氧氟沙星属于氟喹诺酮类抗菌药物,抑制细菌DNA 复制、转录、修复和重组所需的拓扑异构酶Ⅳ和DNA 螺旋酶,对多种革兰阴性和革兰阳性菌均有抑制作用。因其对金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、肺炎链球菌、流感嗜血杆菌等多种临床常见致病菌抗菌活性良好,在临床上应用广泛[1]。市售左氧氟沙星仿制药品种繁多,与原研药相比普遍具有价格优势,在降低医疗成本方面发挥着重要作用,但是否都具有与原研药相同的临床治疗效果仍然存在争议。有研究采用最低抑菌浓度(MIC)实验和时间杀菌曲线法比较不同厂家头孢哌酮/舒巴坦(CFP/SUL)对多药耐药菌(multidrug-resistant organisms,MDROs)的体外抗菌活性,结果表明不同厂家CFP/SUL 对MDROs的抗菌活性存在显著差异[2]。亦有研究在使用万古霉素仿制药对肝移植合并耐甲氧西林金黄色葡萄球菌(MRSA)感染的腹膜炎患者进行治疗时发现使用万古霉素仿制药比原研药出现治疗失败的可能性显著增加[3]。同时另一项研究证明即使通过生物等效验证,万古霉素仿制药与原研药在治疗上仍不等效,在小鼠大腿感染模型中,使用仿制药治疗后明显丰富了小鼠大腿感染的耐药菌群[4]。
仿制药与原研药不等效的原因复杂,涉及到工艺、制剂、体内外溶出等方面的技术环节。对于抗菌药物而言,其治疗的基础是对细菌的抗菌活性强弱,临床使用不等效的仿制抗菌药物不仅可能导致治疗的失败,更可能导致细菌耐药的发生。因此,抗菌药物等效性评价应首先针对药物的抗菌活性进行评估,才能为进一步的临床生物等效性评价提供保障。本研究将市售常见15 个厂牌的左氧氟沙星制剂按照2015年版《中国药典》的方法进行含量测定,进而制备抗菌药物稀释液,再根据美国临床与实验室标准化协会M100S(CLSI,2016 版)推荐的琼脂二倍稀释法测定抗菌药物对临床重要病原菌的MIC,以评估市售各厂牌左氧氟沙星的体外抗菌活性,为临床抗菌药物生物等效性评价提供参考。
1 材料与方法
1.1 试药与菌株
本研究所有药品均通过正规商业渠道购买,并在有效期内使用。左氧氟沙星15 个厂牌规格和批号如下,片剂(规格:0.5 g/片,批号:BW02661、20181023、181209;规格:0.1 g/片,批号:B181002031、181001、181201、00718009、180301、170409056);胶囊剂(规格:0.1 g/粒,批号:17020541、1809020、365181213、181201、1901210、41805311)。将原研左氧氟沙星厂牌第一三共制药标记为P1,其余厂牌将片剂随机标记为P2 ~P9,将胶囊剂随机标记为J1 ~J6。左氧氟沙星对照品(批号:130455-201607,含量以C18H20FN3O4计为97.3%,中国食品药品检定研究院)。研究所用临床菌株来自本院临床科室送检标本(包括痰、分泌物、尿液、腹水、组织、血液等)中分离出的金黄色葡萄球菌(Staphylococcus aureus,SA)48 株,铜绿假单胞菌(Pseudomonas aeruginosa,PA)52 株,大肠埃希菌(Escherichia coli,EC)54 株。质控菌株金黄色葡萄球菌(ATCC 29213)、铜绿假单胞菌(ATCC 27853)和大肠埃希菌(ATCC 25922)均由本院检验科提供。
1.2 仪器
Vitek2 Compact 全自动微生物分析仪、血培养瓶(法国生物梅里埃公司),M-H 琼脂、哥伦比亚血平皿、0.5 号麦氏标准比浊管等(重庆庞通公司),MIT-P 型细菌多点接种仪(日本Sakuma 公司),电子天平BP211D(赛多利斯公司),液相色谱系统Waters2690 高效液相色谱仪,数据的采集和处理用Millennium32 系统,双波长紫外检测器Waters 2487(美国Waters 公司)。
1.3 方法
按照2015年版《中国药典》对15 个厂牌左氧氟沙星的含量进行测定[5],进而制备抗菌药物的稀释液,药品稀释浓度范围见表1。细菌的接种和鉴定均按照《全国临床检验操作规程》(第4 版)[6]的要求进行。药敏试验参照CLSI[7]推荐的琼脂二倍稀释法测定各厂牌的MIC,每批实验均设立质控菌株,以确保整个实验的准确性。制备浓度相当于0.5 号麦氏标准比浊管的菌悬液,将菌悬液用多点接种仪接种至含药平皿,每点接种量为1×104CFU,置35℃孵育16 ~20 h 后观察结果,实验操作过程均严格按照CLSI 文件M07-A10[8]的规定进行,药敏折点标准依据CLSI 抗微生物药物敏感性试验的执行标准进行判读。最后计算各MIC值水平下的累积抑菌百分率,即在每个MIC值水平下被抑制住的细菌株数与细菌总株数的比值[9]。实验数据结果用Excel 2010 版进行描述分析,并使用GraphPad_prism8.0 版进行绘图比较。
2 结果
2.1 市售各厂牌左氧氟沙星含量结果
按照2015年版《中国药典》规定,左氧氟沙星的含量以左氧氟沙星(按C18H20FN3O4计)计应为标示量的90.0%~110.0%,对15 个厂牌进行含量测定,发现P4 和P9 两厂牌含量略低,分别是97.09%和97.28%;J1 和J4 两厂牌含量略高,分别为102.82%和102.48%,各厂牌结果均符合药典规定。具体结果见表2。

表1 左氧氟沙星各细菌MIC 质控范围及药品稀释浓度范围(µg·mL-1)Tab 1 MIC quality control range of levofloxacin and dilution concentration range of drugs (µg·mL-1)
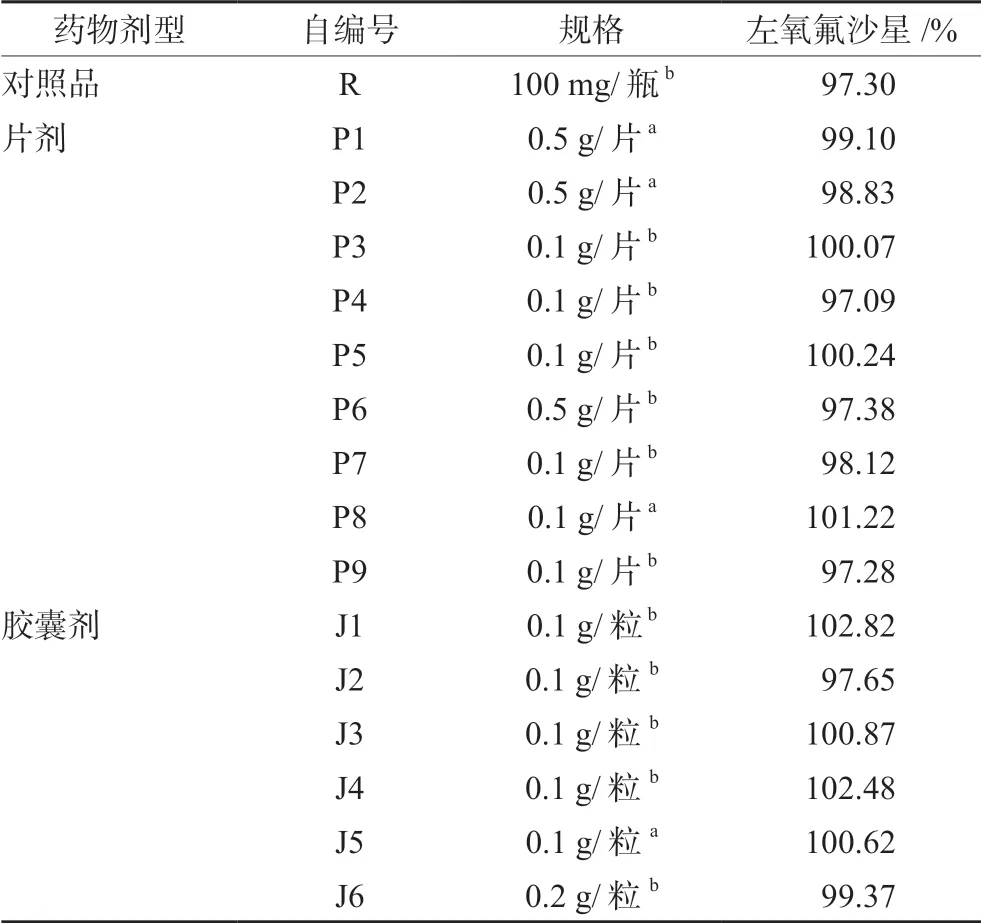
表2 各厂牌左氧氟沙星的含量Tab 2 Content of levofloxacin by various brands
2.2 市售各厂牌左氧氟沙星体外抗菌活性结果
对各厂牌左氧氟沙星进行SA、EC 和PA 的体外抗菌活性比较,结果见表3,发现所有厂牌对质控菌株的MIC结果均落在各菌种MIC质控范围内,MIC值相差不超过±1 个药物稀释梯度,对临床菌株的体外抗菌活性差异较明显。市售各厂牌左氧氟沙星对3 种临床分离菌株的体外抗菌活性结果见表4。原研药P1 在3 种临床菌株中均体现出更优的抗菌活性,P2、P4、P5、P6、P7、J1、J2、J3 与J6 的抗菌活性与原研药相当,其余厂牌相对较低。MIC50、MIC90分别表示抑制住50%和90%的细菌所需的最低药物浓度[6]。各厂牌对SA 的抗菌活性结果表明,P9 的MIC50为0.25 µg·mL-1,其余均 是0.125 µg·mL-1;P9 和J4 的MIC90为1µg·mL-1,其余均为0.5 µg·mL-1,MIC范围0.125µg·mL-1到2 或8 µg·mL-1不 等。对EC 的抗菌活性结果显示,尽管MIC90都是4 µg·mL-1,但P1、P6、J1、J2、J3MIC50低其余厂牌 一 半,MIC范围0.0078 µg·mL-1到8 或16 µg·mL-1不等,差异较明显。在对PA 的抗菌活性中发现,各厂牌的MIC50均是0.5 µg·mL-1,MIC90除P7 是1 µg·mL-1外,其余均为2 µg·mL-1。MIC范围从0.25 µg·mL-1到2 或8 µg·mL-1不等,个别厂牌对某些临床菌株的MIC值相差4 倍。依据CLSI 药敏折点,发现本研究中左氧氟沙星对SA、PA 的敏感率较高,对EC 的敏感率相对较低。
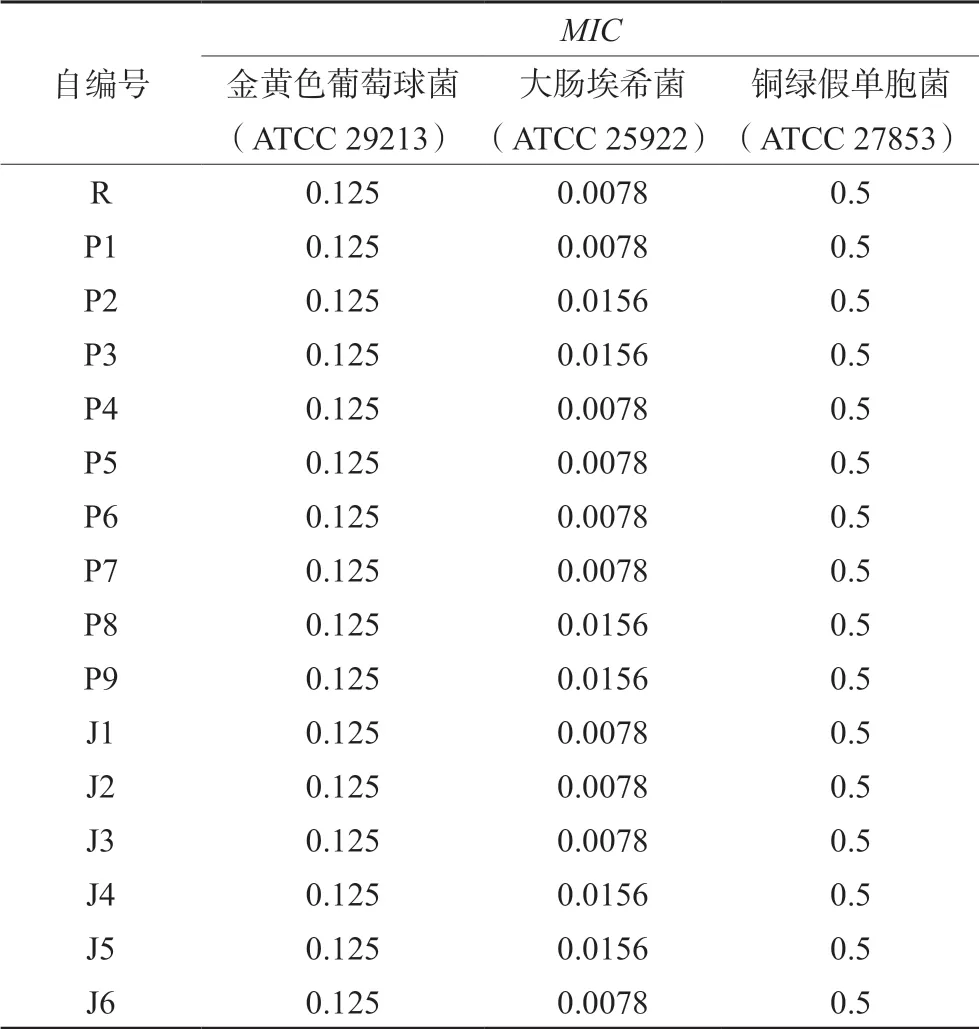
表3 市售各厂牌左氧氟沙星及对照品对质控菌株的体外抗菌活性结果(µg·mL-1)Tab 3 In vitro antibacterial activity of levofloxacin from commercially available brands and reference product against quality control strains (µg·mL-1)
2.3 累积抑菌百分率及耐药率情况分析
2.3.1 累积抑菌百分率 根据各厂牌对临床分离菌株的体外抗菌活性MIC范围,发现各厂牌左氧氟沙星在药物低浓度时的累积抑菌百分率差异更大,故选择SA、EC、PA 的MIC范围最低值(0.125、0.0078、0.25 µg·mL-1)下的累积抑菌百分率进行比较。图1A 显示,当最低值为0.125 µg·mL-1时,P7 和J3 对SA 的累积抑菌百分率最高均为66.67%,P6、P1 等厂牌次之,最低是P9 为39.58%;当最低值 为0.0078 µg·mL-1时,P1 和J2 对EC的累积抑菌百分率最高均为18.52%,J3 次之,而P2、P3、P8、P9、J4、J5 厂牌累积抑菌百分率为0%;当最低值为0.25 µg·mL-1时,P1 对PA 的累积抑菌百分率最高是19.2%,而最低是P9 仅为1.9%。该结果显示,在MIC最低值下各厂牌左氧氟沙星对3 种细菌的抑制情况存在差异,少数厂牌在此浓度下不足以抑制细菌生长,但某些厂牌如原研药却可以抑制住部分细菌的生长。
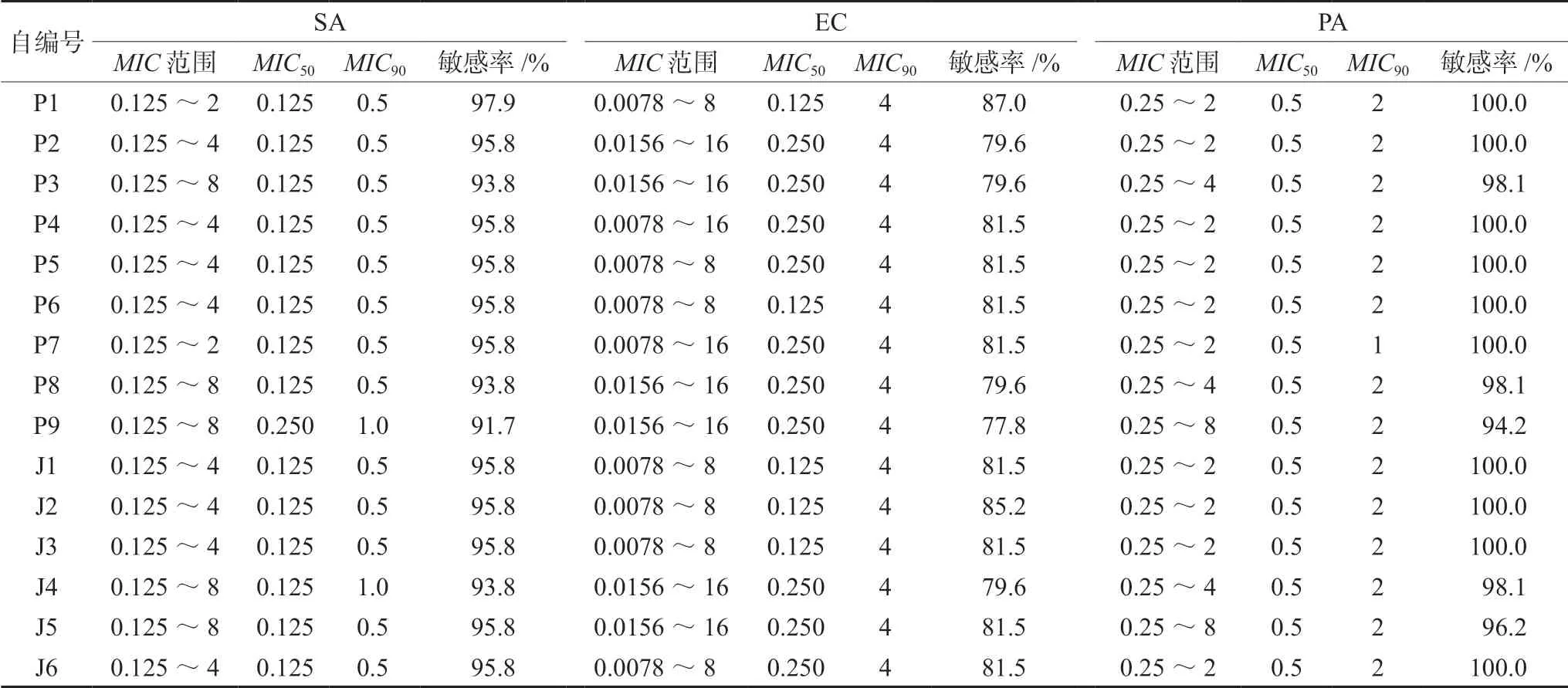
表4 各市售厂牌左氧氟沙星对临床分离菌株的体外抗菌活性结果(µg·mL-1)Tab 4 In vitro antibacterial activity of levofloxacin from various commercial brands against clinically isolated strains (µg·mL-1)
2.3.2 耐药率 依据CLSI 药敏折点标准,药物浓度≥4 µg·mL-1时表示SA 对其耐药,当药物浓度≥8 µg·mL-1时表示EC、PA 对其耐药,图1B 显示,SA 临床菌株对P9 的耐药率最高为8.33%,但对P1 和P7 没有出现耐药菌株。每个厂牌均出现EC 耐药菌株,其中耐药率仍是P9 最高为11.11%。PA 出现耐药的只有P9 和J5 两个厂牌。
2.4 P1、P9、J5 的临床菌株累积抑菌百分率对比分析
研究发现P9 的累积抑菌百分率较其他厂牌低,且PA 的临床菌株仅对P9 和J5 两个厂牌出现耐药。故选取仿制药P9 和J5 与原研药P1 进行对比。如图2所示,对SA 临床菌株,在MIC值0.125 µg·mL-1下,P1 的累积抑菌百分率为60.4%,而J5 为54.2%,P9 累积抑菌百分率最低为39.6%。对EC 临床菌株,仿制药P9 和J5 的累积抑菌百分率明显低于原研药P1,在MIC值0.0078 µg·mL-1下,P1 为18.5%,而P9 和J5 均为0%;在MIC值0.0156 µg·mL-1下,P1 为27.8%,而P9 和J5 均为16.7%;直到MIC值为0.25 µg·mL-1,P1、P9 为64.8%,J5 为63.0%,三者的累积抑菌百分率才几乎达到一致。对PA 临床菌株,在MIC值0.25 µg·mL-1下,P1 的累积抑菌百分率为19.2%,而J5 为7.7%,P9 只有1.9%。从以上数据得出,无论是SA、EC 还是PA,P1 对临床菌株的累积抑菌百分率始终高于P9 和J5,尤其是在较低药物浓度时差异更加明显。

图1 各厂牌在MIC 范围最低值下的累积抑菌百分率(A)和耐药折点下的耐药率(B)情况Fig 1 Accumulative inhibition percentage and drug resistance rate of each brand under the minimum value of MIC(A)and drug resistance breakpoint(B)
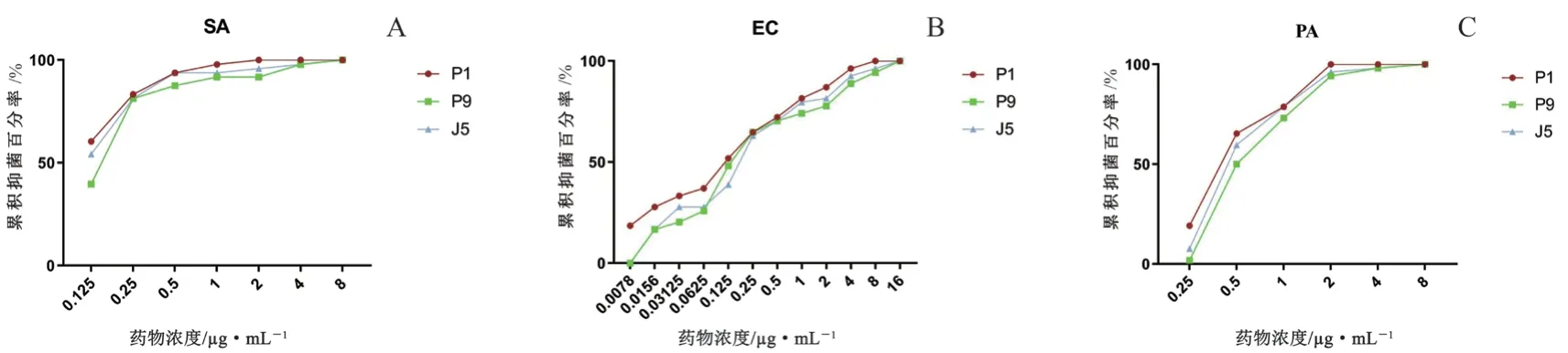
图2 P1、P9、J5 的临床菌株累积抑菌百分率对比情况Fig 2 Accumulative inhibition percentage of clinical strain of P1,P9 and J5
3 讨论
本研究结果显示,市售各厂牌左氧氟沙星对质控菌株的体外抗菌活性相似,对于临床菌株,有9 个厂牌与原研药的抗菌活性相当,敏感率接近,但有几个厂牌的抗菌活性与原研药存在明显差异,个别厂牌存在MIC值相差4 倍的情况。依据CLSI 药敏折点标准对各厂牌的耐药率进行分析发现,P9 的耐药率始终比其他厂牌高。左氧氟沙星因其抗菌谱广抗菌活性强已成为临床中最常用的抗感染药物之一,常用于肺炎、鼻窦炎、支气管炎、尿路感染以及肾盂肾炎的临床治疗用药或经验用药[10]。抗感染治疗成功的关键是抗菌药物的浓度要达到治愈感染所需的MIC[11],本研究结果显示,左氧氟沙星原研药对临床菌株的抗菌活性优于某些仿制药,尤其是在较低药物浓度时差异更加明显,这种差异很可能在临床治疗时导致治疗效果的不同。当体内药物浓度较低时,感染细菌会在“亚抑菌浓度”下存活,为耐药突变体创造有利的环境,增加产生耐药的风险[12]。
抗菌药物在我国的生产厂牌多,使用量大且几乎都是仿制药,若质量欠佳不仅可能导致临床治疗失败还会引起细菌耐药,开展抗菌药物一致性评价工作更应严格把关。生物等效性试验是确保“质量和疗效一致性”至关重要的一步,以药动学参数为终点评价指标的生物等效性通常采用Cmax和AUC进行评价[13],但抗菌药物作用特殊,它并不直接作用于人体,而是作用于体内的细菌,它既可能杀灭或抑制细菌生长,也可能诱导细菌耐药。基于药代动力学/药效学(pharmacokinetic/pharmacodynamic,PK/PD)特性制订的抗菌治疗方案,可使抗菌药物在人体内达到最大杀菌活性,保证临床疗效和安全性,并减少细菌耐药性的发生和发展。《抗菌药物药代动力学/药效学理论临床应用专家共识》指出,衡量氟喹诺酮类最佳PK/PD 指数及临床疗效靶值是AUC0~24/MIC[14]。面对临床复杂的细菌耐药情况,有厂牌出现MIC值相差4 倍的情况,AUC/MIC的差距可想而知。有文献报道,用常规生物等效性指标评价两种抗菌药物等效,但在临床治疗上却有显著性差异[15]。因此,对抗菌药物仿制药的体外抗菌活性评估也应该进行相应的技术细化,如本研究中所采用的各MIC值水平下的累积抑菌百分率指标,是否可以成为考察抗菌药物生物等效和临床等效间相关性的重要前提“参数”,值得进一步研究。这样在评价抗菌药物的等效性试验时,就需要根据抗菌药物的作用特点,在常用生物等效性指标Cmax、Tmax和AUC的基础上,引入MIC以上有效的AUC和MIC以上浓度的持续时间等指标进行评价。
抗感染治疗的失败是主要的医疗问题之一,特别是在发展中国家[16],尽管仿制药的使用减少了医保以及患者的经济负担,但这不应以治疗效果欠佳以及耐药风险增加作为代价,寻求社会医疗成本的节省不能成为药物进入市场的唯一标准。本研究中各厂牌左氧氟沙星的含量相近,对质控菌株的MIC结果差异不大,因为质控菌株是一类特征明确的标准菌种,遗传学特性得到确认和保证并可追溯,且对抗菌药物具有高敏感性。而临床菌株来自于各个科室的各类标本,更易出现变异而导致耐药,所以各厂牌左氧氟沙星对临床菌株的体外抗菌活性存在一定差异。导致这种差异可能的原因很多,如制剂所使用原料药的纯度、晶型或者有关物质等与原研药存在差异,这会直接影响到制剂质量[17]。仿制药中不同的赋形剂或添加剂等辅料也会对药品质量产生影响[18],患者还可能会对特定产品中的辅料产生不良反应,使用仿制药可能会增加不良反应的发生率[19]。另外,仿制药即使与原研药原料一致,若制备工艺未达到最优化,质量上也会产生差异[20]。有研究表明,左氧氟沙星仿制药制剂质量差可能是导致其耐药的重要原因[21]。临床选择治疗药物时既要考虑到仿制药降低医疗成本的优势,也应注意可能存在的疗效不一致问题。
本研究存在一些局限性。首先,本研究并未对所有市售左氧氟沙星厂牌进行测试,但鉴于本研究选择的15 个厂牌的产品均为市场上常见的品规,故选择该15 个厂牌进行实验是具有代表性的。其次,本研究仅通过含量测定和体外抗菌活性来评价左氧氟沙星仿制药和原研药之间的差异,而没有做进一步的体内研究如动物模型或健康志愿者上市后的临床研究。最后,本研究没有考察仿制药和原研药中添加剂及赋形剂等辅料的影响,这可能是体外抗菌活性不同的原因之一,之后将针对上述几个方面做更深一步的研究。
4 结论
本研究结果显示市售各厂牌左氧氟沙星仿制药对临床重要致病菌的体外抗菌活性较原研药存在差异,建议在对抗菌药物进行仿制药一致性评价时应结合其PK/PD 特性,引入基于各MIC值水平下的累积抑菌百分率进行对比,确保仿制药在真实的临床细菌耐药情况下与原研药具有相同的抗菌活性。无论是浓度依赖性抗菌药物的Cmax/MIC、AUC/MIC还是时间依赖性的%T>MIC,临床感染细菌MIC的变化(差异)会对抗菌药物的临床治疗效果产生重要影响[22]。建议定期对市售不同厂牌抗菌药物进行体外抗菌活性测定。
致谢:特别感谢重庆医科大学附属儿童医院药学部/儿童发育疾病研究教育部重点实验室/国家儿童健康与疾病临床医学研究中心贾运涛教授对本文的指导与帮助。

