刘氏正骨方对BMSCs成骨分化中Wnt信号通路及Sclerostin基因的影响∗
吴 毛 王建伟 冯 骅 尹 恒 华 臻 俞云飞
(江苏省无锡市中医医院,江苏 无锡 214000)
骨折是以骨小梁组织连续性破坏为特点,骨组织的修复与重建是在多种组织因子和细胞参与下共同完成。中医学将其归属到“骨折病”范畴,认为骨折必损伤经脉气血,致血脉离经妄行、血瘀留滞。“刘氏骨伤”作为无锡市非物质文化遗产[1],经多代传人总结形成本院经验方—刘氏正骨方,具有“活血祛瘀,接骨续筋”功效,且临床疗效显著[2-3],但有关其促进骨折愈合的具体作用机制尚不明确。近年来有关中药促进骨折愈合多集中于调节骨代谢、促进成骨细胞形成等方面,其中骨髓间充质干细胞(BMSCs)作为骨组织干细胞主要来源,可以在BMP、Wnt信号通路等多种生物信息网调节下促成骨分化[4]。现代研究表明[5-6],Wnt信号通路及其下游靶基因Rnux2、OSX是调节成骨分化的关键路径。硬骨素(Sclerostin/SOST)可以通过抑制Wnt信号通路从而负向调节成骨代谢[7]。我们前期研究发现[8],通过siRNA抑制Sclerostin基因表达可以促进BMP-4体外诱导BMSCs成骨分化过程。因此,本研究依托无锡市科教强卫项目(ZDRC025),设计实验探讨刘氏正骨方对BMSCs体外成骨分化的影响及其可能作用机制,为刘氏正骨方治疗骨折病提供理论基础,并为其应用于治疗骨折提供新的思路。
1 材料与方法
1.1 试剂和仪器
DMEM(Hyclone,美国);胎牛血清(GlBICO,美国);胰蛋白酶(Sigma,美国);CCK-8试剂盒(Abcam,美国);茜素红(Sigma,美国);总蛋白提取试剂盒(上海碧云天公司,中国);一抗:Col1A2、OCN、OPN、Scleros⁃tin、LRP5、Runx2及GAPDH均为美国Abcam公司产品。二抗:山羊抗兔抗体和马抗小鼠抗体为美国CST公司产品;NanoDrop 2000(Thermo&Scintific,美国);细胞计数仪和Trizol(Invitrogen,美国);实时PCR试剂盒(TOYOBO,中国);实时PCR仪(RocheLightCycler480,德国);PCR反应体系和反转录试剂盒(Fermentas,美国);SDS-PAGE凝胶配制试剂盒和ECL发光液(上海碧云天公司,中国)。
1.2 含药血清制备
刘氏正骨方(丸剂)组成:地鳖虫2 g,血竭1 g,川芎1 g,乳香1 g,没药1 g,白术1 g,丁香1 g,杜仲1 g,骨碎补3 g,党参2 g,当归3 g,黄芪 1 g,自然铜 1 g,熟地黄3 g,苏木3 g等。无锡市中医医院药剂室制备,溶解、浓缩为最终质量浓度0.45 g/mL生药,置于4℃冰箱保存。取与中药汤剂相同剂量的0.9%氯化钠溶液配置成对照溶液。中药血清制备:取体质量100~150 g SD大鼠,依据《药理试验中动物间和动物与人体间的等效剂量换算》计算实际大鼠灌药剂量,终末灌服质量浓度0.45 g/mL。空白血清组给予等量生理盐水。每天灌药8∶00、20∶00分别灌服1次,连续7 d,第7天上午8∶00灌注全天量,灌服后1 h后于下腹主动脉采血,经静置、离心、灭活补体、过滤除菌等步骤制得,分装并标记含中药血清和空白血清,放置于-20℃保存备用。
1.3 BMSCs分离与培养
分离:取体质量100~150 g SD大鼠,采取断颈法处死后消毒、剥离并折断胫骨及股骨,用含双抗PBS液(终浓度为青霉素100 U/mL和链霉素100 μg/mL)冲洗出骨髓细胞,离心去上清液、PBS重悬,细胞计数。培养:按4×105个/cm2密度将细胞均匀接种于MGM培养基,加入10% FBS、1%双抗,37℃、5% CO2环境的恒温箱中培养,3 d换液1次,继续培养7 d后收集细胞,取部分用于实验,部分液氮冷藏保存。
1.4 BMSCs成骨分化诱导及分组
将BMSCs按1×105个/cm2密度接种于六孔板,使用MGM培养基培养24 h后进行试验。依据干预培养条件分为对照组(含10%空白血清)、中药组(10%中药血清)、BMP-2组(含BMP-2 50 ng/mL),每2日更换1次培养液,在第28天时收集细胞进行实验。采用CCK-8检测细胞活性;采用实时荧光PCR和Western blotting检测成骨分化相关分子(Col1A2、OCN、OPN)及Scleros⁃tin基因的mRNA和蛋白水平表达情况;采用ALP和茜素红染色检测细胞矿化程度。
1.5 含药血清对Sclerostin基因浓度依赖性研究
将BMSCs按1×105个/cm2密度接种于六孔板,使用MGM培养基培养24 h后,依据中药血清浓度分4组:对照组(含10%空白血清)、低浓度组(2.5%中药血清)、中浓度组(5%中药血清)、高浓度组(含10%中药血清),使用空白血清调配使各组最终血清终浓度为10%,每2天更换1次培养液,在第14天时收集细胞进行实验。
1.6 标本采集与检测
1.6.1 CCK-8法检测细胞活性 将BMSCs按1×106个/cm2密度接种于96孔板中,每组设3个复孔,培养24 h后进行干预实验,干预结束后在避光处加入配置好的CCK-8溶液,37℃孵育2 h,再用酶联免疫检测仪OD 450 nm处测量各孔的吸光值并计算。
1.6.2 DNA含量分析 将BMSCs按3×105个/cm2密度接种于96孔板中,每组设3个复孔,24 h后进行干预实验,实验结束后收集细胞样本。DNA含量由CyQUANT细胞增殖检测试剂盒测量;其中,激发波长为450 nm,发射波长为530 nm。
1.6.3 实时荧光PCR法 收集细胞样品,抽取总RNA,以2 μg反转20 μL体系进行反转录。检测目的基因的mRNA表达。将反转的cDNA稀释5倍,进行实时PCR。扩增体系为10.0 μL,反应条件:95℃预变性30 s;95℃ 5 s、60℃ 25 s,扩增50个循环。溶解曲线分析:95℃5 s;溶解曲线为单一峰说明是特异性扩增,阴性对照为ddH2O,GAPDH为内参,每个模板做3个复孔,结果使用相对定量2-ΔΔCt方法分析。引物序列详见表1。

表1 实时聚合酶链反应引物序列
1.6.4 Western blotting法 收集细胞样品,使用蛋白提取缓冲液RIPA和蛋白酶抑制剂PMSF提取蛋白,经冰上静置、4℃离心后采用BCA法检测蛋白浓度,SDSPAGE电泳,用0.22 μm孔径的PVDF膜转膜,经封闭、一抗孵育、洗涤、孵育二抗后,常规ECL发光液显色。
1.6.5 ALP染色与茜素红染色 使用固紫B试剂盒(购自Sigma公司)和茜素红钙染色试剂盒(购自Sig⁃ma公司)分别进行染色,并通过倒置显微镜观察拍照记录。
1.7 统计学处理
应用PASS Statistics 22.0统计软件。计量资料以(±s)表示,两独立样本采用t检验,多样本采用单因素相差分析,方差不齐采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组BMSCs细胞活性及成骨分化的比较
细胞活性实验:与对照组相比,中药组和BMP-2组细胞活性明显增高(P<0.05);中药组和BMP-2组中的DNA含量也相应增高。见表2。成骨分化实验:与对照组相比,中药组和BMP-2组细胞ALP活性明显增强(P<0.05),且BMP-2组效果最强(P<0.05)。茜素红染色结果:中药组和BMP-2组细胞外矿化程度明显高于对照组(P<0.05),且BMP-2组效果最强。成骨相关基因Col1A2、OCN和OPN mRNA和蛋白水平表达情况也呈现相同趋势。相较于对照组和BMP-2组,中药组中Sclerostin基因表达明显抑制。见图1~图2,表2~表3。

图1 刘氏正骨方含药血清上调BMSCs细胞ALP活性及细胞矿化

图2 各组Col1A2、OCN、OPN蛋白水平表达比较
表2 各组BMSCs细胞增殖和矿化现象比较(±s)
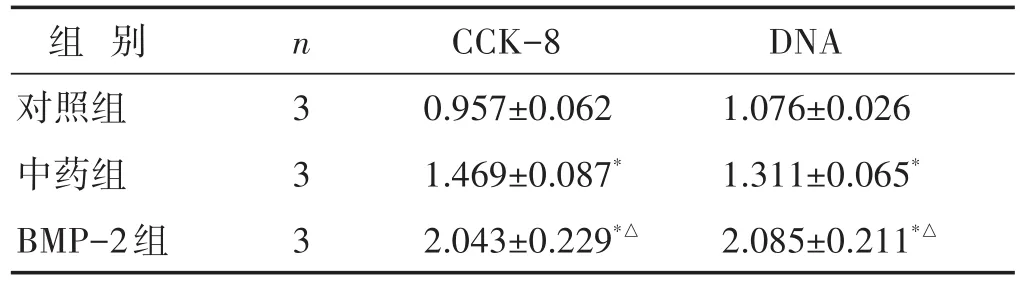
表2 各组BMSCs细胞增殖和矿化现象比较(±s)
注:与本组治疗前比较,∗P<0.05;与中药组比较,△P<0.05。下同。
组别对照组中药组BMP-2组n 3 3 3 CCK-8 0.957±0.062 1.469±0.087*2.043±0.229*△DNA 1.076±0.026 1.311±0.065*2.085±0.211*△
表3 各组BSMC中成骨相关基因与Sclerostin基因mRNA表达比较(±s)

表3 各组BSMC中成骨相关基因与Sclerostin基因mRNA表达比较(±s)
组别对照组中药组BMP-2组n 3 3 3 ALP活性1.014±0.103 1.723±0.128*3.811±0.262*△茜素红定量1.047±0.026 1.623±0.244*3.643±0.391*△Col1A2 1.091±0.054 1.526±0.172*3.626±0.366*△OCN 1.083±0.031 1.663±0.219*2.823±0.263*△OPN 1.130±0.064 1.783±0.148*3.533±0.453*△Sclerostin 1.074±0.036 0.911±0.072*4.533±0.725*△
2.2 各组BMSCs活性的比较
见表4。使用不同浓度刘氏正骨方含药血清处理BMSCs 14 d后发现,与对照组相比,BMSCs细胞活性和DNA含量结果表明低浓度组、中浓度组无明显差异(P>0.05),但高浓度组细胞活性增强,DNA含量增多(P<0.05)。
表4 各组BMSCs细胞活性及Wnt信号通路相关基因表达(±s)

表4 各组BMSCs细胞活性及Wnt信号通路相关基因表达(±s)
组别对照组低浓度组中浓度组高浓度组n 3 3 3 3 CCK-8 1.045±0.027 1.121±0.060 1.204±0.122 1.551±0.081*DNA 1.034±0.077 1.078±0.071 1.150±0.091 1.457±0.069*LRP5 1.075±0.046 1.170±0.106 1.276±0.093 1.626±0.203*Runx2 1.069±0.034 1.207±0.067 1.449±0.226 2.039±0.084*Sclerostin 1.031±0.115 0.924±0.071 0.827±0.085 0.737±0.049*
2.3 各组Sclerostin、LRP5、Runx2基因表达的比较
见图3,表4。与对照组相比,高浓度含药血清可以下调Sclerostin基因表达,上调Wnt信号通路中关键分子LRP5蛋白以及下游靶基因成骨关键转录因子Runx2蛋白的表达,但低浓度和中浓度组无明显统计学差异(P>0.05)。
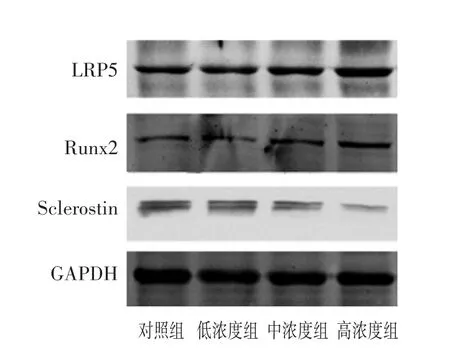
图3 各组Sclerostin、LRP5、Runx2基因蛋白水平的表达
3 讨论
“刘氏骨伤”为无锡市非物质文化遗产[1],由多代传人总结、完善形成,该方中骨碎补等补肾壮骨,土鳖虫等活血续筋,熟地黄补血养阴,党参等补益气血,血竭等活血散瘀消肿,诸药合用共奏活血祛瘀、补肾养肝之功效。我们前期临床研究也表明[4-5],刘氏正骨方可以有效地促进患者骨折愈合,但其具体作用机制尚不明确。
现代中医药促进骨修复与重建的研究多聚焦于骨代谢调节机制等方面。目前研究表明[9],活血化瘀类中药可以改善局部微循环、促进骨组织细胞活性与增殖;补肾壮骨类药可以加快骨代谢、增加骨含量。骨折愈合的关键在于骨组织再生与重建,而成骨细胞主要来源于干细胞的定向分化。BMSCs属于多向分化干细胞,可在特定刺激下发生促成骨分化,该过程是由多种细胞因子和信号通路共同参与调控[10]。BMP-2可以通过Wnt、MAPK等多种信号通路以及Runx2、Osterix等相关转录因子促进成骨分化[6]。ALP、细胞矿化现象是评价成骨分化早期和晚期的重要标志;Col1A2、OCN、OPN是成骨源性细胞中反应骨转化与形成的特异性标志;Sclerostin可负向调控成骨分化[11]。本次研究结果显示:中药血清可以增强BMSCs细胞活性与ALP活性,而细胞增殖程度是BMSCs促成骨分化的基础,而Col1A2、OCN、OPN基因也呈现上调趋势,提示刘氏正骨方可以促进BMSCs成骨分化,可能是其活血祛瘀、补肾养肝的微观体现。
Sclerostin早期被作为一种非经典BMP拮抗剂,可与BMP的Ⅰ型和Ⅱ型受体竞争性结合抑制BMP信号通路,从而负调控成骨分化过程[11]。我们前期研究表明[8],通过siRNA抑制Sclerostin基因表达可以上调BMP-4诱导BMSCs成骨分化。近年来有研究发现[7,13],补肾强督类中药复方可以通过体上调Scleros⁃tin基因表达来抑制BMSCs成骨分化。本次研究结果发现BMP-2可以上调BMSCs中Sclerostin基因表达,这与既往研究结果相一致[12],但中药组中Sclerostin基因呈现下调趋势。近年来研究发现[11,14],Sclerostin蛋白抑制成骨分化并非主要通过Smad信号通路,而是通过与Wnt/β-catenin信号通路中关键受体Lrp5/6中的El螺旋区域竞争性结合,促使GSK-3β对β-catenin的磷酸化,从而抑制Wnt/β-catenin信号激活以及下游转录因子Runx2的表达,从而负向调控成骨分化过程,其中Runx2是正向调节BMSCs促成骨分化的关键转录因子[5]。因此,我们设计实验进一步探究刘氏正骨方含药血清促进BMSCs成骨作用与Sclerostin基因之间的关系。实验结果显示高浓度刘氏正骨方含药血清浓度可增强BMSCs细胞活性,这可能与下调Sclerostin基因后抑制成骨细胞程序性凋亡而延长细胞寿命有关[16]。高浓度刘氏正骨方含药血清可抑制BMSCs中Scleros⁃tin基因表达,且上调Wnt通路中LRP5和Runx2的表达,提示刘氏正骨方含药血清可能是通过抑制Scleros⁃tin基因表达、激活Wnt信号通路途径,从而促进BSMCs成骨分化过程。
综上所述,刘氏正骨方含药血清可以体外促进BMSCs成骨分化,该过程可能与抑制Sclerostin基因表达,激活Wnt信号通路及下游Runx2转录因子有关。本研究初采用现代细胞学、分子生物学等技术手段对刘氏骨伤理论中活血祛瘀,接骨续筋理论进行微观验证,为中医药治疗骨折提供新的理论方向与实验依据。
本实验不足:由于本次实验不涉及动物实验,无法观察对组织水平的影响;本研究仅探究Wnt通路,还可能有如BMP/Smad信号通路、MSX2转录因子等其他因素参与调节,在其他生物信息网络中的作用还有待进一步探究。

