加味宫外孕Ⅱ号方对HTR-8/SVneo细胞内质网应激JNK信号通路的凋亡作用
简咏男 郑文兰
1.贵州中医药大学研究生院,贵州贵阳 550002;2.贵州中医药大学第一附属医院妇科,贵州贵阳 550000
异位妊娠(ectopic pregnancy,EP)是指孕卵在子宫体腔以外着床,其中输卵管妊娠最为常见,占95%左右[1]。随着患者逐渐年轻化及二孩政策的开放,要求保留生育功能的患者增多[2],因此中医药的应用也受到了相应的重视。加味宫外孕Ⅱ号方治疗EP 在贵州中医药大学第一附属医院应用多年,其临床疗效好,前期研究表明该方有破坏滋养细胞超微结构、诱导细胞凋亡的作用[3],但杀胚的具体机制尚不清楚。据文献报道,通过内质网应激(ERS)诱导细胞凋亡,是一条新的细胞凋亡信号传导通路,许多疾病的防治都与过度ERS 引起的细胞凋亡有关[4],但加味宫外孕Ⅱ号方是否通过ERS 途径发挥药效来治疗EP 尚未见报道。本研究以人绒毛膜滋养层细胞株(HTR-8/SVneo)细胞作为研究对象,采用Western blot 及实时荧光定量PCR(qRT-PCR)法,探讨加味宫外孕Ⅱ号方对滋养细胞凋亡的相关机制,为临床上加味宫外孕Ⅱ号方保守治疗EP 提供实验依据。
1 材料与方法
1.1 动物与细胞
SPF 级SD 健康雌性大鼠36 只,体重180~220 g,购于湖北省实验动物研究中心,本实验通过湖北省实验动物管理与使用委员会批准(20182901),实验动物生产许可证号:SCXK(鄂)2015-0018,每次灌胃前禁食12 h,不禁水,给药2 h 后恢复食物;HTR-8/SVneo购于华中科技大学同济医学院附属协和医院。
1.2 实验药物
加味宫外孕Ⅱ号方(丹参15 g、赤芍15 g、桃仁9 g、三棱9 g、莪术9 g、蜈蚣4 g、全蝎6 g、土鳖虫10 g、紫草25 g)由贵州中医药大学第一附属医院中药房提供,水煎浓缩成3 g/mL 的药液,4℃保存备用;甲氨喋呤:广东岭南制药有限公司,批号:872016。
1.3 主要仪器及试剂
qRT-PCR 仪(美国ABI);离心机(湖南湘仪);BCA 蛋白浓度测定试剂盒(上海碧云天生物技术有限公司;P0010);逆转录试剂盒及荧光定量试剂盒(南京诺唯赞生物科技股份有限公司;Q111-02);引物合成(武汉擎科生物技术有限公司);兔抗GAPDH 一抗(杭州贤至生物科技有限公司;AB-P-R 001);兔抗IRE1一抗(武汉三鹰生物技术有限公司;27528-1-AP);兔抗TRAF2、ASK1 一抗及辣根过氧化物酶标记的羊抗兔二抗(武汉博士德生物工程有限公司;BA1444-2、BM4220、BA1054);兔抗JNK1、JNK2、p-JNK 一抗(英国Abcam;ab199380、ab76125、ab4821)。
1.4 含药血清的制备
36 只大鼠适应性饲养1 周后,采用随机数字表法分为六组,即阴性对照组,中药低、中、高剂量组,西药组,中西药结合组,每组6 只。由人与大鼠等效剂量换算,以成人(体重以60 kg 计)每日用药量的等效剂量比1∶7[5]为加味宫外孕Ⅱ号方低剂量组给药剂量,低剂量的2 倍为中剂量组,低剂量的4 倍为高剂量组给药剂量,即加味宫外孕Ⅱ号方低、中、高灌胃剂量分别为12、24、48 g/(kg·d);阴性对照组予中药中剂量等体积的生理盐水灌胃;西药组予中药中剂量等体积的生理盐水灌胃,并在取血前1 h 一次性肌注甲氨喋呤7.775 mg/kg;中西药结合组予中药中剂量灌胃,并在取血前1 h 一次性肌注甲氨喋呤7.775 mg/kg。中药及生理盐水灌胃为1 次/d,连续8 d;西药1 次为1 个疗程。于末次给药1 h 后在麻醉下行心脏采血,将取得的血液标本静置2 h,3000 r/min离心10 min,离心半径为12.5 cm,吸取血清,微孔滤器过滤,水浴灭活,将同组血清混合,各组分装,-80℃冰箱保存。
1.5 细胞培养和干预
将HTR-8/SVneo 细胞培养于含10%胎牛血清(FBS)+1%青链霉素(penicillin-streptomycin solution)的1640 培养基中,细胞培养条件为37℃恒温培养,二氧化碳浓度为5%,待细胞的密度达到80%时,用胰蛋白酶消化传代。取第5 代对数生长期的HTR-8/SVneo 细胞随机分为七组,即空白对照组,阴性对照组,中药低、中、高剂量组,西药组,中西药结合组,培养24 h。再将各组别的含药血清分别与相对应组别的细胞共培养,24 h 后收集细胞用于后续实验。空白对照组为未用血清处理的细胞,以排除血清成分复杂所带来的干扰。
1.6 Western blot 法
Western blot 法测定IRE1α、TRAF2、ASK1、JNK1、JNK2、p-JNK 蛋白表达,具体参照前期课题组方法[6]。
1.7 qRT-PCR 法
qRT-PCR 法 测 定IRE1α、TRAF2、ASK1、JNK1、JNK2 基因表达具体,参照前期课题组方法[6]。引物序列及产物大小详见表1。
1.8 统计学方法
采用SPSS 25.0 对所得数据进行统计学分析,计量资料采用均数±标准差(±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间均数两两比较采用LSD 及S-N-K 分析。以P <0.05 为差异有统计学意义。
2 结果
2.1 各组HTR-8/SVneo 细胞中IRE1α、TRAF2、ASK1、JNK1、JNK2、p-JNK 蛋白表达情况比较
与空白对照组比较,阴性对照组IRE1α、TRAF2、ASK1、JNK1、JNK2、p-JNK 蛋白表达量无明显变化(P >0.05)。与阴性对照组比较,中药各剂量组、西药组及中西药结合组除JNK1、JNK2 外,IRE1α、TRAF2、ASK1、p-JNK 蛋白表达量均增加,差异均有统计学意义(均P <0.05);与中药低剂量组比较,中药中剂量组中TRAF2 蛋白表达量减少,差异有统计学意义(P <0.05),在中药高剂量组、西药组及中西药结合组中TRAF2 蛋白表达量均增加,差异均有统计学意义(均P <0.05)。与中药低剂量组比较,中药中剂量组、中药高剂量组、西药组及中西药结合组IRE1α、ASK1、p-JNK蛋白表达量均增加,差异均有统计学意义(均P <0.05);与中药中剂量组比较,中药高剂量组中ASK1 蛋白表达量无明显变化(P >0.05),西药组及中西药结合组ASK1 蛋白表达量均增加,差异均有统计学意义(均P <0.05)。与中药中剂量组比较,中药高剂量组、西药组及中西药结合组IRE1α、TRAF2、p-JNK 蛋白表达量均增加,差异均有统计学意义(均P <0.05);与中药高剂量组比较,西药组TRAF2 蛋白表达量增加,差异有统计学意义(P <0.05),中西药结合组TRAF2 蛋白表达量无明显变化(P >0.05)。与中药高剂量组比较,西药组及中西药结合组IRE1α、ASK1、p-JNK 蛋白表达量均增加,差异均有统计学意义(均P <0.05);与西药组比较,中西药结合组IRE1α 蛋白表达量无明显变化,差异无统计学意义(P >0.05),ASK1 蛋白表达量增加,差异有统计学意义(P <0.05),而TRAF2、p-JNK 蛋白表达量均减少,差异均有统计学意义(均P <0.05)。见图1、表2。

表1 基因引物序列及大小
2.2 各组HTR-8/SVneo 细胞中IRE1α、TRAF2、ASK1、JNK1、JNK2 mRNA 表达情况比较
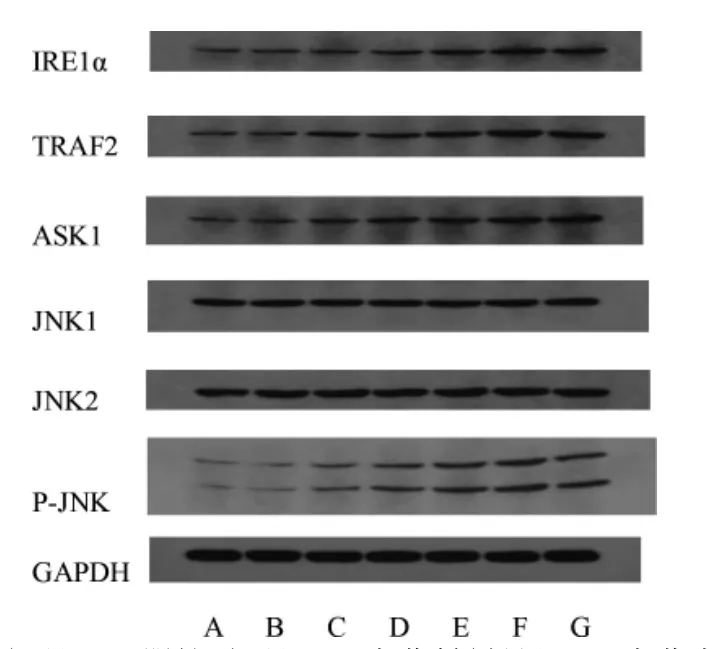
图1 各组HTR-8/SVneo 细胞中IRE1α、TRAF2、ASK1、JNK1、JNK2、p-JNK 蛋白表达的电泳图
与空白对照组比较,阴性对照组IRE1α、TRAF2、ASK1、JNK1、JNK2 mRNA 表达量无明显变化(P >0.05)。与阴性对照组比较,中药各剂量组、西药组及中西药结 合 组IRE1α、TRAF2、ASK1、JNK1、JNK2 mRNA 表达量均增加,差异均有统计学意义(均P <0.05);与中药低剂量组比较,中药中剂量组中TRAF2、JNK2 mRNA 表达量无明显变化(P >0.05),中药高剂量组、西药组及中西药结合组TRAF2、JNK2 mRNA 表达量均增加,差异均有统计学意义(均P <0.05)。与中药低剂量组比较,中药中剂量组、中药高剂量组、西药组及中西药结合组IRE1α、ASK1、JNK1 mRNA 表达量均增加,差异均有统计学意义(均P <0.05);与中药中剂量组比较,中药高剂量组ASK1 mRNA 表达量无明显变化(P >0.05),西药组和中西药结合组ASK1 mRNA 表达量均增加,差异均有统计学意义(均P <0.05)。与中药中剂量组比较,中药高剂量组、西药组及中西药结合组IRE1α、TRAF2、JNK1、JNK2 mRNA表达量均增加,差异均有统计学意义(均P <0.05);与中药高剂量组比较,西药组和中西药结合组IRE1α、JNK1 mRNA 表达量均增加,差异均有统计学意义(均P <0.05),西药组和中西药结合组TRAF2、ASK1、JNK2 mRNA 表达量无明显变化(P >0.05);与西药组比较,中西药结合组IRE1α、ASK1、JNK1、JNK2 mRNA表达量无明显变化(P >0.05),TRAF2 mRNA 表达量减少,差异有统计学意义(P <0.05)。见表3。
表2 各组HTR-8/SVneo 细胞中IRE1α、TRAF2、ASK1、JNK1、JNK2、p-JNK 蛋白表达情况比较(±s,n=3)

表2 各组HTR-8/SVneo 细胞中IRE1α、TRAF2、ASK1、JNK1、JNK2、p-JNK 蛋白表达情况比较(±s,n=3)
注:与阴性对照组比较,*P <0.05;与中药低剂量组比较,▲P <0.05;与中药中剂量组比较,★P <0.05;与中药高剂量组比较,◆P <0.05;与西药组比较,△P <0.05
表3 各组HTR-8/SVneo 细胞中IRE1α、TRAF2、ASK1、JNK1、JNK2 mRNA 表达情况比较(±s,n=3)
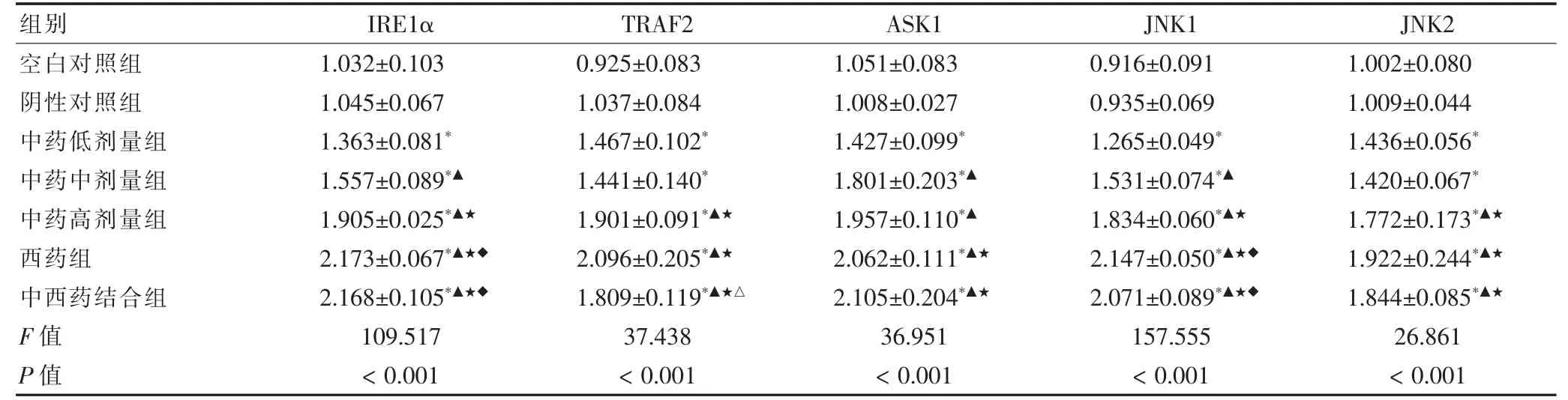
表3 各组HTR-8/SVneo 细胞中IRE1α、TRAF2、ASK1、JNK1、JNK2 mRNA 表达情况比较(±s,n=3)
注:与阴性对照组比较,*P <0.05;与中药低剂量组比较,▲P <0.05;与中药中剂量组比较,★P <0.05;与中药高剂量组比较,◆P <0.05;与西药组比较,△P <0.05
3 讨论
细胞凋亡为细胞的程序性死亡,凋亡过程受细胞内一系列分子的调控[7]。MAPK 为一类丝蛋白/苏氨酸蛋白激酶,是细胞内外信号传导的主要传导分子之一[8]。JNK 信号通路是MAPK 家族主要成分之一,在细胞凋亡中也是重要的信号通路,与多种疾病发生发展密切相关[9-13]。已有研究表明,JNK 信号通路参与了过度ERS 所引发的细胞凋亡[14]。最新研究表明ERS 是诱导细胞凋亡的关键分子机制,现阶段研究认为ERS 发生的主要原因是内质网折叠蛋白功能异常,导致错误蛋白在内质网内堆积,短时间的ERS 是细胞自我修复的一种方法,但长期ERS 发生即可引起细胞凋亡[15-16]。ERS 需3 种内质网跨膜蛋白即PERK、IRE1 和ATF6介导[17]。
IRE1 是ERS 的传感器,它可以将内质网的应激信号传递给细胞质和细胞核[18],其自身具有核酸内切酶活性,IRE1α 是其中一种亚型,广泛存在于各种细胞中[19]。在非ERS 条件下,IRE1α 与内质网分子伴侣结合在一起,处于无活性的状态。当内质网内异常折叠的蛋白聚集引起ERS 反应时,内质网分子伴侣就会与IRE1α 解离,活化后的IRE1α 可以募集TRAF2,IRE1α 与TRAF2 共同激活ASK1,形成IRE1α/TRAF2/ASK1 三聚体,可促使JNK 的磷酸化激活形成p-JNK[20],最终导致细胞凋亡。Chen 等[21]认为IRE1 是决定细胞生存或者凋亡的关键,因此可通过检测IRE1α 来判断是否发生了过度ERS,那么,在HTR-8/SVneo 细胞中是否也存在内质网跨膜蛋白IRE1α 的激活呢?邓高丕课题组认为体外培养的输卵管妊娠滋养细胞与正常宫内早孕滋养细胞相似,故选用HTR-8/SVneo 细胞进行研究[22]。为了排除大鼠含药血清对实验结果的干扰,故设未用含药血清处理的细胞作为空白对照组。本实验研究运用Western blot 及qRT-PCR技术检测加味宫外孕Ⅱ号方对HTR-8/SVneo 细胞JNK信号通路各凋亡调控因子蛋白及mRNA 的影响。结果显示,阴性对照组和空白对照组结果各指标比较,差异无统计学意义(P >0.05),提示含药血清未对实验造成干扰,与阴性对照组比较,无论是中药各剂量组、西药组还是中西药结合组,HTR-8/SVneo 细胞中IRE1α 蛋白及mRNA 均高水平表达,说明加味宫外孕Ⅱ号方和甲氨蝶呤均能通过持续激活IRE1α 进而诱发细胞发生过度ERS。与阴性对照组比较,中药及西药组处理后的HTR-8/SVneo 细胞中IRE1α、TRAF2、ASK1、p-JNK 蛋白与IRE1α、TRAF2、ASK1、JNK1、JNK2 mRNA 的表达量均上调,说明经加味宫外孕Ⅱ号方和甲氨蝶呤干预后,HTR-8/SVneo 细胞内JNK 信号通路被激活,活化的JNK 通路可诱导细胞凋亡[23]。因此,加味宫外孕Ⅱ号方治疗EP 的机制可能与加味宫外孕Ⅱ号方能激活ERS JNK 信号通路,进而促进细胞凋亡有关。中药及西药组处理后的HTR-8/SVneo细胞中JNK1、JNK2 蛋白表达与阴性对照组比较,差异无统计学意义(P >0.05),但基因表达增加,考虑可能是因为JNK1、JNK2 剪切激活时受到了抑制[24]。另外中药低、中、高剂量组IRE1α、p-JNK 蛋白和IRE1α、JNK1 mRNA 表达量逐渐增加,且P <0.05,提示中药各剂量组可能呈剂量相关性,剂量越高,促凋亡作用越强,此结果与郑文兰等[25]研究结果一致,对指导临床用药剂量的选择具有参考价值。
此外,从本研究结果看,单纯西药组在上调IRE1、TRAF2、p-JNK 蛋白表达上优于单纯中药组和中西药结合组,且P <0.05,提示JNK 信号通路中甲氨蝶呤发挥促凋亡的作用最强。而本课题组前期研究中,加味宫外孕Ⅱ号方在Caspase-12 通路中促细胞凋亡作用最好[6]。此差异性说明加味宫外孕Ⅱ号方诱导细胞凋亡可能存在不同的分子机制,还可能受到其他凋亡通路的调控,故JNK 通路并不是加味宫外孕Ⅱ号方诱导细胞凋亡的唯一通路。
综上所述,本研究显示加味宫外孕Ⅱ号方含药血清可以促进HTR-8/SVneo 细胞凋亡,JNK 信号通路的激活可能是其中的机制之一。

