补虚解毒化瘀方对单侧输尿管梗阻大鼠健侧肾脏肾小球细胞增殖的抑制作用
张雨轩,马雪莲,杨汉继,赵绮悦,高晓萌,许庆友∗
(1.河北中医学院研究生学院,河北石家庄 050091;2.河北省中西医结合肝肾病证研究重点实验室,河北石家庄 050091)
我国慢性肾脏病的发病率不断上升[1],由梗阻性肾病导致的肾功能衰竭发病率也有明显升高的趋势。单侧肾梗阻引起慢性肾衰竭的机制尚不明确,前期研究发现,单侧输尿管梗阻可诱导健侧肾脏细胞增殖,并随着时间的延长发生肾脏纤维化[2]。
近几年来,中药复方、单味药及提取物在治疗肾小球硬化、延缓肾功能衰竭方面取得了许多新进展[3-5],但对单侧肾脏损伤诱导慢性肾衰竭的干预机制尚不明确。因此,本实验观察补虚解毒化瘀方延缓梗阻性肾病健侧肾小球硬化的作用机制,以期为相关临床治疗提供科学依据。
1 材料
1.1 动物 清洁级Sprague-Dawley 雄性大鼠40 只,4 周龄,体质量(200±10)g,购于河北医科大学动物实验中心,动物生产许可证号SCXK(冀)2013-1-003。随机分为假手术组、模型组、依普利酮组、中药组,每组10 只,适应性喂养1 周后进行实验。
1.2 药物 补虚解毒化瘀方组方药材为生黄芪20 g,地龙、醋鳖甲、赤芍、黄芩、金银花各10 g,均通过广东一方制药公司制成免煎颗粒。依普利酮购于美国辉瑞制药公司。饲料经美国Research Diets 公司加工,由东京大学Tatsuo Shimosawa 教授惠赠。
1.3 试剂 诱导因子1α(HIF-1α)抗体(批号GR194781-9)、GAPDH 抗体(批号10494-1-AP)(英国Abcam 公司);增殖细胞核抗原(PCNA)抗体(单克隆抗体,美国Proteintech 公司,批号10205-2-AP);转化生长因子(TGF-β1)抗体(批号G58021)、β-Actin 抗体(批号XS20170612031)(美国Bioworld Technology 公司);免疫组化试剂盒(北京中衫金桥有限公司,批号K186621D);脱脂奶粉(美国BD 公司,批号8064872)。
1.4 仪器 电泳仪及电泳槽(北京六一公司);Semi-Day 半干转膜仪(美国 Bio-Rad 公司);DP72-CCD、BX53 病理图文拍照系统(日本Olympus 公司);RM 2245 石蜡切片机(德国Leica上海分公司);1-15K 高速冷冻离心机(美国Sigma公司);近红外成像扫描仪(美国 LI-COR Biosciences 公司)。
2 方法
2.1 造模 除假手术组外,其余各组大鼠结扎单侧输尿管,水合氯醛麻醉后于左侧中腹部切开,游离左侧输尿管,分别在肾盂处、输尿管上1/3 处用丝线结扎,在结扎线之间切断输尿管,逐层缝合腹壁皮肤[6];假手术组仅游离左侧输尿管但不结扎离断,轻轻拨动肠管后缝合皮肤。术后1 d,依普利酮组给予含药混合饲料喂养(100 mg/kg)[7];中药组参照《实验动物学》[8]给予免煎颗粒,按1.92 g/kg(相当于11.7 g/kg 生药量)剂量加到3 mL蒸馏水中,每天灌胃1 次。
2.2 标本收集 药物干预10 d 后处死大鼠,留取健侧肾脏,一部分肾组织用4%多聚甲醛固定后制备常规石蜡切片,用于免疫组织化学染色;其余组织于-70 ℃下保存,用于分子生物学检测。
2.3 指标检测
2.3.1 肾组织损伤 大鼠肾组织进行HE 染色后,在普通光镜下观察。为了确定肾小球的损伤程度,参照Purkerson 等[9]对肾小球病变组织学的分级标准分为(1)0 级,无任何病变;(2)Ⅰ级,系膜基质增多,伴轻度系膜细胞增生;(3)Ⅱ级,系膜区扩大明显,伴血管袢阶段硬化和塌陷;(4)Ⅲ级,血管节段硬化,伴血管袢明显塌陷;(5)Ⅳ级,肾小球硬化,伴透明病变,每张切片观察20 个肾小球,归于上述5 个等级,计算各等级肾小球所占比例,计算病理积分,进行半定量分析。
2.3.2 胶原纤维 大鼠肾组织进行Sirius red 染色后,在普通光镜下观察,以红色胶原沉积为阳性信号。通过Image Proplus 多媒体彩色病理图像分析软件进行分析,计算肾小球胶原沉积面积与肾小球总面积的比值,取平均值。
2.3.3 HIF-1α、PCNA 相对表达 采用免疫组织化学法。HIF-1α 免疫染色评分为阳性细胞范围与染色强度之和,阳性细胞范围≤25% 为0 分,26%~50%为1 分,51%~75%为2 分,76%~100%为3 分;染色强度0 分为阴性着色,1 分为淡黄色,2 分为浅褐色,3 分为深褐色,每张切片观察20 个肾小球并分别计分,PCNA 检测肾小球阳性细胞占肾小球细胞总数的比例,进行半定量分析。
2.3.4 HIF-1α、TGF-β1、PCNA 蛋白表达 采用免疫蛋白印迹法。提取大鼠肾皮质蛋白,BCA 测定浓度后在95 ℃下变性,取30~60 μg 进行SDSPAGE 凝胶电泳后转至PVDF 膜上,BSA 封闭1 h,加入一抗(1∶200~1∶1 000),4 ℃下孵育过夜,TBST 清洗3 次,每次8 min,加入二抗,室温下孵育1 h,TBST 清洗3 次,每次8 min,TBS 清洗5 min,红外激光成像系统扫描,所得结果以内参校正。
2.4 统计学分析 通过SPSS 21.0 软件进行处理,计量资料以()表示,多组间比较先采用方差分析,再采用Tukey 检验(均为双侧检验)。P<0.05 表示差异具有统计学意义。
3 结果
3.1 大鼠肾组织病理变化 HE 染色显示,假手术组大鼠肾小球结构无异常,血管袢开放良好;模型组大鼠肾小球体积增大,系膜细胞增殖明显(P<0.05);依普利酮、中药组大鼠细胞增殖较模型组减轻(P<0.05)。Sirius red 染色显示,模型组胶原沉积多于假手术组(P<0.05),依普利酮、中药组胶原沉积更少(P<0.05)。见图1、表1。
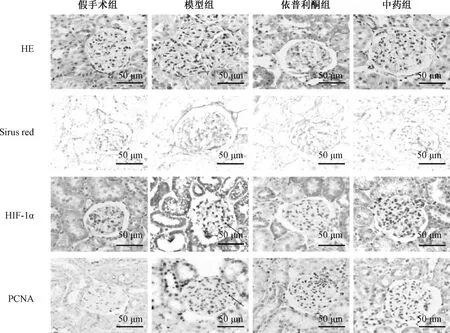
图1 各组大鼠健侧肾脏病理变化及HIF-1α、PCNA 相对表达(×400)Fig.1 Renal pathological changes and HIF-1α,PCNA relative expressions in contralateral kidneys of rats in various groups(×400)
表1 各组大鼠健侧肾脏胶原沉积(, n=6)Tab.1 Collagen deposition of contralateral kidneys of rats in various groups(, n=6)

表1 各组大鼠健侧肾脏胶原沉积(, n=6)Tab.1 Collagen deposition of contralateral kidneys of rats in various groups(, n=6)
注:与假手术组比较,∗P<0. 05;与模型组比较,#P<0.05。
3.2 大鼠肾组织HIF-1α、PCNA 相对表达 假手术组大鼠HIF-1α 仅在肾小管呈弱表达,主要见于细胞浆内;模型组大鼠HIF-1α 相对表达增强(P<0.05),可见于肾小管及肾小球,小球内大量细胞核着色,呈棕色黄染颗粒;中药组、依普利酮组大鼠肾小管内少量着色,主要表达在细胞浆内,HIF-1α 相对表达低于模型组(P<0.05)。见图1、表2。
假手术组大鼠PCNA 阳性细胞较少,可见于肾小管及肾小球;模型组大鼠肾小球阳性细胞增多(P<0.05);中药组、依普利酮组大鼠PCNA 阳性细胞少于模型组(P<0.05)。见图1、表3。
表2 各组大鼠健侧肾脏HIF-1α 相对表达(, n=6)Tab.2 Relative expressions of HIF-1α in contralateral kidneys of rats in various groups(, n=6)

表2 各组大鼠健侧肾脏HIF-1α 相对表达(, n=6)Tab.2 Relative expressions of HIF-1α in contralateral kidneys of rats in various groups(, n=6)
注:与假手术组比较,∗P<0. 05;与模型组比较,#P<0.05。
表3 各组大鼠健侧肾脏PCNA 相对表达(, n=6)Tab.3 Relative expressions of PCNA in contralateral kidneys of rats in various groups(, n=6)

表3 各组大鼠健侧肾脏PCNA 相对表达(, n=6)Tab.3 Relative expressions of PCNA in contralateral kidneys of rats in various groups(, n=6)
注:与假手术组比较,∗P<0. 05;与模型组比较,#P<0.05。
3.3 大鼠肾组织HIF-1α、TGF-β1、PCNA 蛋白表达 模型组HIF-1α、TGF-β1、PCNA 蛋白表达高于假手术组(P<0.05),中药组、依普利酮组三者蛋白表达低于模型组(P<0.05)。见图2、表4。
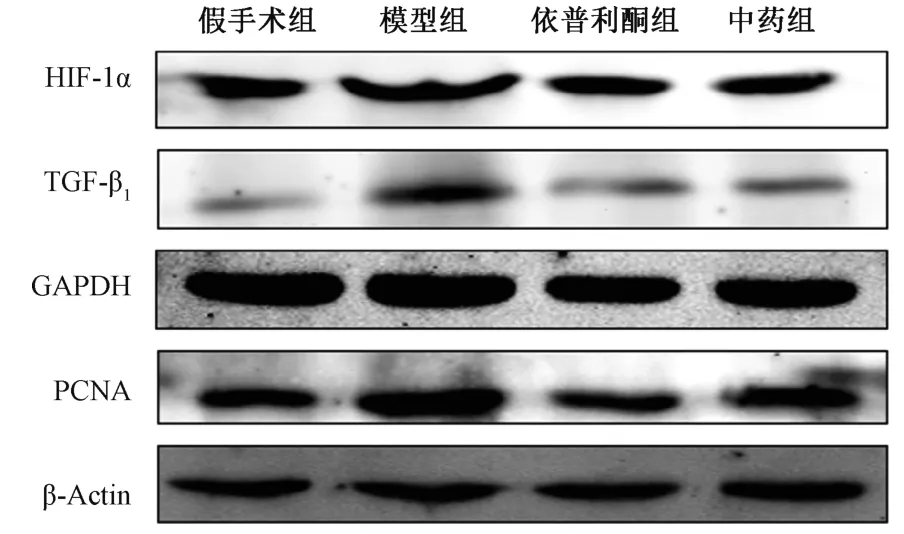
图2 各组大鼠健侧肾脏HIF-1α、TGF-β1、PCNA 蛋白表达Fig.2 Protein expressions of HIF-1α,TGF-β1and PCNA in contralateral kidneys of rats
表4 各组大鼠健侧肾脏HIF-1α、TGF-β1、PCNA 蛋白表达(, n=3)Tab.4 Protein expressions of HIF-1α,TGF-β1and PCNA in contralateral kidneys of rats(, n=3)
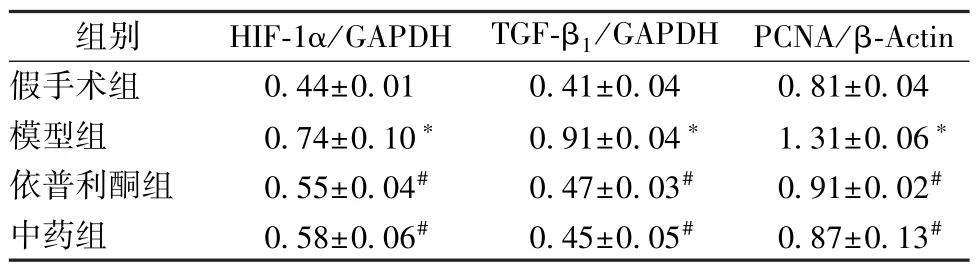
表4 各组大鼠健侧肾脏HIF-1α、TGF-β1、PCNA 蛋白表达(, n=3)Tab.4 Protein expressions of HIF-1α,TGF-β1and PCNA in contralateral kidneys of rats(, n=3)
注:与假手术组比较,∗P<0. 05;与模型组比较,#P<0.05。
4 讨论
大多数梗阻性肾病如能及时发现并解除梗阻、引流肾脏尿液,则可部分或完全恢复,但部分患者肾功能仍然无法恢复,甚至继续恶化,进展为慢性肾衰竭,故健侧肾脏受损可能是发生该疾病的重要原因。受损的肾脏可以表现为肾间质纤维化、肾小球硬化,梗阻性肾病以间质纤维化关注主多,而对肾小球尤其是健侧(对侧)肾脏关注不够,肾间质纤维化的改变与小管上皮细胞、间质细胞、浸润而来的多种炎性细胞相关,肾小球硬化的主要病理特征为系膜细胞增殖和细胞外基质的过度积聚[10]。
大量研究表明,肾小球系膜细胞是导致Ⅰ型胶原等系膜基质成分不断增加的主要效应细胞,肾小球固有细胞增殖及细胞外基质(ECM)异常积聚是导致肾小球硬化的重要因素,故有效地抑制肾小球细胞增殖对延缓肾小球硬化有重要意义。细胞增殖与增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)密切相关,后者是一种仅出现在增殖状态细胞核内的酸性蛋白质,故其表达增强表明细胞正处于增生状态。研究发现,转化生长因子β1(TGF-β1)与肾小球硬化发生发展密切相关,它是一个多功能细胞因子,可促进细胞增殖、调节ECM 积聚[10],被公认为是肾小球硬化的治疗靶标[11]。在过去,肾脏缺氧被认为是纤维化过程的结果而不是诱因,但最近研究表明缺氧可能是肾脏疾病进展的早期潜在的起始事件[12-14],炎症反应、活性氧(ROS)均可调节缺氧诱导因子-1α(HIF-1α)表达,细胞在增殖过程中消耗大量氧气也可激活[15],它是细胞适应缺氧的关键转录调节因子,由ɑ、β 亚基组成,可刺激缺氧基因产物的表达,促进肾纤维化和慢性肾病进展[16],慢性缺氧可通过抑制其降解来增加蛋白累积,从而使其高表达,并可上调TGF-β1来促进细胞增殖。因此,慢性缺氧可能是引起肾小球硬化的重要原因。
慢性肾脏病根据其临床表现和发病特点,归属于中医的“水肿”“关格”“癃闭”等范畴。目前普遍认为,肾小球硬化是虚实夹杂、本虚标实之证,本虚表现为脾肾亏虚,标实表现为瘀血、水肿、浊毒等,正气亏虚是肾小球硬化的根本原因,瘀血是加重肾小球硬化的重要因素。遵循中医“既病防变”理论,在慢性肾脏病的治疗过程中不仅要关注已经发生的疾病,对于尚未发生或已经发生但未深入的病变更要重视。对于梗阻性肾病而言,不仅要研究梗阻侧肾脏病变,还要考察对侧肾脏的病理生理变化。
现代研究表明,中药对防治肾小球硬化有独特疗效。例如,黄芪含药血清可抑制大鼠系膜细胞增殖[17],其总皂苷能抑制高糖诱导下系膜细胞的过度增殖[18];芪归益肾方可通过调节凝血酶调节蛋白来有效延缓单侧输尿管梗阻小鼠肾脏纤维化[19];丹参注射液可下调TGF-β1表达,提高活性氧水平,延缓肾小球硬化[20];地龙能通过抗氧化等途径抑制肾小球系膜细胞增殖,降解细胞外基质,防止肾小球硬化发生[21]。
本实验通过HE 染色来观察大鼠肾组织形态变化,Sirius red 染色来观察肾组织胶原沉积,免疫印迹法来检测HIF-1α、TGF-β1、PCNA 蛋白表达,考察补虚解毒化瘀方对单侧输尿管梗阻健侧肾脏的干预作用。结果表明,给药10 d 后模型组大鼠肾小球胶原沉积较假手术组明显增多;与模型组比较,补虚解毒化瘀方组可减少大鼠肾小球胶原沉积,延缓其硬化进程,HIF-1α、TGF-β1蛋白表达明显降低,提示该方延缓肾小球硬化的作用机制可能是通过改善缺氧、抑制HIF-1α 表达、下调TGFβ1蛋白表达、抑制细胞过度增殖所致。方中黄芪功效补气行血、扶正祛邪,赤芍功效活血利水,地龙、醋鳖甲功效化瘀通络,黄芩、金银花功效清热解毒,诸药相伍,共奏益气活血化瘀通络、标本兼顾的作用。
综上所述,本实验从分子蛋白水平证实补虚解毒化瘀方是抑制单侧输尿管梗阻诱导健侧肾小球硬化的有效中药制剂,可为相关临床研究提供依据,也为该方有效成分的进一步开发应用提供参考。

