MiR⁃873⁃5p靶向HNRNPK调控糖尿病肾病足细胞的增殖和凋亡
熊轩,刘昌淳,黎建文,邱越,周彩燕,郑韬,严跃红,梁剑波
(1.广州医科大学附属顺德医院肾脏内科,广东佛山528315;2.广州医科大学附属顺德医院内分泌科,广东佛山528315;3.广州医科大学附属第五医院肾脏内科,广东广州510799;4.广州医科大学附属第二医院肾脏内科,广东广州510260)
糖尿病肾病(diabetic nephropathy,DN)一直是慢性肾病和肾功能衰竭的主要原因[1]。在过去的20年里,DN的发病率和死亡率在世界范围内迅速上升[2]。足细胞及足突之间裂孔隔膜是肾小球过滤的最后一道屏障,足细胞的增殖和凋亡对维持肾小球滤过屏障的完整性至关重要,对临床DN治疗具有重要意义[3]。微小RNA(microRNA,miRNA)是一类长度为20~25个核苷酸的内源性非编码RNA,通过特异性翻译抑制或者诱导mRNA降解,调控细胞的生长、分化、增殖和凋亡等,以及参与机体多种生理和病理过程[4⁃5]。近年来研究发现许多miRNAs在DN患者中异常表达并参与足细胞增殖、凋亡、损伤等DN的病理过程[6⁃7]。已有研究报道mi R⁃873⁃5p在胃癌[8]、肺癌[9]、结直肠癌[10]等癌细胞的增殖和凋亡过程中发挥重要的调控作用,但关于它在DN中的作用机制仍未完全明确。核内不均一核糖核蛋白K(HNRNPK)定位于人第9染色体,是一种高度保守、广谱表达的DNA/RNA结合蛋白,在肿瘤的增殖、凋亡、转移等生物学过程中发挥重要的调控作用[11]。但HNRNPK在DN中的调控机制尚未十分清楚。本研究通过分析miR⁃873⁃5p和HNRNPK在高糖诱导的足细胞中表达,探讨miR⁃873⁃5p是否通过靶向HNRNPK以影响高糖诱导的足细胞的增殖和凋亡。
1 材料与方法
1.1 主要材料与仪器
MPC5小鼠足细胞购于上海中国科学院细胞库;RPMI⁃1640培养基、胎牛血清购于美国Gibco公司;葡萄糖购于美国Sigma公司;PCR引物、mi RNA提取试剂盒、反转录试剂盒以及荧光定量试剂盒购于日本Takara公司;miR⁃873⁃5p模拟物(mi R⁃873⁃5 mimic)、miR⁃873⁃5p抑制物(miR⁃873⁃5p inhibitor)和对照物(NC inhibitor)序列以及靶向HNRNPK的siR⁃NA序列(si⁃HNRNPK)和对照序列(si⁃NC)均购于上海吉码公司;Lipofectamine 2000转染试剂盒购于美国Invitrogen公司;CCK8细胞增殖检测试剂盒、RI⁃PA裂解液、SDS⁃PAGE胶配制试剂盒均购于上海碧云天公司;Annexin⁃VFITC/PI细胞凋亡检测试剂盒购于南京凯基公司;双荧光素酶报告基因检测试剂盒购于美国Promega公司;iMark型酶标仪购于美国BIO⁃RAD公司;ABI 7500实时荧光定量聚合酶链反应仪购于美国Applied Biosystems公司;流式细胞仪购于美国BD公司。
1.2 细胞培养
MPC5细胞采用添加有10%(φ)胎牛血清的RP⁃MI⁃1640培养基培养,以1×105个/mL细胞浓度将细胞接种至12孔板中,随后置于37℃、5%(φ)CO2培养箱中进行培养。收集指数生长期的细胞用于后续实验。为了模拟糖尿病高糖损伤,在上述培养基中再添入终浓度为30 mol/L的葡萄糖建立高糖损伤细胞模型。高糖诱导培养24 h后qRT⁃PCR检测正常培 养(Cells)和 高 糖 培 养(H⁃Cells)细 胞 中miR⁃873⁃5p相对表达水平。
1.3 细胞转染与分组
将细胞分为正常组(Cells)、高糖组(H⁃Cells)、高糖转染对照组(H⁃NC inhibitor)、高糖miR⁃873⁃5p抑 制 剂 组(H⁃mi R⁃873⁃5p inhibitor)、H⁃miR⁃873⁃5p inhibitor+si⁃NC组、H⁃miR⁃873⁃5p inhibitor+si⁃HNRN⁃PK组。细胞转染按照Lipofectamine 2000转染试剂盒说明书操作步骤进行,经葡萄糖诱导后的MPC5细胞,转染24 h后qRT⁃PCR检测转染效果。
1.4 qRT⁃PCR检 测miR⁃873⁃5p和HNRNPK相 对表达
收集细胞,采用用Trizol试剂提取细胞总RNA,随后按逆转录试剂盒说明书进行操作。将总RNA逆转录合成cDNA,并以此cDNA为模板,按照荧光PCR试剂盒说明书配置反应体系并在ABI 7500实时荧光定量PCR仪中分别检测miR⁃873⁃5p和HNRNPK表达水平。miR⁃873⁃5p相对表达水平以U6作为内参,HNRNPK相对表达水平以GAPDH作为内参。运用2-ΔΔCt方法计算miR⁃873⁃5p和HNRN⁃PK的相对表达水平。
1.5 细胞增殖检测
采用CCK8细胞增殖检测试剂盒对各组细胞的增殖进行检测。将各组细胞接种至96孔板中,每组设置3个重复,置于37℃、5%CO2条件下培养0 h、24 h、48 h、72 h,各组细胞经各时间点培养后,每孔加入10μL CCK8试剂,轻轻混匀,黑暗条件下37℃培养箱中孵育2 h。在450 nm波长下分别检测各组细胞的吸光度(A)值,绘制细胞增殖曲线。
1.6 流式检测细胞凋亡
将各组细胞进行接种,培养箱中孵育48 h后,按照Annexin⁃VFITC/PI细胞凋亡检测试剂盒对各组细胞进行处理,流式细胞仪分析各组细胞中凋亡细胞所占比例。
1.7 双荧光素酶报告基因实验
荧光素酶报告载体(psiCHECK2⁃HNRNPK⁃WT、psiCHECK2⁃HNRNPK⁃MUT)分别与miR⁃873⁃5 mim⁃ics、miR⁃873⁃5p inhibitor共转染小鼠足细胞。转染8 h后,更换新鲜培养液继续培养。转染48 h后,按照双荧光素酶报告基因检测试剂盒说明书步骤操作,以海参荧光素酶的发光强度与萤火虫荧光素酶发光强度的比值反映miR⁃873⁃5p与HNRNPK的结合力。
1.8 Western blot实验
收集各组细胞,加入预冷的RIPA裂解液裂解细胞,提取细胞总蛋白。各组取定量(20μg)变性的蛋白样品进行SDS⁃PAGE电泳,然后将蛋白经电转至PVDF膜上,室温条件下3%的胎牛血清封闭膜1 h。分别加入一抗:anti⁃HNRNPK抗体(1∶1 000)和anti⁃GAPDH抗体(1∶2 000),4℃条件孵育过夜,经TBST洗膜3次;室温条件下经辣根过氧化物酶标记的二抗(1∶3 000)孵育2 h,再TBST洗膜3次,采用增强的化学发光系统(ECL)显色测定各组蛋白条带的光密度,以GAPDH条带作为蛋白相对表达内参。
1.9 统计学方法
采用SPSS 22.0软件对所有实验数据进行统计分析,数据资料以(±s)表示。多组间比较采用单因素方差分析,两组之间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 高糖诱导足细胞中miR⁃873⁃5p表达
QRT⁃PCR结果表明,与对照组(1.00±0.05)相比,高糖组细胞中miR⁃873⁃5p相对表达水平(7.39±0.29)显著升高,差异有统计学意义(P<0.05)。
2.2 干扰miR⁃873⁃5p表达促进高糖培养的足细胞增殖
qRT⁃PCR结果显示,在高糖培养的足细胞中,转染miR⁃873⁃5p inhibitor组细胞中miR⁃873⁃5p相对表达水平显著低于转染NC inhibitor的对照组(P<0.05),见图1A。细胞增殖实验结果显示,在培养24 h、48 h和72 h这3个时间点时,高糖组细胞的增殖能力均显著低于正常培养的细胞组(P<0.05)。而培养24 h、48 h和72 h这3个时间点时,转染miR⁃873⁃5p inhibi⁃tor的高糖培养的细胞组的增殖能力均显著高于转染NC inhibitor的高糖培养的细胞组(P<0.05),见图1B。
2.3 干扰miR⁃873⁃5p表达抑制高糖诱导的足细胞凋亡
细胞凋亡实验结果显示,高糖组细胞的凋亡比例显著大于正常培养的细胞组(P<0.05);而转染miR⁃873⁃5p inhibitor的高糖培养的细胞的凋亡比例显著低于转染NC inhibitor的高糖培养的细胞组(P<0.05),见图2。
2.4 miR⁃873⁃5p对HNRNPK表达的靶向调控作用
运用miRcode数据库对miR⁃873⁃5p的靶基因进行预测,发现miR⁃873⁃5p与HNRNPK 3’UTR存在结合位点,HNRNPK可能是miR⁃873⁃5p的靶基因,见图3A。双荧光素酶报告实验结果显示:与Blank组相比,mi R⁃873⁃5p mimics与WT⁃HNRNPK细胞中荧光活性显著降低(P<0.05),而miR⁃873⁃5p inhibitor与WT⁃HNRNPK细胞中荧光活性显著上调(P<0.05);与Blank组相比,miR⁃873⁃5p mimics与MUT⁃HNRNPK细胞和miR⁃873⁃5p inhibitor与WT⁃HNRNPK细胞中荧光活性无明显差异(P>0.05)。见图3B。qRT⁃PCR结果表明,与对照组相比,高糖组细胞中HNRNPK相对表达水平显著下调(P<0.05);而转染miR⁃873⁃5p inhibitor的高糖培养的细胞中的HNRNPK相对表达水平显著高于转染NC inhibitor的高糖培养的细胞(P<0.05)。见图3C。
2.5 在高糖诱导的足细胞中干扰miR⁃873⁃5p的同时敲低HNRNPK的表达
设计3条靶向敲低HNRNPK表达的siRNA序列(si⁃RNA1、si⁃RNA2、si⁃RNA3),分别转染足细胞,以转染si⁃NC序列作为对照。qRT⁃PCR和Western blot结果均显示,与转染si⁃NC序列相比,转染靶向敲低HNRNPK表达的si RNA序列(si⁃RNA1、si⁃RNA2和si⁃RNA3)均能敲低HNRNPK mRNA和蛋白的表达(P<0.05),但是si⁃RNA1效果最显著,所以在后续高糖培养的足细胞中选择转染si⁃RNA1(si⁃HNRNPK)靶向敲低HNRNPK表达。见图4A和图4B。随后在高糖诱导的足细胞中干扰mi R⁃873⁃5p的同时敲低HNRNPK的表达,qRT⁃PCR和Western blot结果均显示,与转染miR⁃873⁃5p inhibitor+si⁃NC组相比,转染miR⁃873⁃5p inhibitor+si⁃HNRNPK细胞中HNRNPK mRNA和蛋白表达水平均下调(P<0.05)。见图4C和图4D。

图1 CCK8实验检测干扰miR⁃873⁃5p表达对高糖培养的足细胞增殖的影响Figure 1 Effect of miR⁃873⁃5p interference on podocyte proliferation in high glucose culture by CCK8 assay
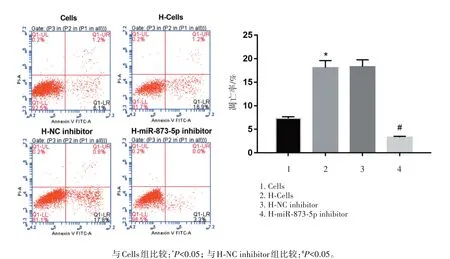
图2 细胞流式实验检测干扰miR⁃873⁃5p表达对高糖培养的足细胞凋亡的影响Figure 2 Effect of mi R⁃873⁃5p interference on podocyte apoptosis in high glucose culture by flow cytometry assay
2.6 干扰miR⁃873⁃5p表达同时干扰HNRNPK的表达对高糖诱导的足细胞增殖的影响
细胞增殖实验结果显示,在培养48 h和72 h这2个时间点时,转染miR⁃873⁃5p inhibitor+si⁃HNRN⁃PK的高糖培养的细胞的增殖能力均显著低于转染miR⁃873⁃5p inhibitor+si⁃NC的高糖培养的细胞组(P<0.05)。见图5。

图3 miR⁃873⁃5p对HNRNPK表达的靶向调控作用Figure 3 Effect of miR⁃873⁃5p on the expression of HNRNPK

图4 在高糖培养的足细胞中干扰mi R⁃873⁃5p的同时干扰HNRNPK的表达Figure 4 Interference of miR⁃873⁃5p and HNRNPK expression in podocytes cultured with high glucose

图5 干扰miR⁃873⁃5p表达同时干扰HNRNPK的表达对高糖培养的足细胞增殖的影响Figure 5 Effect of miR⁃873⁃5p and HNRNPK interference on podocyte proliferation in high glucose culture
2.7 干扰miR⁃873⁃5p表达同时干扰HNRNPK的表达对高糖诱导的足细胞凋亡的影响
细胞凋亡实验结果显示,转染miR⁃873⁃5p inhi⁃bitor+si⁃HNRNPK的高糖培养的细胞的凋亡比例显著高于转染miR⁃873⁃5p inhibitor+si⁃NC的高糖培养的细胞组(P<0.05)。见图6。
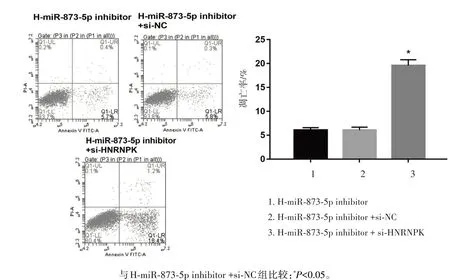
图6 干扰miR⁃873⁃5p表达同时干扰HNRNPK的表达对高糖培养的足细胞凋亡的影响Figure 6 Effect of mi R⁃873⁃5p and HNRNPK interference on podocyte apoptosis in high glucose culture
3 讨论
虽然近些年关于DN发病机制的研究取得了一定的进展,但其高发率和不良预后并没有得到很大改善,寻找新的治疗DN靶点具有重要意义[12]。足细胞肥大、足细胞脱离和足细胞凋亡可能导致DN患者尿蛋白的增加[13]。因此,足细胞增殖和凋亡在DN发病中占有重要地位。近年来越来越多的研究表明异常表达的miRNAs在糖尿病及其并发症等疾病的病理生理学中发挥重要作用[14]。比如,在高糖处理的足细胞中,miR⁃770⁃5p的表达水平上调,干扰miR⁃770⁃5p表达通过靶向TRIAP 1抑制高糖诱导的足细胞凋亡[15]。MiR⁃15b⁃5p通过抑制细胞凋亡、氧化应激和靶向SEMA3A的炎症反应,改善高糖诱导的足细胞损伤[16]。miR⁃873⁃5p作为miRNAs家族的一员,已被证明在人类肿瘤中发挥重要作用。Wang等[10]研究发现miR⁃873⁃5p通过NF⁃κB通路直接靶向JMJD8抑制细胞增殖和上皮间充质转化。Wang等[17]报道miR⁃873⁃5p通过抑制IGF2BP 1的表达,抑制胶质母细胞瘤的发生和转移。然而,关于miR⁃873⁃5p在DN中的功能尚不清楚。本研究发现,与正常细胞相比,miR⁃873⁃5p在高糖处理足细胞中表达上调,提示miR⁃873⁃5p可能参与调控足细胞的增殖和凋亡;随后研究发现干扰miR⁃873⁃5p的表达可促进高糖处理的足细胞的增殖,提示干扰miR⁃873⁃5p表达对高糖处理的足细胞增殖有一定的促进作用。表明以长期高血糖为表型的糖尿病引起的肾病可能通过诱导miR⁃873⁃5p高表达抑制足细胞的增殖有关。肾足细胞凋亡是慢性肾病、小儿肾病综合征及局灶节段性肾小球硬化等多种肾脏疾病的重要发病机制[18]。本研究发现干扰miR⁃873⁃5p的表达能够抑制高糖处理的足细胞的凋亡,表明糖尿病引起的肾病还可能通过诱导miR⁃873⁃5p高表达促进足细胞发生凋亡有关。
为了探讨miR⁃873⁃5p在DN进展中的作用机制,本研究通过在线工具预测miR⁃873⁃5P与HNRNPK有理论结合位点。结果表明,异常表达的HNRNPK与肿瘤的发生、发展和预后有关[19]。HNRNPK表达下调能够明显减少转移性肺肿瘤结节的形成[20]。此外,HNRNPK在细胞内稳态中也起着重要作用。HNRNPK作为p53的辅助激活因子,对DNA损伤修复起调节作用,下调HNRNPK可降低p53的转录,导致DNA损伤所致的细胞周期阻滞[21]。Su等[22]发现HNRNPK在糖尿病肾病大鼠中低表达,而Hordenine治疗能够促进HNRNPK的表达。随后的荧光素酶分析表明,HNRNPK是miR⁃873⁃5P的靶点。同Su等结果一致,本研究发现HNRNPK在高糖培养的足细胞中低表达,而干扰miR⁃873⁃5p表达时高糖培养的足细胞中HNRNPK表达显著上调。表明在高糖培养的足细胞中miR⁃873⁃5p的表达与HNRNPK表达呈负相关。mi R⁃873⁃5P通过与HNRNPK mRNA 3’UTR结合,下调HNRNPK的表达。随后对HNRN⁃PK在高糖培养的足细胞中功能研究发现,干扰miR⁃873⁃5p表达的同时敲低HNRNPK表达,可以逆转干扰mi R⁃873⁃5p表达对高糖培养的足细胞增殖促进和凋亡抑制的作用。表明miR⁃873⁃5p通过靶向HNRNPK调控高糖培养的足细胞增殖和凋亡。
综上所述,miR⁃873⁃5p在高糖培养的足细胞中高表达,干扰miR⁃873⁃5p表达通过靶向下调HNRN⁃PK表达,促进高糖培养的足细胞增殖和抑制凋亡。miR⁃873⁃5p和HNRNPK可能成为DN临床治疗的潜在靶点。

