菟丝子盐炙前后HPLC指纹图谱的变化研究
何广铭,曹斯琼,周湘媛,李国卫,潘礼业,陈向东,魏梅,孙冬梅
(广东一方制药有限公司/广东省中药配方颗粒企业重点实验室,广东佛山528244)
菟丝子为旋花科植物南方菟丝子Cuscuta aus⁃tr al isR.Br.或菟丝子Cuscuta chinens i sLam.的干燥成熟种子,秋季果实成熟时采收植株,晒干,打下种子,除去杂质。菟丝子味辛、甘、平,归肝、肾、脾经,有补益肝肾、固精缩尿、安胎、明目、止泻之功效[1],为中医补肾、壮阳、固精之要药[2]。现代药理研究表明,菟丝子具有保肝、抗氧化、降血糖以及调节生殖系统、内分泌系统和提高免疫力等作用[3⁃8],主要包括黄酮类、有机酸、甾醇类、多糖、微量元素和氨基酸等成分,其中黄酮类成分是补肾壮阳的主要成分[9]。菟丝子临床上多用炮制品,2020年版《中国药典》收载的菟丝子炮制品为盐菟丝子,菟丝子经盐炙后能够增强补益肝肾之功效[10]。目前的研究主要集中在从菟丝子黄酮类成分的溶出能力阐明菟丝子盐炙的机理,认为菟丝子盐炙后较生品的金丝桃苷、槲皮素、山柰酚等黄酮成分溶出增加明显[11⁃13]。本研究通过建立HPLC指纹图谱,并结合化学计量学手段,从整体上揭示菟丝子盐炙前后化学成分的差异,为菟丝子和盐菟丝子的质量控制提供参考依据。
1 仪器与试药
1.1 仪器
Agilent1260 infinity高效液相色谱系统(包括Agilent⁃G1311C四元泵,Agilent⁃G1329B自动进样器,Agilent⁃G1314F可变波长检测器,安捷伦公司);AT⁃330外带柱温箱(天津奥特赛思仪器有限公司);CHEMSTATION C.01.04化学工作站;Waters e2695高效液相色谱仪(沃特世公司);Waters Xsclect HSS T3 C18(4.6 mm×250 mm,5μm)色谱柱,Thermo Acclaim C18(4.6 mm×250 mm,5μm)色谱柱,Phe⁃nonmenex Luna C18(4.6 mm×250 mm,5μm)色谱柱;ME204E万分之一天平、XP26百万分之一天平(梅特勒⁃托利多公司);KQ⁃500DE数控超声清洗器(昆山市超声仪器有限公司);HWS28电热恒温水浴锅(上海一恒科技有限公司);Milli⁃Q Direct超纯水系统(默克股份有限公司)。
1.2 试药
绿 原 酸(批 号:110753⁃201415,质 量 分 数96.2%)、金丝桃苷(批号:111521⁃201205,质量分数93.3%)、异槲皮苷(批号:111809⁃201102,质量分数100%)对照品均由中国食品药品检定研究院提供;15批菟丝子药材经广东一方制药有限公司魏梅主任药师鉴定均为旋花科植物南方菟丝子Cuscuta austr al isR.Br.的干燥成熟种子。本品为秋季果实成熟时采收植株,晒干,打下种子,除去杂质,详细信息见表1。

表1 菟丝子和盐菟丝子来源信息Table 1 Information of the Cuscutae Semen and Salt Cuscutae Semen
2 方法与结果
2.1 盐菟丝子的炮制
取15批经过净选的菟丝子药材,参照《中国药典》2020版四部通则0213的盐炙法,炒至微鼓起,即得盐菟丝子炮制品。
2.2 溶液的制备
2.2.1 对照品溶液 精密称定绿原酸、金丝桃苷、异槲皮苷对照品适量,加甲醇制成每1 mL分别含40.792、48.022、45.160μg的混合对照品溶液。
2.2.2 供试品溶液 取菟丝子和盐菟丝子粉末(过四号筛)1 g,精密称定,置具塞锥形瓶中,精密加入70%(体积分数,下同)甲醇50 mL,称定质量,水浴回流30 min,放冷,再称定质量,用70%甲醇补足减失质量,摇匀,滤过,取续滤液,即得。
2.3 色谱条件
色谱柱为Waters Xselect HSS T3柱(4.6 mm×250 mm,5μm);以乙腈为流动相A,0.1%磷酸溶液为流动相B,梯度洗脱(0~30 min,7%~12%A;30~35 min,12%~15%A;35~55 min,15%A;55~80 min,15%~30%A;80~85 min,30%~93%A);流 速 为1.0 mL/min;柱温为30℃;进样量为10μL;检测波长为360 nm。
2.4 方法学考察
2.4.1 精密度试验 取按“2.2”项方法制备的菟丝子供试品溶液,按“2.3”项色谱条件进样测定,连续重复测定6次,以金丝桃苷为参照峰,计算各共有峰的相对保留时间RSD为0.02%~0.16%,相对峰面积RSD为0.11%~0.84%,均小于1.0%(n=6),表明仪器的精密度良好。
2.4.2 稳定性试验 取按“2.2”项方法制备的菟丝子供试品溶液,按“2.3”项色谱条件分别在室温放置0、2、4、8、12、24 h进样测定,计算各共有峰的相对保留时间RSD为0.04%~0.14%,相对峰面积RSD为0.04%~0.65%,均小于1.0%(n=6),表明供试品溶液在24 h内保持稳定。
2.4.3 重复性试验 取同一批菟丝子粉末,按“2.2”项方法平行制备供试品溶液6份,同法进样测定,计算各共有峰的相对保留时间RSD为0.04%~0.08%,相对峰面积RSD为0.07%~2.27%,均小于3.0%(n=6),表明方法重复性良好。
2.4.4 中间精密度 由另一名实验人员在不同的日期,取同一批菟丝子粉末,按“2.2”项方法平行制备供试品6份,使用不同的仪器同法进样测定,计算各共有峰的相对保留时间RSD为0.05%~0.27%,相对峰面积RSD为0.25%~2.39%,均小于3.0%(n=12),表明方法中间精密度良好。
2.5 指纹图谱的建立
2.5.1 共有峰的确定 按“2.2”项方法分别制备15批菟丝子、15批盐菟丝子的供试品溶液,按“2.3”项色谱条件采集指纹图谱,并将指纹图谱分别导入“中药色谱指纹图谱相似度评价系统”(2012.130723版)软件进行分析,分别匹配出12个共有峰,得菟丝子药材和盐菟丝子的指纹图谱共有峰模式(见图1、图2),与对照品对比指认4号峰为绿原酸峰,9号峰为金丝桃苷峰,10号峰为异槲皮苷峰(见图3)。以峰9为参照峰,分别计算各特征峰的相对保留时间和相对峰面积,两者共有峰的相对保留时间RSD值均小于2%,而相对峰面积范围分别17.35%~127.53%和13.53%~108.58%。

图1 15批菟丝子药材HPLC指纹图谱共有峰模式Figure 1 The common peak mode of HPLC fingerprints of 15 batches of Cuscutae Semen

图2 15批盐菟丝子HPLC指纹图谱共有峰模式Figure 2 The common peak mode of HPLC fingerprints of 15 batches of Salt Cuscutae Semen

图3 菟丝子和盐菟丝子对照指纹图谱Figure 3 Reference fingerprints of Cuscutae Semen and Salt Cuscutae Semen by HPLC
2.5.2 相似度评价 采用“中药色谱指纹图谱相似度评价系统”(2012.130723版)软件分别对15批菟丝子药材和15批盐菟丝子进行相似度评价,与生成的对照指纹图谱对比,除T5外,菟丝子药材的相似度均大于0.9。盐菟丝子与对照图谱的相似度大于0.9。表明不同产地间的菟丝子药材与盐菟丝子饮片的指纹图谱具有较高相似度。结果见表2。

表2 15批菟丝子药材和15批盐菟丝子相似度评价结果Table 2 Results of similarity analysis of Cuscutae Semen and Salt Cuscutae Semen

表3 15批菟丝子和盐菟丝子的共有峰峰面积Table 3 Peak area of common peaks of 15 batches of Cuscutae Semen and Salt Cuscutae Semen
2.5.3 特征峰峰面积的差异分析 由上述结果可知,盐菟丝子与菟丝子指纹图谱均呈现12个相同的共有峰,但盐菟丝子部分色谱峰的峰面积发生明显的变化。运用IBM SPSS Statistics 21.0软件对菟丝子和盐菟丝子各共有峰峰面积(见表3)进行独立样本t检验,结果见表4。可见,峰2、峰3、峰6、峰7、峰11在炮制前后的峰面积间差异具有统计学意义(P<0.05),表明峰2、峰3、峰6、峰7、峰11的含量在炮制后发生了明显的变化。

表4 菟丝子和盐菟丝子共有峰峰面积的独立样本T检验结果Table 4 The independent sample test result of peak area of each common peak of Cuscutae Semen and Salt Cuscutae Semen
2.6 化学计量学分析
2.6.1 主成分分析(PCA)将30批样品的12个共有指纹峰峰面积导入IBM SPSS Statistics 21.0软件进行标准化处理后作为变量进行主成分分析,计算得到主成分特征值、累积贡献率,结果见表5;碎石图见图4。可见,PCA共提取3个特征值大于1的主成分,累积方差贡献率达84.558%,因此,前3个主成分可以代表菟丝子指纹图谱共有峰中大部分的化学信息,且碎石图中前4个特征值的变化曲线陡峭,表明前3个主成分可以揭示引起不同批次样品之间差异的信息[14]。成分载荷矩阵见表6,可见,第1主成分主要反映了峰9、8、4、1、10、5的信息;峰3、6、2、11、12、7在第2主成分的载荷值较高。同时将标准化后的数据作为变量导入SIMCA 14.0软件进行PCA分析,得到得分散点图见图5。可见,菟丝子和盐菟丝子分别分布在不同的区域,区别明显。且未
经过炮制的菟丝子生品离散程度大,盐菟丝子样品更为集中,表明经过炮制后菟丝子中各类化学成分具有较好的一致性[15]。主成分分析结果与相似度评价结果基本一致。
2.6.2 正交最小偏二乘法分析(OPLS⁃DA)采用SIMCA 14.0软件对12个共有指纹峰峰面积进行OPLS⁃DA分析。所建立的模型0.907,Q2=0.871>0.5,表明该模型可以用于菟丝子炮制前后的模式识别。通过OPLS⁃DA的得分散点图(见图6)可知,菟丝子药材与盐菟丝子明显聚为2类。以VIP>1.0为标准,共筛选出5个差异标志物,结果见图7。对其影响显著性排序,分别为峰3>峰6>峰7>峰2>峰11,提示这几个化学成分对于区分炮制前后的菟丝子贡献较大。OPLS⁃DA结果与独立样品t检验结果一致。
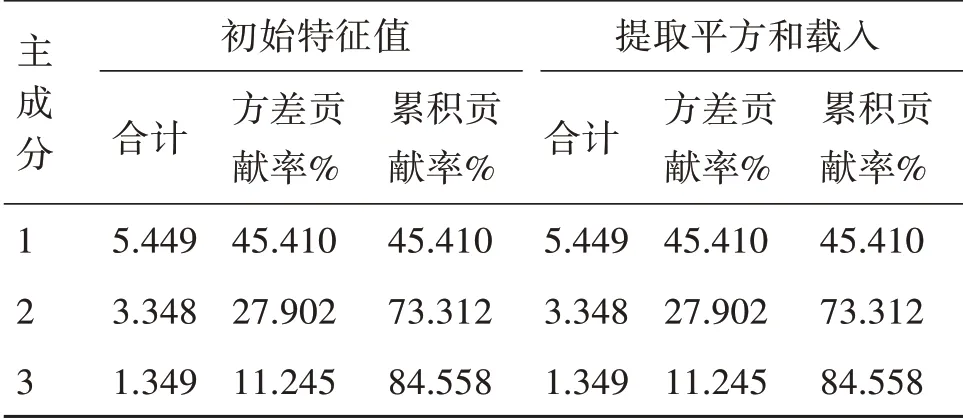
表5 菟丝子和盐菟丝子主成分分析特征值及方差贡献率Table 5 Characteristic value and variance contribution rate of Cuscutae Semen and Salt Cuscutae Semen

表6 菟丝子和盐菟丝子主成分分析成分载荷矩阵Table 6 Factors loading matrix of Cuscutae Semen and Salt Cuscutae Semen

图4 菟丝子和盐菟丝子共有峰主成分分析碎石图Figure 4 Gravel plot of principal component analysis of common peaks of Cuscutae Semen and Salt Cuscutae Semen

图5 菟丝子和盐菟丝子共有峰主成分得分散点图Figure 5 PCA Score plot of principal component analysis of common peaks of Cuscutae Semen and Salt Cuscutae Semen
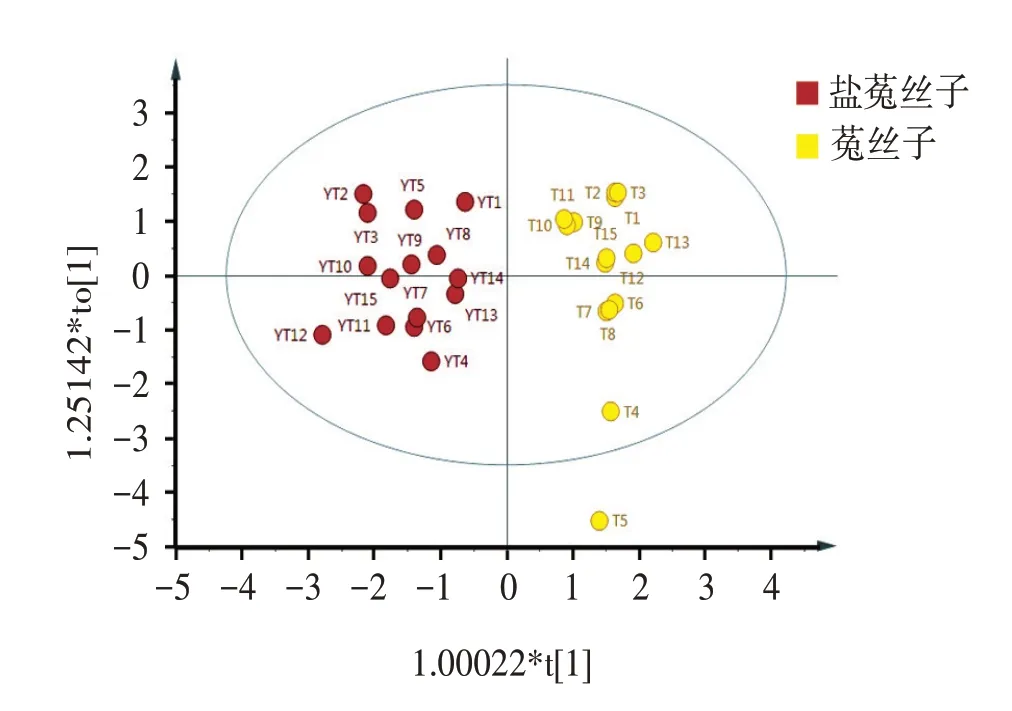
图6 菟丝子和盐菟丝子共有峰OPLS-DA得分散点图Figure 6 OPLS-DA Score plot of common peaks of Cuscutae Semen and Salt Cuscutae Semen

图7 菟丝子和盐菟丝子12个共有峰的VIP值图Figure 7 Result of VIP about 12 common peaks of Cuscutae Se⁃men and Salt Cuscutae Semen
3讨论
本研究比较了不同的流动相体系、流速、柱温下各指纹峰的分离度,结果显示以乙腈⁃0.1%磷酸为流动相,以流速为1.0 mL/min、柱温为30℃时,图谱中各色谱峰分离最好。同时也考察了360、282 nm两个吸收波长,两者的吸收峰一致,但360 nm下的基线较为平稳,所以最后选择以360 nm作为检测波长。此外,还考察了不同提取方式、提取溶剂、提取时间对提取效率的影响,最后确定以70%甲醇为溶剂,水浴回流30 min作为供试品溶液的制备方法。
本研究从菟丝子及盐菟丝子的HPLC指纹图谱中标识出12个共有峰,通过对照品指认其中的3个成分,分别为绿原酸、金丝桃苷和异槲皮苷。通过对比指纹图谱可知,菟丝子和盐菟丝子的色谱峰数目未呈现明显的增加或减少,因此,经过盐炙后的菟丝子未产生新的化学成分或导致某些化学成分的损失。相似度评价结果显示,菟丝子、盐菟丝子均与相应的对照指纹图谱的相似度较高,表明不同产地及炮制前后的菟丝子整体的化学成分具有较好的一致性。通过PCA和OPLS⁃DA分析可将菟丝子明显区分成将盐炙前后的2类,OPLS⁃DA分析筛选出5个差异标志物,分别为峰3、峰6、峰7、峰2、峰11,且OPLS⁃DA结果与独立样品t检验结果一致,表明炮制前后其化学成分含量发生了显著的变化。但对于化学成分产生的具体变化及是否为菟丝子盐炙后增强补益肝肾功效的药效物质基础有待进一步结合药理实验进行研究。本研究所建立菟丝子的指纹图谱及分析方法,能有效区分盐炙后的菟丝子,为菟丝子和盐菟丝子的质量控制提供了新的技术手段。

