黄芪注射液对LPS所致THP⁃1源性巨噬细胞炎症的干预作用
蔡大可,李钰婷,胡子旋,甘海宁,黄雪君,黄丹娥,杨九妹,赖亦静,李方圆,陈玉兴
(1.广东省中医药工程技术研究院,广东广州510095;2.广东省中医药研究开发重点实验室,广东广州510095;3.广州中医药大学第五临床医学院,广东广州510405;4.中山大学新华学院,广东广州510520)
黄芪作为一味传统中药,具有益气养元、扶正祛邪、养心通脉、健脾利湿等功效[1]。现代医学研究发现单味黄芪、复方黄芪及其有效成分均具有保护心血管[2⁃3]、降血糖血脂[4⁃5]、免疫调节[6⁃7]、保肝[8]、护肾[9]、抗肿瘤[10]等药理作用。有文献表明黄芪具有较强抗炎活性的同时兼具免疫调节的双重作用[11⁃12],避免一般抗炎药物治疗所引起的机体免疫失衡等不良反应,满足于现代抗感染治疗的新需求而被广泛用于临床治疗心气虚损、心脉瘀阻之病毒性心肌炎[13]、心功能不全及脾虚湿困之肝炎[14]等病症。巨噬细胞作为上述炎症相关疾病的关键免疫细胞,能够左右疾病的转归与发展,同时也能够被治疗药物所调控[15⁃16]。巨噬细胞根据其活化状态、发挥功能以及分泌因子的不同,分为M1型和M2型,M1型巨噬细胞通过干扰素⁃g(interferon⁃g,INF⁃g)及细菌脂多糖(lipopolysaccharide,LPS)活化,主要分泌促炎因子IL⁃1β等;M2型巨噬细胞通过分泌IL⁃4、IL⁃10等抗炎因子从而发挥抑制炎症反应以及组织修复等作用[17⁃18]。两种分型巨噬细胞的数量比例对炎症反应的发生及消退起着关键的作用,且M1和M2型巨噬细胞的转化与炎症小体信号通路NLRP3/CASPASE⁃1/IL⁃1β的调控有关[19],因此后者与黄芪的抗炎分子机制密切关系。黄芪注射液是我国CFDA批准上市的黄芪提取物药品,具有明确的抗炎作用[20],但是其对巨噬细胞的炎症表征以及关键促炎因子IL⁃1β的调控还尚未阐明。本实验通过在LPS刺激THP⁃1源性巨噬细胞的模型上,探讨黄芪注射液对巨噬细胞炎症因子表达的影响作用,在细胞水平上为黄芪注射液在临床抗炎应用以及药物作用机理研究中提供参考。
1 实验材料
1.1 主要仪器
BS224S电子天平(1/万),购自德国Sartorius公司;5450型小型高数离心机,购自德国Eppendorf公司;IM5⁃50型全自动雪花制冰机,购自常熟市雪科电气有限公司;VarioskanFlash型全波长多功能酶标仪,购自美国Thermo公司;IQTM5型荧光定量PCR仪和SmartSpecplus核酸蛋白测定仪,购自美国Bio⁃Rad公司;ini⁃protean Teral Cell垂直电泳槽、Pow⁃erPac Basic电泳仪、M制胶器均购自美国Bio⁃Rad公司;PVDF膜,购自美国MilliPore公司;Tanon 5200 Multi多功能成像系统,购自上海天能科技有限公司。
1.2 主要试剂
黄芪注射液,购自正大青春宝药业有限公司,批号:1810112;LPS,购自广州奕元生物技术有限公司,批号:20180616;佛波酯(PMA),购自美国Sigma公司,批号:20190103;RPMI⁃1640培养基,购自上海中乔新舟生物科技有限公司,批号:201811;1%10 U/mL青霉素和10 mg/mL链霉素混合液(双抗),购自美国Gibco公司,批号:20180907;胎牛血清,购自博维根生物制品有限公司,批号:181023;无水乙醇和异丙醇,购自广州化学试剂厂,批号:20181102;脱氧核糖核酸去离子水,购自天根生化科技(北京)有限公司,批号:20180722;TRIzol®总RNA提取试剂,购自康为世纪生物科技有限公司,批号:20180117;SYBRgreen和反转录试剂盒均购自日本Takara公司,批号:20180114;PCR引物,由英潍捷基上海贸易有限公司合成;NLRP3和caspase⁃1抗体,购自艾博抗(上海)贸易有限公司,批号:201811;CCK8试剂盒,购自东仁化学(上海)有限公司,批号:20180901;IL⁃4、IL⁃10和IL⁃1βELISA试剂盒,购自上海邦奕生物科技有限公司,批号:201809;RIPA蛋白裂解液,购自北京索莱宝科技有限公司,批号:201810;蛋白酶抑制剂、磷酸酶抑制剂、5×SDS⁃PAGE购自美国bimake生物科技有限公司,批号:201809。
2 方法
2.1 细胞培养
THP⁃1细胞株购自上海生物化学与细胞生物学研究所细胞中心。THP⁃1单核细胞用含10%(φ)胎牛血清、1%10 U/mL青霉素和10 mg/mL链霉素混合液的RPIM⁃1640培养基,置于37℃、5%(φ)CO2培养箱中静置培养,细胞数目维持在1×106cells/mL,待生长良好,以6×105cells/mL细胞数接种于相应板中。
2.2 细胞分组
将生长良好的THP⁃1单核细胞均匀接种于96孔板中,每组6个复孔,用于黄芪注射液对细胞增殖的检测。在接种细胞的同时,给予10 nmol/L PMA诱导24 h,将THP⁃1单核细胞诱导为巨噬细胞,24 h后将含PMA培养基弃去,换成完全培养基继续培养48 h,后换无血清培养基100 mL/孔,同时给予相应药物,分别为正常组、黄芪注射液(HQ)10%[注射剂体积/(培养基体积+注射剂体积)]、5%、2.50%、1.25%、0.625%、0.313%、0.156%、0.078%组,每组6个复孔,重复两块板。干预24 h后,其中一块板每孔加入10 mL CCK8,另一块不作处理。1 h后用全波长酶标仪在450 nm波长下检测其吸光度值A,计算细胞存活率(存活率=A给药组/A空白组×100%)。
将生长良好的THP⁃1单核细胞均匀接种于6孔板中,每组3个复孔,共6组,分别为正常对照组(Control)、模型组(LPS 500 ng/mL)、LPS+黄芪注射液200μL/mL(HQ200)、LPS+黄芪注射液100μL/mL(HQ100)、LPS+黄芪注射液50μL/mL(HQ50)、LPS+黄芪注射液25μL/mL(HQ25),以同样的方法诱导单核细胞分化为巨噬细胞后,换无血清培养基2 mL/孔,同时给予相应药物,重复2次实验,干预24 h后,上清液用于ELISA检测,细胞用于PCR和WB的检测。
2.3 ELISA检测细胞上清液中IL⁃4、IL⁃10和IL⁃1β的含量
在药物干预24 h后,收集细胞上清液,根据ELISA试剂盒说明书,用多功能酶标仪在450 nm波长下检测A值,再根据公式计算IL⁃4(Y=-3.48×10-7X2+6.65×10-4X+1.31×10-4)、IL⁃10(Y=7.06×10-10X2+4.07×10-5X⁃5.16×10-3)和IL⁃1β(Y=⁃7×10-7X2+0.001X+0.034)的含量。
2.4 RT⁃qPCR检测炎症相关基因mRNA的表达
每孔细胞中加入1 mL TRIzol,室温放置5 min,根据TRIzol总RNA提取试剂说明书提取细胞总RNA,用0.5 mg总RNA根据反转录试剂盒说明书将RNA转录为cDNA,再对其进行扩增,用b⁃actin基因作为内参对照基因,在反应条件:步骤1:94℃×5 min;步骤2:94℃×30 s→60℃×30 s→72℃×50 s(45个循环);步骤3:72℃×7 min下,进行RT⁃qPCR扩增,运用2-△△C t法计算各组基因相对表达量。相关引物信息如表1所示。

表1 炎症相关引物序列Table 1 Primers sequences of inflammation⁃related genes
2.5 Western blot检测炎症相关蛋白的表达
将RIPA、蛋白酶抑制剂、磷酸化酶抑制剂按照100∶1∶1的体积比制成混合物,六孔板中的细胞每孔加入100 mL RIPA混合物,并在4℃下裂解5~10 min,用细胞刮刀将细胞刮取转移至1.5 mL EP管中,进行超声离心后,吸取上清,根据上清量加入5×SDS⁃PAGE蛋白缓冲液,95℃煮沸5 min使蛋白变性,-80℃下保存。根据目的蛋白条带选择分离胶浓度,对照标准Marker条带大小取所需要的蛋白条带,转膜,封闭,孵育一抗,洗涤,孵育二抗,洗涤,在化学发光液中浸泡1 min后,用凝胶自动成像系统对条带进行拍摄。用ImageJ软件对条带进行半定量分析。
2.6 统计学处理
实验数据用SPSS22.0软件进行处理,结果用均值±标准差(±s)表示,服从正态分布的数据用单因素方差分析,不服从正态分布的数据用非参数检验的Kruskal⁃Wallis检 验,P<0.05为 差 异 有 统 计 学意义。
3 结果
3.1 黄芪注射液对巨噬细胞增殖的影响
如图1所示,10 mL/mL以内系列浓度的黄芪注射液对细胞无毒性,且可促进细胞增殖,因而在安全范围内选取系列浓度进行药效研究。
3.2 黄芪注射液对LPS所致巨噬细胞炎症因子分泌的影响
如表2所示,在LPS刺激下,巨噬细胞分泌抗炎因子IL⁃4、IL⁃10含量显著降低(P<0.05),而趋化因子IL⁃1β的分泌量显著升高(P<0.05);在给予黄芪注射液干预后,与LPS组相比,IL⁃4和IL⁃10的分泌量呈上升趋势,其中HQ100组和HQ50组的IL⁃4分泌量显著升高(P<0.01),HQ100组和HQ25组的IL⁃10分泌量显著升高,差异有统计学意义(P<0.01),而各组IL⁃1β分泌量均显著降低(P<0.05,P<0.01)。

图1 黄芪注射液对巨噬细胞增殖的影响Figure 1 Effect of astragalus injection on macrophage prolif⁃eration(±s,n=6)
3.3 黄芪注射液对巨噬细胞炎症相关基因mRNA表达的影响
如图2所示,在LPS刺激下,巨噬细胞中抗炎因子IL⁃4、IL⁃10 mRNA表达量明显降低(P<0.05),而促炎因子IL⁃1β、CASPASE⁃1、IL⁃6以及IL⁃18 mRNA的表达量显著升高(P<0.01);在给予黄芪注射液干预后,与LPS组相比,IL⁃4和IL⁃10mRNA表达量均呈上升趋势(P<0.01),I L⁃1β、C A S PA S E⁃1、IL⁃6以及IL⁃18 mRNA表达量显著降低(P<0.01)。
3.4 黄芪注射液对巨噬细胞炎症相关蛋白表达量的影响
如图3所示,在LPS的刺激下,巨噬细胞炎症小体NLRP3及其下游cleaved⁃CASPASE⁃1蛋白表达量显著升高(P<0.01);在黄芪注射液的干预下,与LPS组比较,HQ25、HQ50和HQ200组的NLRP3、cleaved⁃CASPASE⁃1蛋白表达量显著降低(P<0.01)。
表2 黄芪注射液对巨噬细胞炎症因子分泌的影响Table 2 Effect of astragalus injection on the secretion of IL⁃4,IL⁃1βand IL⁃10 in macrophages(±s,n=3) ρ/(pg·mL⁃1)

表2 黄芪注射液对巨噬细胞炎症因子分泌的影响Table 2 Effect of astragalus injection on the secretion of IL⁃4,IL⁃1βand IL⁃10 in macrophages(±s,n=3) ρ/(pg·mL⁃1)
与正常组比较:#P<0.05;与LPS组比较:*P<0.05,**P<0.01。
组别Control LPS HQ200 HQ100 HQ50 HQ25药物浓度-500 ng/mL 200μL/mL 100μL/mL 50μL/mL 25μL/mL IL⁃4 212.06±2.90 193.92±3.26#213.36±27.69 216.90±1.95**220.15±2.98**196.78±6.63 IL⁃10 1 612.84±174.61 1 360.03±35.19#1 465.35±93.53 1 620.90±48.41**1 504.34±71.31 1 860.14±115.40**IL⁃1β 106.46±6.46 125.60±9.10#111.36±5.34*105.84±1.17*99.82±6.76**103.99±13.53**
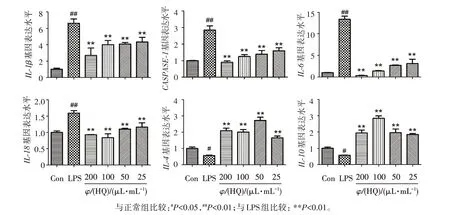
图2 黄芪注射液对炎症基因mRNA表达的影响Figure 2 Effect of astragalus injection on the mRNA expression of inflammatory genes(±s,n=3)

图3 黄芪注射液对炎症相关蛋白表达量的影响Figure 3 Effect of astragalus injection on the expression of inflammation⁃related protein(±s,n=3)
4 讨论
黄芪注射液是中药黄芪按照标准中药成方制剂所提取的注射剂,其成分之一芒柄花素可与AMPK间接结合激活自噬,降低LPS诱导的NLRP3表达[21]。在小鼠巨噬细胞(ANA⁃1细胞)中黄芪注射液可上调自噬通量,抑制炎症因子IL⁃1β、IL⁃6的分泌从而发挥抗炎作用[22]。本实验验证黄芪注射液具有明显的抗炎作用,而且发现其抗炎作用与NLRP3/caspase⁃1的激活相关。同时,其抗炎作用亦与抗炎因子与促炎因子的转录水平、翻译水平、两类因子的相互转化有相关性。
THP⁃1细胞因具有与人原代单核细胞相似的形态和功能,且具有稳定的基因背景,而常被用于免疫和炎症的研究。本实验通过用佛波酯(PMA)将THP⁃1细胞诱导分化为巨噬细胞,进而通过LPS诱导巨噬细胞M1型极化用以造成巨噬细胞炎症反应。实验发现,将巨噬细胞用LPS处理后,趋化因子IL⁃1β的分泌明显增加,且炎症因子IL⁃1β、CAS⁃PASE⁃1、IL⁃6、IL⁃18 mRNA表达以及NLRP3及其下游激活型CASPASE⁃1蛋白表达量也显著升高。IL⁃1β是M1型巨噬细胞标志性炎性因子[23],也是介导各种炎症反应的关键因子,在LPS或某些病毒的刺激下可诱导单核细胞、巨噬细胞等分泌[24],对单核/巨噬细胞具有特异性趋化,从而激活炎性反应的下游环节,促进IL⁃6、IL⁃18等的分泌,最终形成炎症性损伤[25]。由此可见,LPS可刺激巨噬细胞转化为促炎M1型巨噬细胞,致使IL⁃1β相关炎症小体炎症的激活,该结果验证LPS调控巨噬细胞分化及促炎的作用[26]。黄芪注射液作为抗炎药物,能否逆转LPS所致的炎症小体激活仍有待验证。
在给予黄芪注射液干预后发现,THP⁃1源性巨噬细胞中IL⁃1β的转录水平、胞外分泌下降,IL⁃1β的翻译后修饰调控蛋白NLRP3及caspase⁃1亦受到抑制,且炎症因子I L⁃6、IL⁃18 mRNA表达也明显减少。鉴于IL⁃1β为巨噬细胞参与多种疾病发生发展的关键因子,其激活过程需要经过转录翻译表达和剪切激活等关键步骤[27],黄芪注射液对于IL⁃1β转录及其上游NLRP3炎症小体活性均有调控作用,提示黄芪注射液的调控靶点可能为IL⁃1β及NLRP3共同上游的调控因子——活性氧[28]。另外,本实验研究发现黄芪注射液可明显上调IL⁃4和IL⁃10的mRNA表达以及分泌。IL⁃4和IL⁃10是M2型巨噬细胞抑制性细胞因子,M2型巨噬细胞可通过这些抑制性细胞因子下调免疫应答,限制炎性反应[21]。换言之,黄芪注射液可促进巨噬细胞从M1型向M2型转化。由于巨噬细胞极化亦为细胞内活性氧所调控,黄芪注射液促巨噬细胞极化的作用可能与其调控活性氧本身或其相关分子靶点相关。
综上所述,黄芪注射液具有明显的抗炎药效,并通过逆转巨噬细胞NLRP3/caspase⁃1/IL⁃1β炎症小体激活以及诱导巨噬细胞M2极化等双重调控来实现,从而抑制炎症反应发生。本实验从细胞水平上对黄芪注射液的抗炎作用进行研究,为黄芪注射液的临床应用及药理作用研究提供了分子生物学基础。

