龙脷叶水提取物对哮喘大鼠肺组织病理学及炎症因子的影响
陈素雯,魏嘉宝,邱思娃,李苑新,蔡延渠,吴燕红
(1.广东药科大学新药研发中心,广东广州510006;2.高州中医院药学部,广东高州525200)
龙脷叶是岭南民间传统常用止咳平喘中药,始载于《岭南采药录》,其中所记载的龙脷叶“治痰火咳嗽,以其叶煮猪肉汤食之”[1]。临床上龙脷叶常用于治疗“支气管炎、支气管哮喘、肺结核咳嗽”等呼吸道疾病[2-3],近年来,对龙脷叶的药理研究报道主要涉及抗炎及止咳作用,对平喘作用的研究较少。本研究采用大鼠哮喘模型,观察龙脷叶水提取物对哮喘大鼠支气管及肺组织的病理学及血清中IL⁃5、TXB2和6⁃Keto⁃PGF1α的影响,初步探讨龙利叶平喘的作用机制。
1 材料
1.1 实验动物
SPF级SD大鼠40只,雌雄各半,体质量140~160 g,购自广东省医学实验动物中心,生产许可证号:SCXK(粤)2018⁃0002,饲养于广东药科大学实验动物中心,使用许可证号:SYXK(粤)2017⁃0125。
1.2 药物
龙脷叶水提取物制备:龙脷叶(批号180801,符合2015年版《中国药典》标准,广东时珍制药有限公司),剪碎,大小约为2 cm×2 cm,加10倍量水煎煮1 h,煎煮2次,医用棉花过滤,合并滤液,浓缩至每毫升相当于生药量1 g(1 g/mL)。地塞米松注射液(2 mg/mL,批号1704292,江苏涟水制药有限公司);0.9%NaCl注射液(批号H18060814,山东华鲁制药有限公司);乌拉坦(批号Z30S9Y71673,上海源叶生物科技有限公司)。
1.3 试剂
卵清白蛋白(OVA)(批号1031K051,北京Solar⁃bio公司);氢氧化铝凝胶(批号O1004A,大连美仑生物技术有限公司);IL⁃5和TXB2 ELISA试剂盒(批号分别为:L190109529、L181211238,武汉优尔生生命科学装备有限公司);6⁃Keto⁃PGF1αELISA试剂盒(批号:TY3CXHLYC6,武汉伊莱瑞特生物科技有限公司);无水乙醇、二甲苯、盐酸、氨水、中性树胶(国药集团化学试剂有限公司);苏木素⁃伊红染液(G1005,武汉谷歌生物科技有限公司)。
1.4 主要仪器
雾化箱(自制,30 cm×19 cm×17 cm);WH⁃802超声波雾化器(广东粤华医疗器械厂有限公司);Neo⁃fuge 15R台式高速冷冻离心机(力康生物医疗科技控股有限公司);MX⁃F涡旋混合器(武汉塞维尔生物科技有限公司);DW⁃86L626超低温冰箱(青岛海尔生物医疗股份有限公司);RT3100自动洗板机(雷杜生命科学股份有限公司);Epoch酶标检测仪(美国伯腾仪器有限公司);JJ⁃12J脱水机(武汉俊杰电子有限公司);JB⁃P5包埋机(武汉俊杰电子有限公司);RM2016病理切片机(上海徕卡仪器有限公司);JB⁃L5冻台(武汉俊杰电子有限公司);KD⁃P组织摊片机(浙江省金华市科迪仪器设备有限公司);Nikon Eclipse CI正置光学显微镜(Nikon Corporation);Nikon DS⁃U3成像系统(Nikon Corporation)。
2 方法
2.1 实验分组
40只大鼠随机分为正常组(N组)、模型组(Mo组)、龙脷叶水提取物高剂量组(H组)、龙脷叶水提取物低剂量组(L组)、地塞米松组(De组),每组8只(雌性4只,雄性4只,分组分性别分笼饲养),实验前适应性喂养1周。
2.2 哮喘模型建立
参考文献[4⁃5]制备大鼠哮喘模型:除正常组外,其余各组于实验第1天腹腔注射含OVA 100 mg与100 mg氢氧化铝凝胶的生理盐水混悬液1 mL,致敏大鼠,正常组以生理盐水代替OVA腹腔注射,第15天开始将大鼠置于自制的透明密闭雾化箱,以2%OVA生理盐水溶液最大量超声雾化吸入激发,每次30 min,连续激发14 d,正常组以生理盐水代替OVA超声雾化吸入。除正常组外大鼠腹腔注射OVA后即出现精神萎靡、拱背蜷缩等表现。在雾化激发后前5~10 min出现躁动不安、搔抓鼻子皮毛等症状,10 min后活动明显减少、毛发竖立、俯卧不动、伸颈等表现为模型建立成功。
2.3 给药方法
从第15天起于每次激发前1 h灌胃给药,N组与Mo组灌服注射用生理盐水1 mL/100 g;De组灌服地塞米松注射液0.5 mg/kg;根据《中国药典》规定用量9~15 g,按徐叔云教授主编的《药理实验方法学》中不同实验动物与人的等效剂量比值来计算实验用药剂量,即H、L组灌服龙脷叶水提取物剂量分别为5.4 g/kg与1.35 g/kg;每天1次,连续14 d。
2.4 标本采集
2.4.1 血清样本采集 末次给药雾化吸入OVA激发哮喘后24 h内,各组大鼠分别给予20%的乌拉坦生理盐水溶液(剂量0.8 g/kg)腹腔注射麻醉,眼眶内静脉取血3~5 mL,3 500 r/min离心15 min,吸取血清,-80℃保存备用。
2.4.2 肺组织样本采集 大鼠取血后迅速剖取肺脏。取左侧肺脏组织固定于4%(φ)多聚甲醛24 h以上。
2.5 指标检测
2.5.1 肺组织病理学观察 将固定后的组织逐级酒精脱水、包埋、切片,HE染色法,封片后在光学显微镜下观察支气管与肺组织的病理变化,比较各组大鼠支气管与肺组织病理学变化。
2.5.2 血清IL⁃5、TXB2和6⁃Keto⁃PGF1α含量检测 将保存于-80℃血清进行解冻处理,按ELISA试剂盒操作说明进行IL⁃5、TXB2和6⁃Keto⁃PGF1α检测。
2.5.3 数据统计与分析 应用SPSS18.0统计软件分析,实验数据以均数±标准差(±s)表示。两组样本间比较采用t检验,P<0.05为差异具有统计学意义。
3 结果
3.1 肺组织病理学观察
肺组织HE染色结果显示,N组:支气管上皮细胞结构完整,排列紧密(A),局部可见细支气管(B)管腔内有少量脱落的上皮细胞(黑色箭头)及少量嗜酸性黏液分泌(黄色箭头);组织中可见较多肺泡壁轻度增厚,并伴有少量淋巴细胞与中性粒细胞浸润(C)(红色箭头)。如图1。
Mo组:多见支气管管腔内有少量脱落的上皮细胞(A)(黑色箭头)及少量嗜酸性黏液分泌(黄色箭头),局部支气管管腔内可见较多红细胞(蓝色箭头);多见血管周围有较多炎性细胞浸润成环,形成血管套袖(红色箭头);多见支气管、血管周围与肺泡组织内有较多巨噬细胞浸润(B)(绿色箭头),多见肺泡壁增厚,并伴有较多炎性细胞浸润(C)(红色箭头)。如图2。
De组:支气管上皮细胞结构完整,排列紧密(A),局部细支气管管腔内有少量嗜酸性黏液分泌(黑色箭头),局部管腔内可见少量脱落的上皮细胞(黄色箭头)及少量红细胞(蓝色箭头);血管周围“套袖”样炎性浸润消失,多见支气管与血管周围肺泡腔中有较多巨噬细胞浸润(红色箭头);多见肺泡壁增厚,伴有较多淋巴细胞与中性粒细胞浸润(绿色箭头)。如图3。
H组:局部可见支气管管腔内有少量脱落的上皮细胞(黑色箭头)及少量嗜酸性黏液分泌(黄色箭头),局部支气管管腔内可见少量红细胞;血管周围“套袖”样炎性浸润明显减少或消失,局部可见血管或气管周围肺泡腔中有较多巨噬细胞浸润(蓝色箭头);多见肺泡壁增厚,局部有较多炎性细胞浸润(红色箭头)。如图4。
L组:局部可见支气管管腔内有少量脱落的上皮细胞(黑色箭头)及少量嗜酸性黏液分泌(黄色箭头);血管周围“套袖”样炎性浸润明显减少或消失,局部可见血管或气管周围肺泡腔中有较多巨噬细胞浸润(绿色箭头);组织中可见大量肺泡壁增厚,并伴有较多淋巴细胞与中性粒细胞浸润(红色箭头);局部可见肺泡腔内有少量嗜酸性物质(蓝色箭头)。如图5。

图1 正常对照组肺组织染色结果(200×)Figure 1 Histopathology of lung tissues in the normal group(200×)
观察图1~图5中各实验组的肺组织染色结果可知,与N组相比,M组支气管管腔内有部分上皮细胞脱落,支气管、血管周围和肺泡组织炎性细胞明显增多,且在血管周围形成明显的“套袖”环,哮喘病变样改变明显,表明实验造模成功。与M组相比,De、H、L组中巨噬细胞等炎性细胞均有明显减少,血管周围“套袖”样炎性浸润明显减少或消失,表明治疗组能有效改善哮喘大鼠的肺组织和支气管病变。

图2 哮喘模型组肺组织染色结果(200×)Figure 2 Histopathology of lung tissues in the model group(200×)
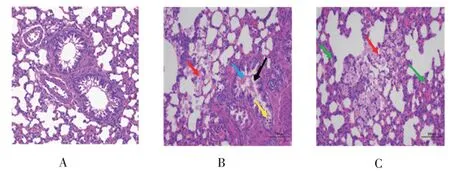
图3 地塞米松组肺组织染色结果(200×)Figure 3 Histopathology of lung tissues in the dexamethasone group(200×)

图4 龙脷叶高剂量组肺组织染色结果(200×)Figure 4 Histopathology of lung tissues in the high dose of Sauropus spatulifolius group(200×)
3.2 大鼠血清中IL⁃5、TXB2和6⁃Keto⁃PGF1α浓度水平
与正常组比较,模型组IL⁃5和TXB2浓度水平显著升高(P<0.01),而6⁃Keto⁃PGF1α浓度水平显著降低(P<0.01),TXB2/6⁃Keto⁃PGF1α比值显著升高(P<0.01);地塞米松组、龙脷叶水提取物高剂量、低剂量组分别与模型组相比,IL⁃5和TXB2浓度水平显著降低(P<0.01),而6⁃Keto⁃PGF1α浓度水平显著升高(P<0.01,P<0.05);TXB2/6⁃Keto⁃PGF1α比值显著降低(P<0.01)。见表1。

图5 龙脷叶低剂量组肺组织染色结果(200×)Figure 5 Histopathology of lung tissues in the low dose of Sauropusspatulifolius group(200×)

表1 各组大鼠血清中炎性因子水平比较Table 1 Comparison of inflammatory factors in serum of rats in each group(x±s,n=8)
4 讨论
哮喘是呼吸道常见疾病,通常认为哮喘是由多种细胞特别是肥大细胞、嗜酸性粒细胞、T淋巴细胞参与的慢性气道炎症。IL⁃5是由活化的Th2细胞产生的细胞因子,可刺激嗜酸性粒细胞生长和分化,主要表现为对嗜酸性粒细胞(EOS)募集、迁移入呼吸道并维持炎症反应具有正向调控作用,嗜酸性粒细胞浸润和IL⁃5表达水平增高是哮喘支气管黏膜的特征性改变[6]。研究表明,IL⁃5是哮喘炎症中的主要调节因子[7⁃8]。
血栓素A2(TXA2)和前列腺素I2(PGI2)的比例失衡在哮喘发病中的作用,已越来越受到国内外学者的关注[9⁃10]。TXA2可促使血小板聚集,气道平滑肌收缩,还可促使气道分泌物增多,血管渗透性增高,从而加重气道的炎症反应,而PGI2的作用几乎与TXA2的作用相反。因此,TXA2增高或PGI2下调,致TXA2/PGI2比例失衡或增高引起支气管平滑肌收缩而导致哮喘[11⁃13]。TXA2和PGI2在体内水解为活性很小但更稳定的代谢产物TXB2和6⁃ket⁃PGF1α,常 以TXB2和6⁃ket⁃PGF1α作 为 观 察TXA2和PGI2活性的标志物。因此,血清TXB2和6⁃ket⁃PGF1α水平可作为衡量TXA2和PGI2平衡的标志物[14⁃16]。
本实验结果显示龙脷叶提取物能降低哮喘大鼠血清中IL⁃5、TXB2浓度水平和TXB2/6⁃ket⁃PGF1α比值,显著升高6⁃keto⁃PGF1α浓度水平,提示龙脷叶水提取物可能通过降低炎性细胞浓度水平从而减轻哮喘模型大鼠肺组织与气管的炎性病理改变,促进哮喘大鼠肺功能的恢复。但在治疗组(地塞米松组、龙脷叶提取物高剂量、低剂量组)的病理切片中气管与肺泡组织周围仍可观察到较多的巨噬细胞与炎性细胞,这种情况有待进一步探讨。后续可进行更深入的血清化学研究,结合高效液相法和质谱分析法检测鉴定有效成分,将有助于阐明其发挥哮喘作用的物质基础。

