离子色谱法测定糊精中的5种还原糖
李艺,王淼
(广东省药品检验所,广东广州510006)
糊精系由淀粉或部分水解的淀粉,在干燥状态下经加热改性而制得的聚合物[1]。糊精通常分为白糊精、黄糊精和英国胶三类。白糊精随着转化作用的进行,还原糖稳定地上升到最高值,在转化作用的后期,还原糖增加的速度较缓慢;黄糊精和英国胶,当黏度开始下降时还原糖含量开始减少,因此,还原糖是反映淀粉水解程度的关键指标。在制药工业中,糊精作为药用辅料主要用于片剂和胶囊剂的稀释剂,片剂的黏合剂,糖包衣的增塑剂和黏合剂,以及混悬剂的增稠剂[2],用量大,辅料的还原性可能影响制剂中原料药的活性。因此有必要对糊精中还原糖进行控制。
糊精收载于《中国药典》2020年版四部[1],利用还原糖对碱性酒石酸铜的还原性,采用重量法进行测定;《美国药典》和《英国药典》中也收载了糊精,采用滴定法对还原糖进行控制,原理与《中国药典》相同,该法仅能分析还原糖的总量。目前,文献报道测定还原糖和总糖的方法主要有高效液相色谱法[3⁃4]、比色法[5]及紫外可见法[6]等。上述方法大多存在需要前处理,分析效率低,或者选择性较差的不足。而离子色谱法利用其优异的阴离子交换色谱柱的分离技术,脉冲安培检测器所具有的优势,在糖类物质的检测中得到越来越多的应用,可以很好地弥补上述不足。因此,本研究参考文献[7],采用操作较为简单快速且专属性较高的离子色谱法首次测定糊精中还原糖,为糊精的质量控制提供一个简便而有效的方法。
1 仪器与试药
ICS⁃5000+DC离子色谱仪,Thermofisher,主要配置在线脱气装置的四元梯度泵、柱温箱、脉冲安培检测器(Au为工作电极,Ag/AgCl为参比电极);D⁃葡萄糖(中国食品药品检定研究院,批号110833⁃201707,质量分数:99.5%);麦芽糖(中国食品药品检定研究院,批号:100287⁃201604,质量分数:94.4%);麦芽三糖(中国食品药品检定研究院,批号:100274⁃201703);麦芽四糖(上海源叶生物科技有限公司,批号:Z04J9X52064,质量分数:98%);麦芽五糖(中国食品药品检定研究院,批号:112017⁃201602,质量分数100%);糊精样品(A企业:180108C、180306B;B企业:180212、180301;C企业:171201;D企业:160314);试剂均为分析纯;纯化水。
2 方法与结果
2.1 色谱条件
色谱仪:ICS⁃5000+DC离子色谱仪;检测器:脉冲安培检测器(Au为工作电极,Ag/AgCl为参比电极);色谱柱:Dionex CarboPac PA200分析柱(250 mm×5 mm),Dionex CarboPac PA200保护柱(50 mm×5 mm);流速:0.4 mL/min;柱温:30℃;进样量:25μL;以纯化水流动相A,0.25 mol/L NaOH溶液为流动相B,0.25 mol/L醋酸钠溶液为流动相C,按表1进行梯度洗脱。
2.2 溶液的制备
2.2.1 供试品溶液的制备
取本品约0.1 g,精密称定,置100 mL量瓶中,加水适量,摇匀,稀释至刻度,作为供试品溶液,滤过(0.22μm微孔滤膜)。
2.2.2 对照品溶液的制备
精密称取D⁃葡萄糖、麦芽糖、麦芽三糖、麦芽四糖和麦芽五糖适量,加水稀释成每1 mL中含D⁃葡萄糖、麦芽糖、麦芽三糖、麦芽四糖和麦芽五糖各100μg的溶液作为对照品储备液。精密量取对照品储备液5 mL,置50 mL量瓶中,加水稀释至刻度,作为对照品溶液。

表1 梯度洗脱程序Table 1 Gradient elution program
2.3 属性及系统适用性
取对照品溶液与空白溶液,精密量取25μL,分别注入离子色谱仪,按“2.1”项色谱条件进行测定,记录色谱图见图1。可见,D⁃葡萄糖、麦芽糖、麦芽三糖、麦芽四糖和麦芽五糖的保留时间分别为7.2、19.8、23.4、27.4、30.3 min,分离度均大于1.5,空白溶剂无干扰。
2.4 线性关系的考察
分别精密量取“2.2.2”项下的对照品储备液加水稀释成含D⁃葡萄糖、麦芽糖、麦芽三糖、麦芽四糖和麦芽五糖质量浓度分别为0.1、1、2、5、10、20μg/mL的系列溶液,作为线性溶液。按“2.1”项色谱条件测定。以对照品质量浓度作横坐标(X)、峰面积作为纵坐标(Y),得到各成分测定的线性方程、相关系数及线性范围见表2。
2.5 检出限和定量限的考察
精密量取“2.2.2”项下的对照品储备液适量,加水定量稀释制成每1 mL中含D⁃葡萄糖、麦芽糖、麦芽三糖、麦芽四糖和麦芽五糖各约0.01μg的溶液,作为限度溶液。按“2.1”项色谱条件测定,记录色谱图,计算信噪比,以基线噪音3倍和基线噪音10倍分别计算检出限及定量限,各成分的检出限及定量限见表2。
2.6 精密度试验
取“2.2”项下对照品溶液各6份,连续进样测定,结果测得D⁃葡萄糖、麦芽糖、麦芽三糖、麦芽四糖和麦芽五糖的峰面积RSD值分别为0.8%、0.5%、0.9%、0.7%和0.8%,表明方法精密度良好。
2.7 稳定性试验
取“2.2.1”项供试品溶液,分别于0、2、8、12、24、48 h时进样,记录色谱图,测定峰面积值。结果表明各成分峰面积均无显著性变化,RSD值均小于2.0%,表明供试品溶液在48 h内稳定。
2.8 重复性试验
取A企业样品(批号:180108C),按“2.2.1”项方法配制供试品溶液,共6份,分别进样记录色谱图,结果测得葡萄糖、麦芽糖、麦芽二糖、麦芽三糖、麦芽四糖和麦芽五塘的RSD分别为1.2%、2.3%、0.8%、1.8%和1.9%,表明方法重复性良好。
2.9 加样回收率试验
取A企业样品(批号:180108C)约0.05 g,精密称定,置50 mL量瓶中,分别精密加入“2.2.2”项下对照品储备液4、5、6 mL,再按“2.2.1”项方法制备低、中、高3个回收浓度的供试品溶液,各3份,共9份,按“2.1”项色谱条件进样测定,计算回收率,结果测得D⁃葡萄糖平均回收率为98.4%,RSD为0.5%;麦芽糖平均回收率为99.2%,RSD为0.3%;麦芽三糖平均回收率为100.9%,RSD为1.1%;麦芽四糖平均回收率为98.9%,RSD为1.0%;麦芽五糖平均回收率为99.1%,RSD为0.8%,详见表3。

图1 空白对照溶液(A)、对照品溶液(B)和供试品溶液(C)的离子色谱图Figure 1 Chromatograms of the black(A),reference standard(B)and sample(C)
2.1 0 样品测定
取4个不同厂家共6批样品,按“2.2”项下方法制备对照品溶液与供试品溶液,进样,按“2.1”项下色谱条件测定,按外标法以峰面积计算。同时按《中国药典》方法进行还原糖测定遗留残渣,各样品测定结果见表4。

表2 各成分的线性方程与线性范围及检出限和定量限Table 2 The linear equation,linear range,detection limit and quantitative limit of each component
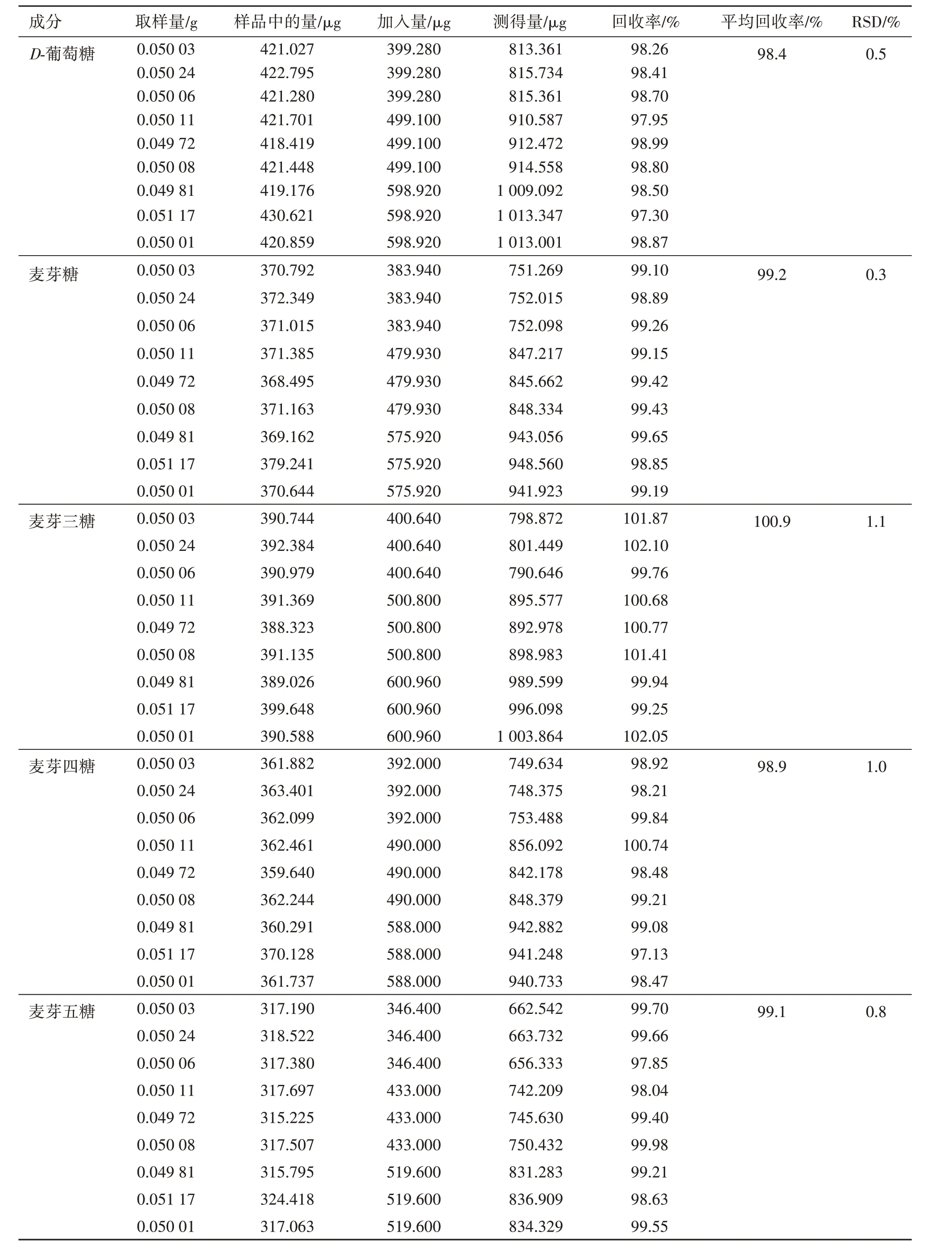
表3 糊精中5种还原糖的回收率试验结果Table3 Resultsofrecoveryoffivereducingsugarsindextrin

表4 不同厂家样品中5种还原糖的测定结果Table 4 The results of determination of five reducing sugars in dextrin w/%
3 讨论
在糊精的干法转化过程中,淀粉发生的化学反应比较复杂,主要包含水解反应、苷键转移反应、再聚反应。酸可催化断裂淀粉中的α⁃1,4糖苷键,也可能断裂α⁃1,6糖苷键[8],苷键水解形成的还原性端基量增加,还原性增加。糊精中所含还原糖是混合物,水解反应生成含有游离醛基或酮基的葡萄糖单糖和含有游离醛基的麦芽糖,因而具有一定的还原性。此外,糊精还可能水解出麦芽三糖、麦芽四糖、麦芽五糖等,也具有一定的还原性基团。因此,本研究选择上述5种糖进行检测,结果显示糊精中确实存在上述5种糖。本研究可以定量分析糊精水解出的葡萄糖、麦芽糖、麦芽三糖、麦芽四糖和麦芽五糖的含量,可为该检查项提供具体量化数据,为分析糊精中的还原成分起到了巨大作用。
糊精在《中国药典》中的还原糖检查项采用重量法,通过测得氧化亚铜残渣的量,从而判断糊精中还原糖总量。根据《中国药典》中的方法,对4个厂家的6批样品进行检测,遗留残渣量分别为6.60%、3.08%、3.88%、6.08%、9.65%和0.64%。该结果对比本研究建立的离子色谱法检测结果可以看出,2种检测方法得到的结果趋势性一致,重量法检验得到遗留残渣多的供试品采用离子色谱法检测时的测定结果也较大;另外,对比两种方法得到的结果还发现重量法的结果均大于离子色谱法的检测结果,原因分析一方面是重量法得到的结果是糊精中存在的还原性物质总量,可能会有与碱性酒石酸铜试液反应生成沉淀的其他物质,另一方面可能是由于离子色谱法测得的结果是由葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖相加的总量,糊精中可能还存在其他还原糖或者还原性物质。
在试验中发现,重量法影响结果的因素较多,如煮沸反应时间、过滤、洗涤、干燥等步骤都可能对结果造成影响,重复性较差;而离子色谱法简单快速且专属性较高,排除了人为操作对结果的影响。
本研究参考离子色谱⁃积分脉冲安培检测法测定β⁃环糊精中的有关物质[7]中的色谱条件建立了检测方法,通过试验表明,方法灵敏度高、准确性好,样品制备简单,所测成分之间的分离度良好,可准确检测糊精中不同还原糖的含量,为糊精的质量控制提供了一个简便而有效的方法,同时也在其他高分子多糖化合物的还原糖含量测定中具有广阔的应用前景。

