改性花生分离蛋白对猪肉肌原纤维蛋白凝胶特性的影响
吴萌萌,栗俊广,孙芳菲,姜茜,望运滔,白艳红
1. 郑州轻工业大学食品与生物工程学院(郑州 450000);2. 河南省冷链食品质量安全控制重点实验室(郑州 450000);3. 河南省食品生产与安全协同创新中心(郑州 450000)
花生粕是花生仁经压榨和提炼花生油后的副产物。研究表明,花生粕中提取的花生分离蛋白,含有47%~55%的低变应原性蛋白和大量必需氨基酸,氨基酸组成合理,可消化率高,具有较高的营养价值[1-2]。然而,由于其不良的功能特性,如有限的溶解性、不良凝胶特性,无法满足食品加工的需求[3-4]。因此需要进行适当改性,拓展其在食品工业中的应用。pH偏移技术是一种简单有效的蛋白质方法,通过将蛋白质溶液pH调整到极端碱性或酸性条件下,使蛋白质结构展开,将pH回调至中性,使蛋白质结构重新折叠,从而改善蛋白质的功能性质[5-6]。
肌原纤维蛋白(MP)是肉品中具有重要功能的结构蛋白质群,其热诱导凝胶性能对于肉品加工品质有着重要影响[7]。在肉品加工中,常会加入部分植物蛋白,如大豆蛋白、鹰嘴豆蛋白等,提高肉品的质构和保水性能。Niu等[8]将改性大豆分离蛋白加入肌原纤维蛋白中,结果发现改性大豆分离蛋白可显著改善肌原纤维蛋白凝胶体系的凝胶强度、保水性及流变特性。杜洪振等[9]研究预热处理大豆蛋白以不同比例加入到肌原纤维蛋白中,结果发现经过处理的大豆蛋白与MP混合凝胶的凝胶硬度、弹性和持水性显著高于天然大豆蛋白与MP形成的混合凝胶。
试验从花生粕中提取花生分离蛋白,采用pH偏移法对其改性,对比研究添加改性和天然花生分离蛋白对猪肉肌原纤维蛋白凝胶质构、流变和保水等特性的影响,为花生分离蛋白在肉制品加工中的应用提供理论指导。
1 材料与方法
1.1 材料与试剂
脱脂花生粕(河南驻马店盛丰粮油有限公司);大豆油、猪肉(市售);牛血清蛋白(BSA,索莱宝公司);盐酸、氢氧化钠、硫酸铜、酒石酸钾钠、碘化钾、磷酸氢二钠、磷酸二氢钠等(均为分析纯)。
1.2 仪器与设备
pH计(DELTA 320,上海梅特勒-托利多仪器有限公司);流变仪(Discovery,美国TA仪器公司);低场核磁共振成像分析仪(NM120,上海纽迈电子科技有限公司);高速冷冻离心机(TGL-20KR,上海安亭科学仪器厂);质构分析仪(TA.XT. Plus,英国Stable Micro System公司);高速均质机(T25,德国IKA公司)。
1.3 试验方法
1.3.1 花生分离蛋白(PPI)的制备
根据Ji等[10]的方法。脱脂花生粕经粉碎干燥,按料液比1∶10(g/mL)与去离子水混合,调节至pH 9.0,磁力搅拌2 h,以4 000 r/min转速离心15 min,调节至pH 4.5,以4 000 r/min离心15 min,得到沉淀,用去离子水洗涤沉淀2次,调节至pH 7.0,透析除去盐离子,冷冻干燥后备用。凯氏定氮法测定PPI含量98.4g/100 g。
1.3.2 pH偏移处理PPI
将冷冻干燥后的PPI粉末溶解于去离子水中(质量分数15%),磁力搅拌30 min,充分混匀。用1 mol/L HCl或NaOH溶液调节PPI溶液至pH 10.0,立即将其放入40℃水浴锅中水浴加热,保持1 h后,取出立即冷却,将PPI溶液调节至pH 7.0。冷冻干燥备用。将改性后的花生分离蛋白命名为AH-PPI,天然的花生分离蛋白为N-PPI。
1.3.3 猪肉肌原纤维蛋白(MP)的提取
参考刘旺等[11]的方法。将猪里脊肉绞碎后加入4倍体积提取液(4 ℃,0.1 mol/L NaCl,10 mmol/L磷酸盐缓冲液,10 mmol/L MgCl2和1 mmol/L EGTA,pH 7.0),在10 000 r/min转速下混匀,每次20 s,匀浆3次。在5 000 r/min转速下离心15 min,弃去上清液,重复上述步骤3次。加入4倍体积0.1 mol/L NaCl溶液洗涤蛋白,以相同的离心条件离心,弃去上清液,重复3次,过3层纱布,得到纯净的猪肉肌原纤维蛋白,在4 ℃下储存,48 h内使用完毕。蛋白浓度测定方法采用双缩脲法,以牛血清蛋白作为标准蛋白。
1.3.4 改性PPI-MP混合凝胶的制备
猪肉肌原纤维蛋白的质量浓度调整为30 mg/mL,分别加入0.25%,0.50%和0.75%的改性PPI,在10 000r/min下60 s混匀,以800 r/min离心5 min,混合蛋白在恒温水浴锅中从20 ℃加热至80 ℃并保持30 min,于4℃冰箱储存,48 h内使用完毕。
1.3.5 凝胶质构特性测定
参考Chen等[12]的方法并略有修改。使用P0.5探头,测前、测中、测后速度分别为1.0,1.0和2.0 mm/s,应变40%,触发力5 g。测定后得到一条曲线,第1个峰顶点为样品破裂点,定义为样品的凝胶强度(g),重复6次。
1.3.6 凝胶保水性(WHC)的测定
精确称取6 g蛋白凝胶于10 mL离心管中,在8 000r/min速度下离心10 min,在滤纸上倒置20 min除去多余水分,记录离心前后离心管和样品质量。保水性按式(1)计算。
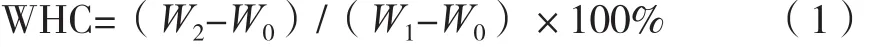
式中:W2为离心后凝胶和离心管总质量,g;W1为离心前凝胶和离心管总质量,g;W0为离心管质量,g。
1.3.7 流变特性的测定
参照Kang等[13]的方法略有改动。用40 mm平板,甲基硅油密封,间隙0.6 mm,应变为1.05%,于25~90℃线性升温,速率1 ℃/min,频率1 Hz。测定流变储能模量G’。
1.3.8 凝胶水分分布的测定
参考Han等[14]的方法,用NM120低场核磁共振成像分析仪测量混合凝胶的弛豫时间(T2)。参数设定:温度32.00±0.01 ℃;频率18 MHz;扫描16次;回声数12 000;重复时间间隔100 ms;半回波时间τ-值200 μs。
1.3.9 数据分析
采用Origin 8.5软件绘图,采用SPSS软件进行ANOVA单因素方差分析和最小显著差异法Ducan检验(p<0.05),数据结果均表示为平均值±标准差。试验除标明外,均重复测定3次。
2 结果与分析
2.1 添加花生分离蛋白对猪肉肌原纤维蛋白凝胶强度的影响
如图1所示,加入0.25%和0.50%天然花生分离蛋白(N-PPI)时,肌原纤维蛋白凝胶强度无显著变化,添加0.75% N-PPI时,肌原纤维蛋白凝胶强度显著下降(p<0.05)且降低10.24%。同时,肌原纤维蛋白凝胶强度随着N-PPI浓度升高而逐渐降低,这与Niu等[8]将大豆蛋白添加至肌原纤维蛋白凝胶强度的结果相似。
添加AH-PPI可显著提高MP的凝胶强度(p<0.05)。与MP相比,AH-PPI浓度在0.25%~0.75%时,混合凝胶的凝胶强度增加12.96%~21.07%。这可能是因为碱性pH处理导致PPI球状结构展开,埋藏在蛋白质内部的活性基团暴露,增强PPI与MP之间的分子相互作用,形成更致密的凝胶网络结构,从而增强MP的凝胶强度。
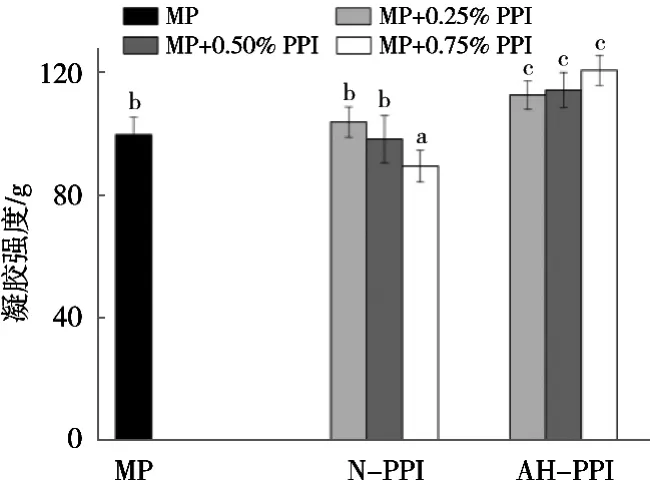
图1 添加花生分离蛋白对肌原纤维蛋白凝胶强度的影响
2.2 花生分离蛋白添加量对猪肉肌原纤维蛋白凝胶保水性的影响
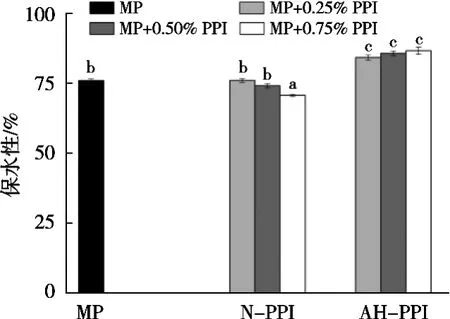
图2 添加花生分离蛋白对肌原纤维蛋白凝胶保水性的影响
如图2所示,N-PPI添加量0.25%和0.50%时,MP凝胶的保水性无显著性变化(p>0.05),添加量达到0.75%时,MP凝胶的保水性显著降低。这可能是因为N-PPI较大添加量时可能会部分破坏凝胶的网状结构,导致保水性下降。
然而,添加AH-PPI时,MP凝胶保水性显著增加(p<0.05),说明AH-PPI/MP混合凝胶形成的凝胶对水的束缚力更强。Westphalen等[15]发现WHC的增加部分可能是因为蛋白凝胶内氢键的增加。因此,可能是由于AH-PPI侧链基团的暴露促进MP和PPI分子间的相互作用,从而形成更致密的凝胶网络结构,将更多的水束缚其中,提高凝胶保水性。
2.3 添加花生分离蛋白对猪肉肌原纤维蛋白流变特性的影响
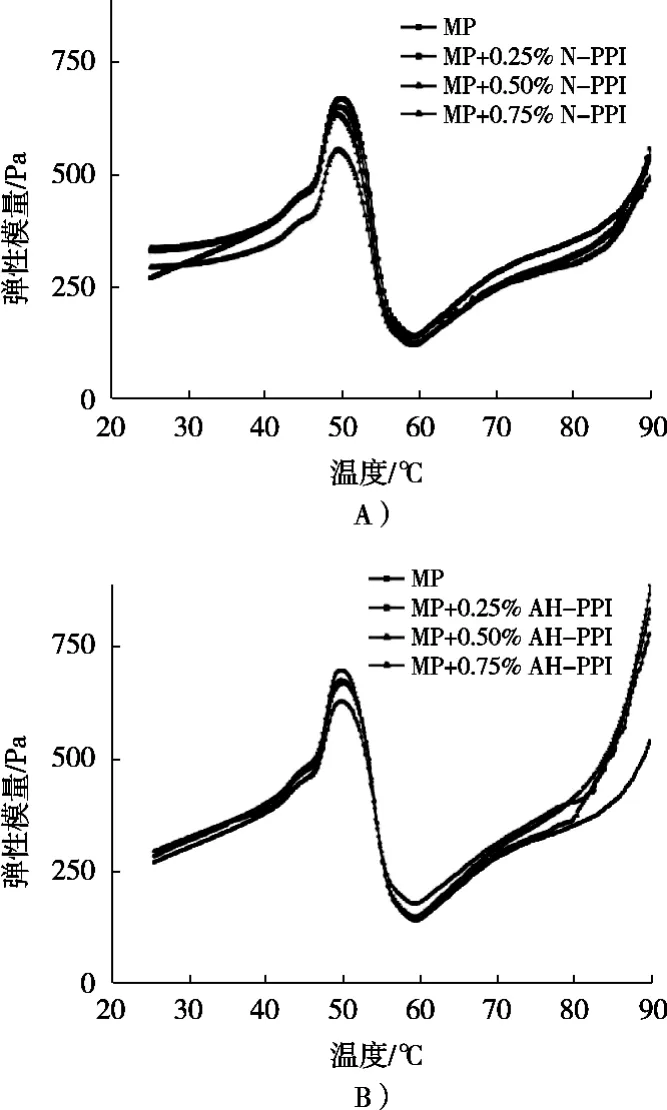
图3 添加花生分离蛋白对肌原纤维蛋白流变特性的影响
花生分离蛋白添加量对猪肉肌原纤维蛋白的流变特性储能模量G’的影响如图3所示。储能模量G’反映肌原纤维蛋白凝胶强度的大小[16-17]。图3显示花生分离蛋白添加对MP从25~90 ℃加热过程中储能模量(G’)的变化。添加PPI的MP混合凝胶G’整体趋势相同,都有4个温度范围:在25~40 ℃,G’基本保持不变;在40~50 ℃,G’迅速升高,这是弱凝胶网络开始形成阶段,此时肌球蛋白头部相互交联,形成蛋白质网络结构[18];在50~60 ℃,G’逐渐下降,这是因为肌球蛋白尾部开始变性,导致蛋白质分子重组,形成的凝胶网络结构遭到破坏[19-20],此时是凝胶减弱阶段;在60~90 ℃,G’随着温度升高而迅速升高,此时是凝胶加强阶段,说明凝胶三维网状结构的形成[21]。
如图3(A)所示,在加热过程中,添加N-PPI的G’值均低于MP对照组,并随着N-PPI添加量增加,MP凝胶体系的储能模量G’均下降,但除添加0.75%N-PPI,其他均无显著性变化,说明N-PPI与MP不发生交联反应,因此对MP的胶凝作用不明显。Ramíezsuaez等[22]报道完整的外源蛋白具有较致密的结构,可能不利于肌肉蛋白凝胶化。如图3(B)所示,添加AH-PPI的G’值均高于MP对照组,并随着AH-PPI添加量增加,MP凝胶体系的G’显著上升,说明添加AHPPI的MP凝胶的强度更好,更有利于MP凝胶网络结构形成,更有利于猪肉制品的加工品质。这一现象可能是由于AH-PPI中活性基团促进PPI与MP之间的相互作用,因此凝胶网状结构更加致密坚固。Liu等[23]报道了经过酸和热处理的大豆分离蛋白,会处于熔融球状态,暴露出更多内部的活性基团,蛋白链部分展开。这种柔性结构会有利于MP凝胶网络结构的形成。
2.4 添加花生分离蛋白对猪肉肌原纤维蛋白凝胶水分分布的影响
利用LF-NMR测定肌原纤维蛋白凝胶的水分分布,MP凝胶的T2弛豫时间一般会出现3~4个峰,每个峰代表不同的水分状态[24-26]。如图4所示,MP及混合凝胶的T2弛豫时间分布出现4个峰,T2弛豫时间峰0.1~1 ms时,代表与蛋白质大分子结合最为紧密的结合水,用T2b表示;T2弛豫时间峰1~100 ms时,代表与大分子结合程度较弱的不易流动水,用T21表示;T2弛豫时间峰100~1 000 ms时,代表是毛细管里等原因留存在凝胶结构中的中度可移动水,用T22表示;T21和T22都可称为不易流动水;1 000 ms后,代表可自由移动的自由水,用T23表示。如图4所示,所有样品均出现4个峰,说明肌原纤维蛋白凝胶中主要存在4种状态的水。由表1可知,MP凝胶体系中4个T2弛豫时间峰面积比例中,PT22数值最高,说明在MP凝胶体系中绝大部分水为中度可移动水。

图4 添加花生分离蛋白对肌原纤维蛋白凝胶水分分布的影响
从表1中看出,随着AH-PPI添加量增加,PT23自由水的峰面积百分数显著降低,而不易流动水PT21+PT22峰面积百分比显著增加,说明在热诱导形成凝胶的过程中,自由水向不易流动水移动。据报道,T2b对物理特性和WHC的影响可忽略不计,而T21和T22的峰比例之和与WHC有显著正相关[27]。这与上述WHC的结果基本一致。因此,相对于N-PPI的添加,AH-PPI可更好维持猪肉肌原纤维蛋白凝胶的保水能力。
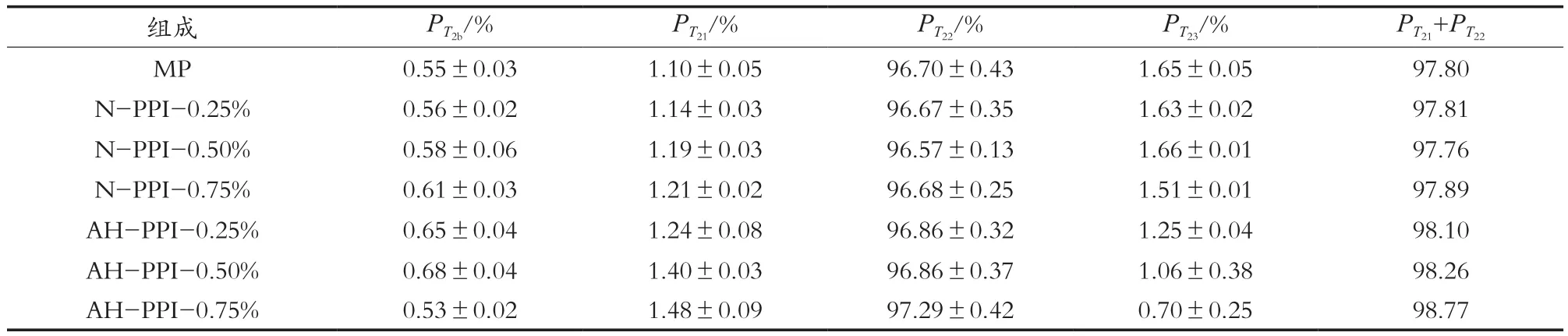
表1 添加花生分离蛋白对猪肉肌原纤维蛋白凝胶各弛豫峰峰面积百分数的影响
3 结论
添加天然花生分离蛋白不能改善猪肉肌原纤维蛋白的凝胶特性,然而添加改性花生分离蛋白(AHPPI)可有效改善猪肉MP凝胶体系的凝胶强度、保水性能和流变特性。低场核磁分析显示凝胶体系主要包含4种状态的水,且添加AH-PPI的凝胶体系不易流动水峰比例升高,T23自由水比例下降。试验表明,花生分离蛋白经pH偏移改性后,能显著改善猪肉肌原纤维蛋白的凝胶性能,为拓展其在肉制品加工中的应用提供理论指导。

