非小细胞肺癌患者血浆外泌体APE1的表达与铂类化疗敏感性相关
赵晓龙,代晓燕,毛成毅,肖华亮,王 东,戴 楠*
(陆军军医大学大坪医院 1.肿瘤科; 2.病理科,重庆 400042)
非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总数的80%~85%[1]。在中国,由于早期肺癌临床症状不明显,肺癌筛查未全面普及,大部分患者发现时已为中晚期[2]。含铂化疗是无驱动基因突变的NSCLC患者的标准治疗,然而有相当一部分患者对铂类治疗不敏感,出现耐药后迅速进展,这严重影响患者的疗效和生存[3]。
脱嘌呤脱嘧啶核酸内切酶(apurinic aprimidinic endonuclease 1, APE1)与非小细胞肺癌(non small cell lung cancer,NSCLC)的发生、发展和预后密切相关[4]。研究发现,APE1 蛋白及自身抗体存在于NSCLC 患者外周血中,NSCLC 患者血清 APE1蛋白和抗体水平明显高于健康体检者[5]。问题是缺乏分泌信号肽的典型核蛋白APE1是通过什么方式进入血液的呢?外泌体是直径在30~150 nm的小囊泡,能够包裹核酸、蛋白和脂质等生物活性物质[6]。据此推测,APE1可能存在于外泌体中,并通过外泌体分泌到血液中。为验证这种假设,本研究提取了无驱动基因突变的晚期NSCLC患者血浆外泌体,首次发现APE1存在于血浆外泌体中。对NSCLC患者铂类化疗前后的血浆外泌体APE1进行动态监测,发现血浆外泌体APE1与铂类化疗敏感性密切相关。
1 材料与方法
1.1 材料
1.1.1 研究人群:选取2017年1月至2018年1月保存于大坪医院临床生物样本库的晚期NSCLC患者72例,48例体检的正常人作为对照,用于研究NSCLC患者与正常人血浆外泌体APE1水平的比较;其中31例有对应的穿刺组织标本,用于检测组织APE1水平与血浆外泌体APE1水平的关系。收集2018年1月至2019年6月就诊大坪医院肿瘤科的晚期NSCLC患者64例,用于研究外泌体APE1与铂类治疗敏感性的关系;其中24例有化疗前后血浆样本,用于研究化疗前后APE1水平变化。根据RECIST 1.1版评价标准,将患者分为化疗应答组(CR+PR,n=22)和无应答组(SD+PD,n=42)。所有患者均明确诊断为ⅢB或Ⅳ期无驱动基因突变的NSCLC,并接受含铂双药一线化疗,未联合抗血管生成治疗。本研究经大坪医院伦理审查委员会批准(伦理审批编号:2018-113),所有患者均签署知情同意书(表1)。

表1 研究对象基本资料
1.1.2 试剂: Total Exosome Isolation Kit(Invitrogen公司);RIPA裂解液(碧云天公司);抗APE1抗体(Novus Biological公司),抗CD9、CD63、β-tubulin 抗体(Abcam公司),人APEX1酶联免疫试剂盒(武汉华美生物工程有限公司)。
1.2 方法
1.2.1 血浆外泌体的分离和鉴定:采用EDTA采血管收集静脉血5.0 mL,静置30 min,2 000 r/min离心10 min,取上层血浆,10 000×g离心20 min,取上清后采用血浆外泌体提取试剂盒,按说明书步骤提取血浆外泌体。
1.2.2 电镜(transmission electron microscope,TEM)观察外泌体及纳米示踪分析(nanoparticle tracking analysis,NTA):取外泌体样本 5 μL 滴加在铜网上,室温孵育 5 min,滴加2%的乙酸双氧铀,室温干燥20 min,采用透射电镜观察外泌体形态。取10 μL外泌体样本进行相应比例稀释,利用纳米粒度颗粒跟踪分析仪进行纳米示踪分析。
1.2.3 Western blot检测蛋白:配制SDS-PAGE胶,取10 μL外泌体蛋白进行电泳,100 V恒压条件下转膜90 min,在5%的脱脂奶粉37 ℃封闭1 h,加入一抗稀释液(APE1 1∶1 000,CD9 1∶1 000,CD63 1∶1 000,β-tubulin 1∶2 000),4 ℃孵育过夜;TBST洗涤后加入相应种属二抗(1∶5 000), 37 ℃ 孵育1 h,TBST洗涤,采用化学发光显影系统显影。
1.2.4 ELISA检测APE1蛋白:提取200 μL血浆中的外泌体,根据实验需要,将外泌体加入含或不含1% Triton X-100 的PBS溶液中充分混匀后,采用人脱嘌呤/脱嘧啶核酸内切酶1(APEX1)酶联免疫试剂盒,按说明书操作,对外泌体APE1进行定量检测。
1.2.5 免疫组化(IHC)检测APE1蛋白:取石蜡标本进行切片、脱蜡和水化后置于含pH 9.0 EDTA溶液高压锅中加热修复。流水冲洗后,用30% H2O2-methanol溶液浸泡封闭10 min。PBS冲洗3次后滴加APE1一抗,置于湿盒中,4 ℃过夜。PBS清洗3次,擦干后滴加二抗,37 ℃孵育25 min后,PBS清洗3次,滴加DAB显色,冲洗后用苏木精复染,脱水封片、评分并拍照。评分方法:根据细胞染色深浅及阳性细胞比例将APE1表达水平分为0,1,2,3,共4个等级,将评分0,1定义为低表达,评分2,3定义为高表达。
1.3 统计学分析
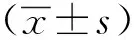
2 结果
2.1 血浆外泌体的提取与鉴定
血浆外泌体呈现椭圆形的双层膜结构,外泌体的粒径大小整体合乎标准(30~150 nm) (图1A,B)。 Western blot检测发现有外泌体特异性标志物CD63和CD9的存在 (图1C)。
2.2 外泌体中的APE1是外周血中APE1存在的主要方式
血浆外泌体中存在APE1蛋白(图2A)。ELISA检测结果显示,NSCLC患者外泌体中的APE1水平明显高于未用Triton X-100处理过的样本(P<0.0001)(图2B),提示APE1主要被包裹于外泌体的脂质膜结构内。
2.3 非小细胞肺癌患者外泌体APE1高表达
ELISA检测发现,NSCLC患者外泌体APE1水平为(658±251)pg/mL,明显高于正常人的(182±96)pg/mL(P<0.0001)(图3)。

A.TEM(80 kV);B.NTA;C.Western blot图1 NSCLC患者血浆外泌体的鉴定Fig 1 Identification of plasma exosomes in NSCLC patients
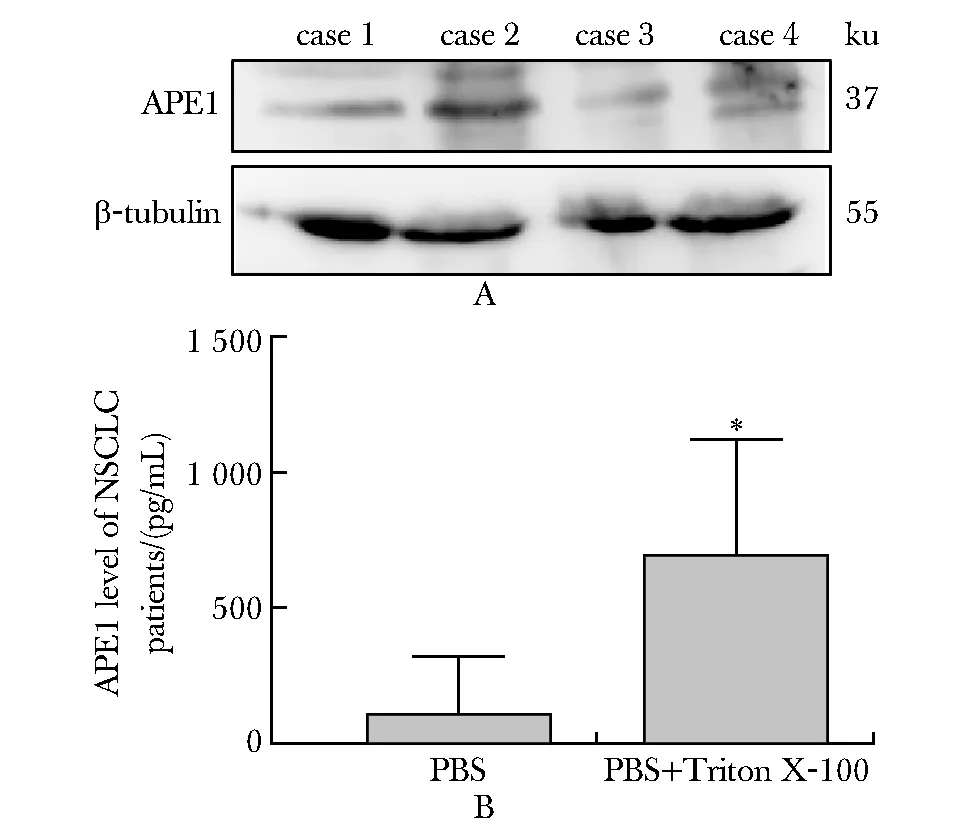
A.Western blot;B.APE1 level in exosomes;*P<0.000 1 compared with PBS group图2 血浆外泌体APE1的表达情况Fig 2 Expression of APE1 in
2.4 非小细胞肺癌组织APE1水平与血浆外泌体APE1水平成正比
肿瘤组织免疫组化染色情况图4A,评分为0或1分(低表达)患者为15例,评分2或3分(高表达)为16例。组织高表达APE1的患者,其血浆外泌体APE1水平较组织APE1低表达患者明显升高(P<0.01)(图4B)。

*P< 0.0001 compared with the control group图3 NSCLC患者与正常人血浆外泌体APE1的表达Fig 3 Expression of APE1 in NSCLC
2.5 外泌体APE1水平与铂类治疗敏感性相关
与化疗应答组相比,无应答组的外泌体APE1水平明显升高 (P<0.001)(图5A)。对比化疗前后APE1水平的改变,无应答组的外泌体APE1在化疗后明显增高(P<0.01)(图5B),而应答组APE1则无明显变化(图5C)。
3 讨论
铂类一直是晚期无驱动基因突变NSCLC患者的基础治疗药物。然而有研究表明,以铂类为基础的化疗方案有效率仅为30%~40%[7],耐药严重制约了铂类在NSCLC中的应用。铂类主要通过与DNA结合形成加合物[8]来对肿瘤细胞造成杀伤。研究发现APE1在 DNA损伤修复过程中发挥关键作用[9],APE1可能在一定程度上影响铂类治疗的疗效,肿瘤组织高表达APE1的患者中有高达83.3%的患者对顺铂化疗耐药[10]。然而,目前大部分的研究仅局限于肿瘤组织,因此研究血液中的外泌体APE1,可以拓展其临床应用价值。
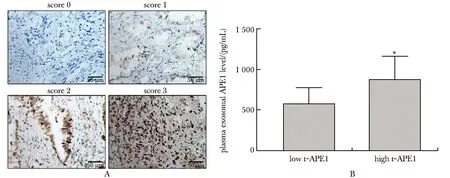
A.IHC;B.APE1 level in plasma exosomes;*P<0.01 compared with low t-APE1 group图4 肿瘤组织低表达与高表达APE1患者的血浆外泌体APE1表达情况

A.exosome APE1 level of responding **P<0.001 compared with responding group; B.exosome APE1 level during chemotherapy in non-responding patients *P<0.01 compared with pre-chemotherapy level; C.exosome APE1 level during chemotherapy in responding
外泌体是直径在30~150 nm脂质膜囊泡,内含核酸、脂质、蛋白质等生物活性物质[6]。本研究通过免疫学方法发现APE1确实存在于血浆外泌体中。在检测过程中,如使用非离子型去垢剂Triton处理外泌体,APE1的检出浓度将迅速提高。究其原因,极有可能是由于外泌体脂质膜结构被破坏,导致其中包裹的APE1更容易被检出。实际上,血液样本中APE1的检出浓度很低[11],因此检测血浆外泌体APE1的表达水平,可以极大的提高检测灵敏度,提高其在临床上的应用价值。
本研究发现,NSCLC患者血浆外泌体APE1的表达与组织APE1表达水平成正比,这提示外泌体APE1也可作为判断NSCLC疗效的指标。进一步研究发现,铂类化疗疗效不佳的患者中,外泌体APE1的表达明显升高;同时,化疗后外泌体APE1升高的患者,其疗效比外泌体APE1无明显变化(甚至降低)的患者更差。其机制可能为该部分患者,除自身肿瘤组织APE1表达增高外,APE1还会以外泌体的形式释放,并通过外泌体来传递耐药性。这也说明血浆外泌体APE1同样能作为铂类化疗疗效的指标,且更有意义:血液检测属无创操作,可用于动态监测评估疗效和调整用药方案,更好的服务于临床实际。
综上所述,APE1在NSCLC患者血浆外泌体中高表达,其表达高低与患者铂类治疗疗效有关。然而,为了更加全面的对NSCLC外泌体APE1进行研究,未来还需要对APE1进入外泌体中的机制以及非癌性肺部病变患者血浆的外泌体APE1表达情况进行探索;此外,由于APE1是具有DNA损伤修复功能和氧化还原调控功能的双功能基因,可通过多种途径导致化疗耐药[12],因此外泌体APE1导致铂类耐药的机制也有待一步研究。

