细胞周期蛋白D1、基质金属蛋白酶 -9 在胃癌组织中的表达水平及与幽门螺杆菌感染的相关性
陆 莲
(江南大学附属医院病理科,江苏无锡 214062)
胃癌是一种恶性肿瘤,其发病初期无明显症状,随着病情发展进入晚期,患者将表现出消化道出血症状,如疼痛、呕血、黑便等,如提示疼痛持续放射性向腰背部展开,则表示肿瘤已经侵犯胰腺被膜。肿瘤细胞的增殖、凋亡在恶性肿瘤的发展中起着重要的作用,细胞周期蛋白D1(cyclinD1)具有促进细胞增殖由G1 期转变为S 期的作用,cyclinD1 蛋白表达的增加主要见于恶性肿瘤的发生过程;基质金属蛋白酶 -9(MMP-9)是可对肿瘤细胞侵袭的组织学屏障起破坏作用[1]。幽门螺杆菌(Hp)感染可引发机体发生免疫反应与炎症损伤,进而促进胃癌的发生[2]。相关研究表明,Hp 阳性患者胃癌发生率明显高于Hp 阴性患者,且清除Hp 可以有效降低胃癌的发生率[3]。因此,本研究旨在探讨cyclinD1、MMP-9 在Hp 感染性胃癌组织中的表达水平与Hp 感染的相关性,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2018 年1 月至2021 年1月江南大学附属医院收治的100 例胃癌患者的临床资料,其中男性63 例,女性37 例;年龄48~73 岁,平均(58.37±7.42)岁;TNM 临床分期[4]:Ⅰ+Ⅱ期40 例,Ⅲ+Ⅳ期60 例;分化程度[5]:中高分化65 例,低分化35 例。纳入标准:符合《胃癌》[6]中的相关诊断标准者;且经病理学检查确诊者;临床资料完整者;近期未接受抗Hp 治疗者等。排除标准:伴有其他恶性肿瘤者;严重肝、肾等功能损伤者;胃癌复发者等。本研究已通过院内医学伦理委员会批准。
1.2 检测方法
1.2.1 Hp 感染 ①改良Giemsa 染色:取所有患者的病理组织,做石蜡切片,进行脱蜡水化,在2%的Giemsa染色剂中染色30 min,取出后立即用自来水进行冲洗脱水透明处理,采用油镜观察Hp 感染情况(×1 000),其中改良Giemsa 染色Hp 菌体呈紫红色。②14C 呼气实验:检测前采集所有患者空腹6 h,且口服14C 尿素胶囊后的100 mL 呼出气体,进行14C 红外线能谱仪检测;14C 呼气实验Hp 阳性超基准值(DOB) >2.5。Hp 感染判定标准:改良Giemsa 染色、C-14 呼气实验均为阳性。
1.2.2 cyclinD1、MMP-9 表达 取所有患者的病理组织,做石蜡切片,进行脱蜡水化,每隔3 min 用磷酸盐缓冲液(PBS)冲洗1 次,共冲洗3 次。使用微波将pH值 = 6.0 的柠檬酸盐缓冲液加热至沸腾,取出组织切片后,放置于耐高温塑料切片架上,静置自然泠却10 min后,每隔3 min 用蒸馏水和PBS 反复冲洗各2 次。滴1 滴3%的过氧化氢于切片上,静置10 min 后,PBS再次冲洗3 次。cyclinD1 阳性染色主要定位于细胞核,阳性着色为棕黄色;MMP-9 阳性染色主要定位于细胞质,阳性着色为棕黄色。综合判定标准为染色强度和阳性细胞数占肿瘤细胞的百分比,染色强度:棕褐色(3分)、棕黄色(2 分)、淡黄色(1 分)、无染色(0 分);阳性细胞数在肿瘤细胞中占比:>50%(3 分)、25%~49%(2分)、5%~24%(1 分)、<5%(0 分),最后计算两项结果的乘积,乘积 > 2 则判定为阳性[7]。
1.3 观察指标 ①Hp 感染、cyclinD1、MMP-9 表达与胃癌患者临床病理特征的关系,其中临床病理特征包括胃癌TNM 临床分期、分化程度。②胃癌患者Hp 感染与cyclinD1、MMP-9 表达的相关性。
1.4 统计学分析 采用SPSS 21.0 统计软件分析数据,计数资料采用[ 例(%)]表示,组间比较采用χ2检验,采用Pearson相关系数法进行相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 Hp 感染与胃癌患者临床病理特征的关系 100 例胃癌患者中Hp 感染70 例,非Hp 感染30 例;非Hp 感染胃癌患者TNM 临床分期为Ⅰ期和Ⅱ期、低分化程度占比均低于Hp 感染患者,但经比较,差异无统计学意义(P>0.05),见表1。
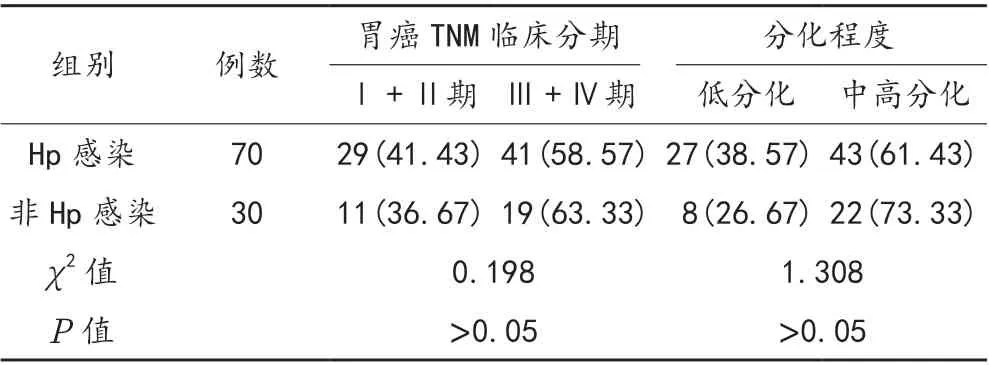
表1 Hp 感染与胃癌患者临床病理特征的关系比较[ 例(%)]
2.2 cyclinD1 阳性表达与胃癌患者临床病理特征的关系 免疫组化染色结果显示,cyclinD1 表达阳性57例,阴性43 例;cyclinD1 阴性患者中胃癌TNM 临床分期为Ⅲ+Ⅳ期、中高分化程度患者占比均显著低于cyclinD1 阳性患者,差异均有统计学意义(P<0.05),见表2。
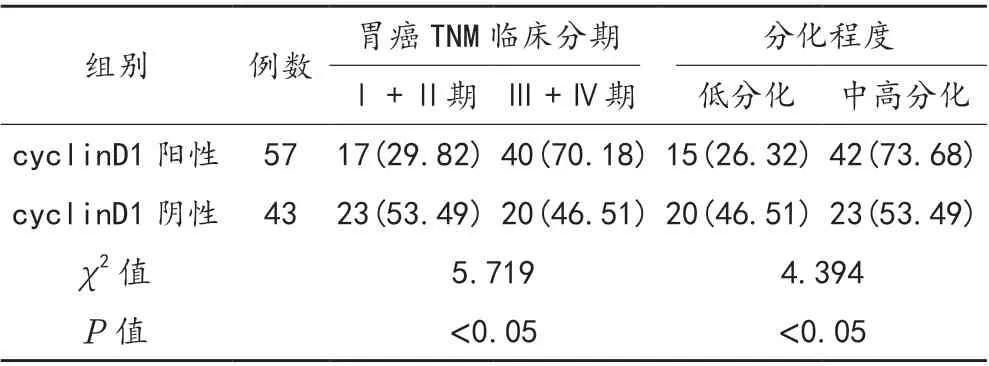
表2 cyclinD1 表达与胃癌患者临床病理特征的关系比较[ 例(%)]
2.3 MMP-9 阳性表达与胃癌患者临床病理特征的关系 免疫组化染色结果显示,MMP-9 表达阳性80 例,阴性20例;MMP-9 阴性患者中胃癌TNM 临床分期为Ⅲ+Ⅳ期、中高分化程度患者占比均显著低于MMP-9 阳性患者,差异均有统计学意义(均P<0.05),见表3。

表3 MMP-9 表达与胃癌患者临床病理特征的关系比较[ 例(%)]
2.4 胃癌患者Hp 感染与cyclinD1、MMP-9 表达的相关性 与Hp 感染患者比,非Hp 感染患者中胃癌组织cyclinD1 阳性、MMP-9 阳性患者占比均显著降低,差异均有统计学意义(均P<0.05),见表4。
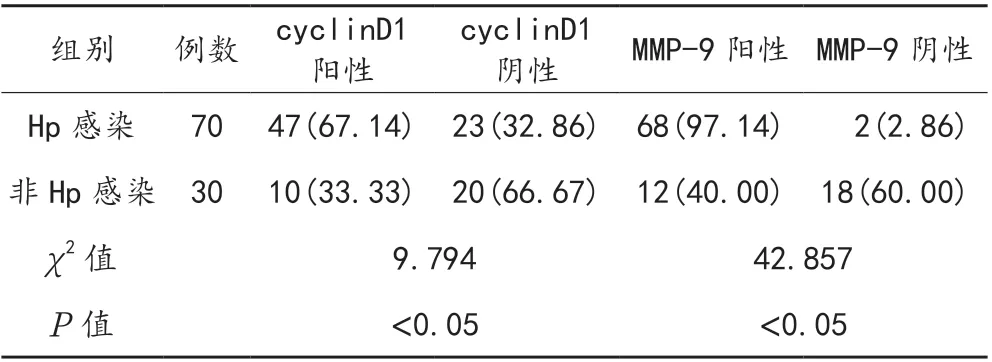
表4 胃癌患者Hp 感染与cyclinD1、MMP-9 的表达水平的关系比较[ 例(%)]
2.5 胃癌患者Hp 感染与cyclinD1、MMP-9 表达的相关性 胃癌患者中,Hp 感染与cyclinD1 阳性、MMP-9阳性表达均呈正相关,差异均有统计学意义(r= 0.462、0.571,均P<0.05)。
3 讨论
胃癌是由饮食、感染等致病因素导致机体胃黏膜上皮细胞发生癌变的一种疾病。手术切除仍是目前临床治疗胃癌的主要方法,也是治疗胃癌的主要手段,由于大多数胃癌患者被发现时已经属于晚期肿瘤,所以仍有大部分患者在术后存在复发和转移的情况[8]。
Hp 是一种革兰氏阴性菌,在大气或绝对厌氧环境下不能生长,常寄居在胃黏膜内壁,但胃黏膜上皮脱落较快,所以寄居在胃黏膜上的Hp 会随着胃黏膜上皮的更新而脱落,脱落后顺着肠道从粪便排到体外,使食物和水源受到污染。但也有一部分Hp 不会随着肠道排出,会经过胃 - 食管反流进入口腔,通过唾液传播感染,Hp 可加重胃黏膜的炎症反应,促进肠内消化和萎缩,进而加快癌变[9]。cyclinD1 含量随细胞周期而变化,不同细胞周期时细胞内cyclinD1 的含量和活性的高峰均不同[10]。MMP-9 是一种依赖性较强的金属酶,可有效降解细胞外基质。本研究结果,非Hp 感染患者胃癌TNM 临床分期为Ⅰ期和Ⅱ期、低分化程度占比均低于Hp 感染患者;cyclinD1 阴性患者与MMP-9 阴性患者中胃癌分期Ⅲ+Ⅳ期、中高分化程度占比均显著低于cyclinD1 阳性与MMP-9 阳性患者,表明在胃癌中,Hp 感染可明显促进cyclinD1、MMP-9 的表达,进而加快病情进展。MMP-9 是一类蛋白水解酶,在正常的生理过程与疾病过程中参与细胞外基质的分解,破坏机体抑制肿瘤细胞转移的天然屏障,进而促进肿瘤细胞转移。胃癌患者中Hp 自身及其代谢产物在一定程度上具有致癌活性,其可促进cyclinD1 基因的激活、扩增等,同时其可通过对胃黏膜的炎症损伤进行促进MMP-9 的表达,从而加重患者临床症状[11]。本研究中,非HP 感染患者中cyclinD1 阳性、MMP-9 阳性患者均显著低于Hp 感染患者;Hp 感染与cyclinD1阳性、MMP-9 阳性均呈正相关,表明胃癌Hp 感染与cyclinD1、MMP-9 表达水平的关系密切。
综上,Hp 感染性胃癌中,cyclinD1、MMP-9 表达水平较高,且其与Hp 感染均呈正相关,可为胃癌患者预后分析提供参考,但本研究样本量较少,且为单中心研究,因此后期可增加样本后进行多中心、多方面深入研究,以便提高研究结果的准确度。

