溶剂热法制备钛酸钾粉体研究
吴海江,龚晨,朱家乐,何世杰,刘志勇,黄宇翔,刘毅
(1.邵阳学院 机械与能源工程学院,湖南 邵阳,422000;2.邵阳学院 高效动力系统智能制造湖南省重点实验室,湖南 邵阳,422000)
钛酸钾是一种性质独特的无机材料,而四钛酸钾(K2Ti4O9)具有薄片层状结构且板层间活跃的K+有助于电子转移和有机分子的吸收,表现出优良的化学性质和实用价值,可用作光催化剂[1-2]、无机离子交换剂[3]、补强剂[4]、钛酸钾晶须[5-7],同时,在钛基钠、锂离子电池领域也有着广泛的应用[8-11]。
传统的钛酸钾制备方式有煅烧法、熔盐法、助溶剂法、水热法和KDC(kneading drying calcination)法等方式[12-16]。熔盐法和煅烧法需要在1 000 ℃的温度下进行,过程能耗大,而且所得的钛酸钾杂质多,有纤维状副产物产生,难提纯;助溶剂法则存在分离目标物和助溶剂困难且助溶剂成本高的缺点;KDC法是烧结法的改良方法,生成钛酸钾结晶性能好,但是实验工艺较为复杂;传统的水热法需要在高温高压条件下进行,对设备要求高,所需操作复杂;溶剂热法是水热法的一种改良方法,它和水热法的不同之处在于实验反应的溶剂是有机溶液而不是水溶液,与传统制备方法相比,该方法在常压低温的条件下进行,具有制备工艺简单、设备原料成本低廉和对环境友好等优点。
MAX相是一类新型层状化合物,兼具金属材料(优异的导电导热性、机械加工性能、抗热震性能等)和陶瓷材料(高模量、耐高温、抗氧化性、耐腐蚀性等)的优良性能[17-18]。Ti2AlN是MAX相化合物中的一种,具有层状结构,且在水热反应过程中N会转化为氮氧化物,用纯碱对废气进行收集,减少其他杂质的产生,这不失为快速、高效的制备K2Ti4O9提供了一种新的途径。本文选择Ti2AlN在KOH液相中反应,采用简单低廉和环保型的溶剂热法制备K2Ti4O9粉体,探讨反应温度、通气速率和反应时间对产物结构、成分和微观形貌的影响,并用盐酸对产物进行除杂处理以获得高纯度的K2Ti4O9。
1 试验
1.1 试验原料
试验所用Ti2AlN(纯度大于99%,平均粒径约为48 μm),购于莱州凯烯陶瓷材料有限公司;分析纯氢氧化钾(KOH)、分析纯一缩二乙二醇(C4H10O3)和优级纯盐酸(HCl)均由国药集团化学试剂有限公司制造。
1.2 试验方法
在三颈瓶中加入一缩二乙二醇,称5.6 g KOH后配置成2 mol/L KOH,将溶液升温至90 ℃加速KOH溶解,降温至室温后加入0.5 g Ti2AlN,连接氩气阀门,装置冷凝管,边通氩气边以300~500 r/min速率搅拌10 min,使Ti2AlN在溶液中充分分散,之后升温至180~210 ℃反应3~7 h,反应完成后自然降至室温,然后取出用去离子水在3 500 r/min的转速下离心洗涤,除去上层清液,保留下方沉淀,重复洗涤5~6次后将底部沉淀于真空干燥箱中55 ℃下干燥6 h,干燥结束后,取出样品,于真空中保留备用。
1.3 结构与微观形貌表征
采用X’Pert Powder型X射线衍射仪对样品进行物相分析,激发光源为Cu/Kα,扫描速度为4(°)/min,在2θ角5°~50°范围内对样品进行扫描,将测试得出的图谱与其标准图谱数据相比较,以此来确定样品中是否存在物相。通过Nova Nano SEM 450型场发射扫描电子显微镜及其附带的能谱仪对K2Ti4O9粉体的微观形貌进行观察和成分分析。
2 结果与讨论
2.1 反应温度对产物的影响
图1所示为不同反应温度下制备的K2Ti4O9粉体XRD图谱。从图1中可以看出:4组试样主峰均为Ti2AlN原料,且峰强度较大,基本没有被刻蚀反应掉;当温度在180 ℃时,衍射图谱显示原料基本没有反应;随着温度升高,从200 ℃开始,Ti2AlN峰强度开始有所降低,并且在25°附近有少量氧化物Ti3O5的产生。MASAKI等[14]研究了钛金属粉末在Ti-KOH-H2O体系水热合成钛酸钾实验中,温度变化是影响其晶态变化的重要因素,证明升高温度有助于反应的进行。对比标准图谱(PDF#32-0861)发现在(200)峰处有K2Ti4O9的产生,为此,选定实验反应温度控制在200~210 ℃。
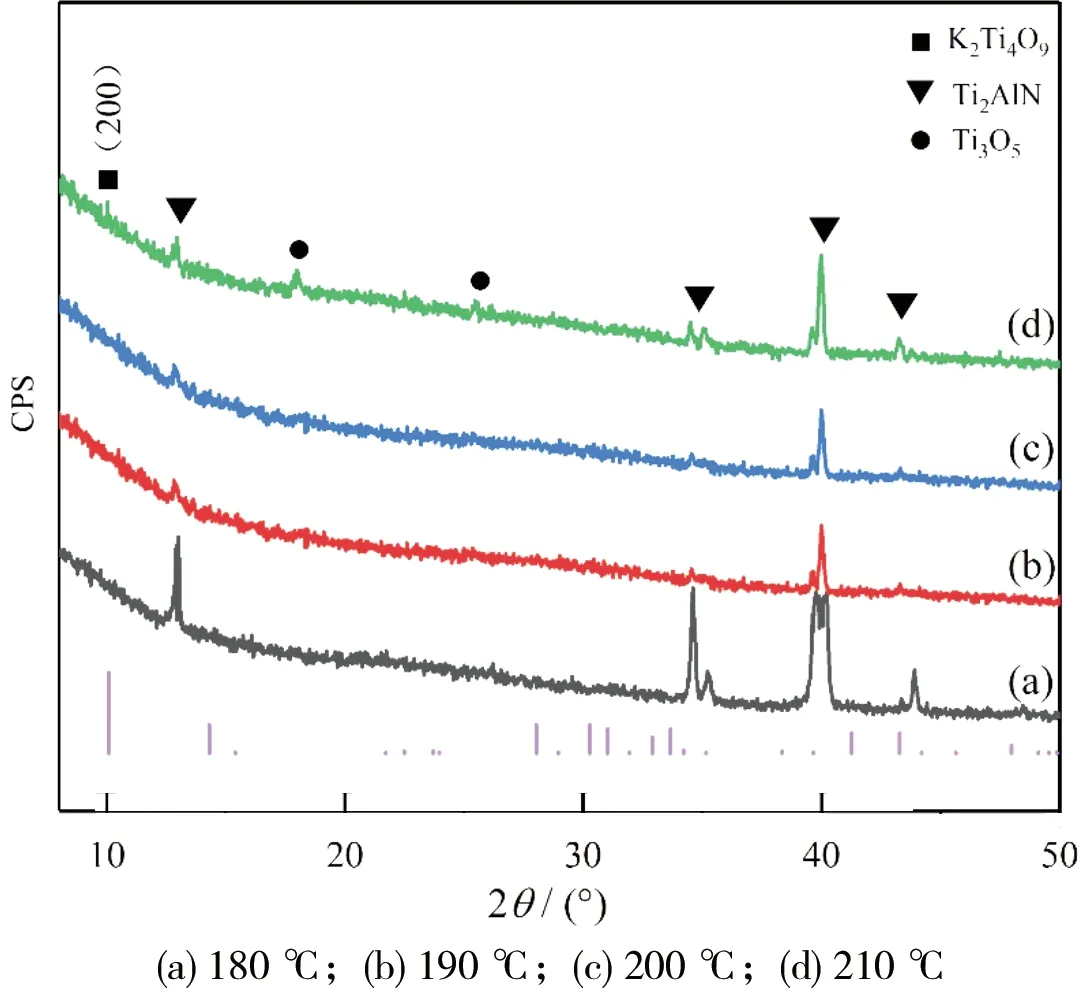
图1 不同反应温度下制备的K2Ti4O9粉体XRD图谱
2.2 通气速率对产物的影响
图2所示为不同通气速率下制备的K2Ti4O9粉体XRD图谱。从图2可见:当通气速率控制在2 L/min时,衍射曲线(a)只剩下Ti2AlN原料的主峰且强度较低,说明较低的通气速率使得反应并不完全,Ti2AlN虽然产生了反应,但是并没有转化K2Ti4O9;进一步提升通气速率,当通气速率提升至3 L/min时,衍射曲线(b)有少量K2Ti4O9生成,但Ti2AlN的主峰仍然较强,表明大部分Ti2AlN并未反应;降低通气速率至2.5 L/min,从衍射曲线(c)可以看出K2Ti4O9的(200),(110)和(310)峰处都比较明显,并且有较大的半峰宽,表明获得的K2Ti4O9为纳米粉体,同时,Ti2AlN在39°附近主峰强度降低,可判断其基本反应完全,后续进行提纯处理即可获得高纯度的K2Ti4O9。
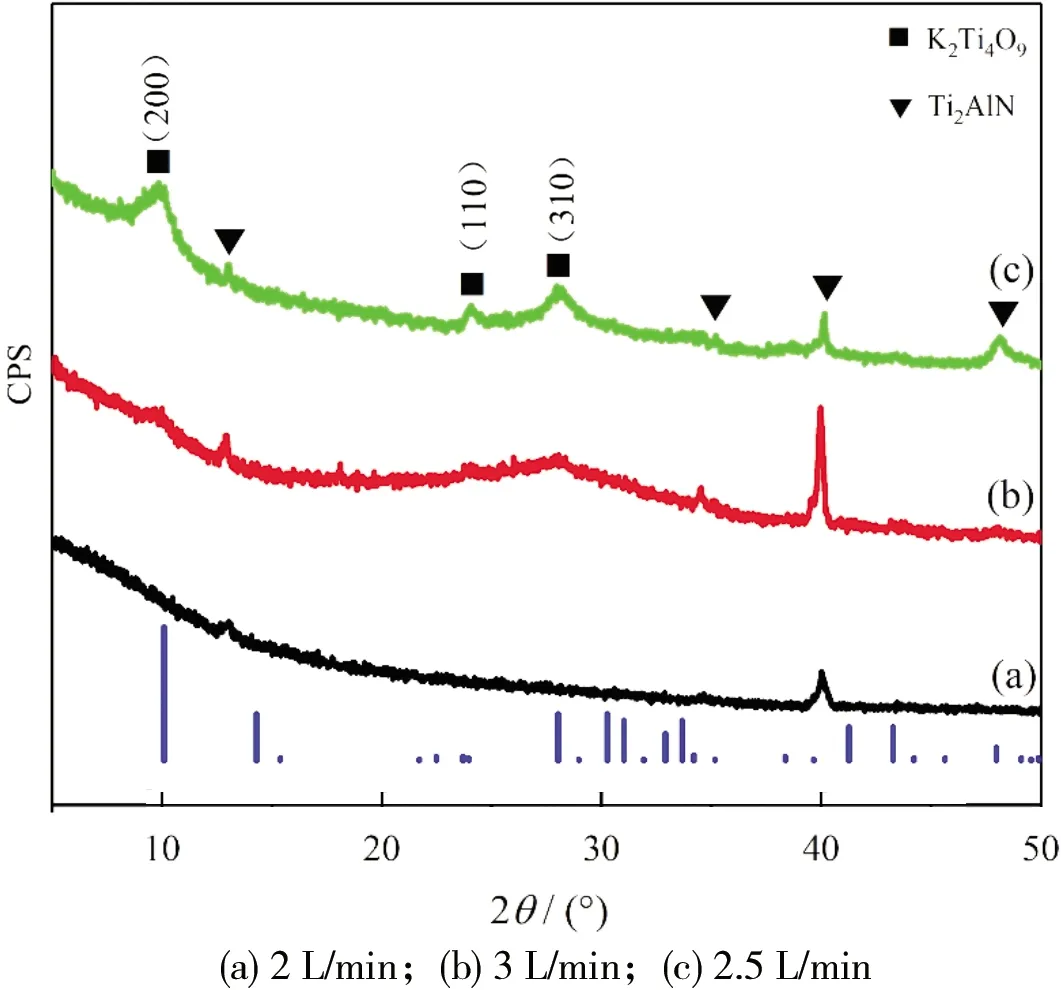
图2 不同通气速率下制备的K2Ti4O9粉体XRD图谱
2.3 反应时间对产物的影响
图3所示为不同反应时间下制备的K2Ti4O9粉体XRD图谱。在确定反应温度和通气速率最适宜的条件后,进一步探究反应时间对制备产物的影响,通过与K2Ti4O9标准PDF卡片(PDF#32-0861)对比,曲线(a)显示在(200)峰处有K2Ti4O9生成,显然,较少的反应时间使得原料Ti2AlN反应并不完全,其与Ti2AlN原料衍射峰显示的基本一致;延长反应时间至7 h后,从曲线(c)可以看出,原料已经过度刻蚀,且产生大量钛的氧化物[19];降低反应时间至5 h后,(200),(110)和(310)峰都出现了明显的K2Ti4O9衍射峰,这与K2Ti4O9标准PDF卡片(PDF#32-0861)显示的一致。
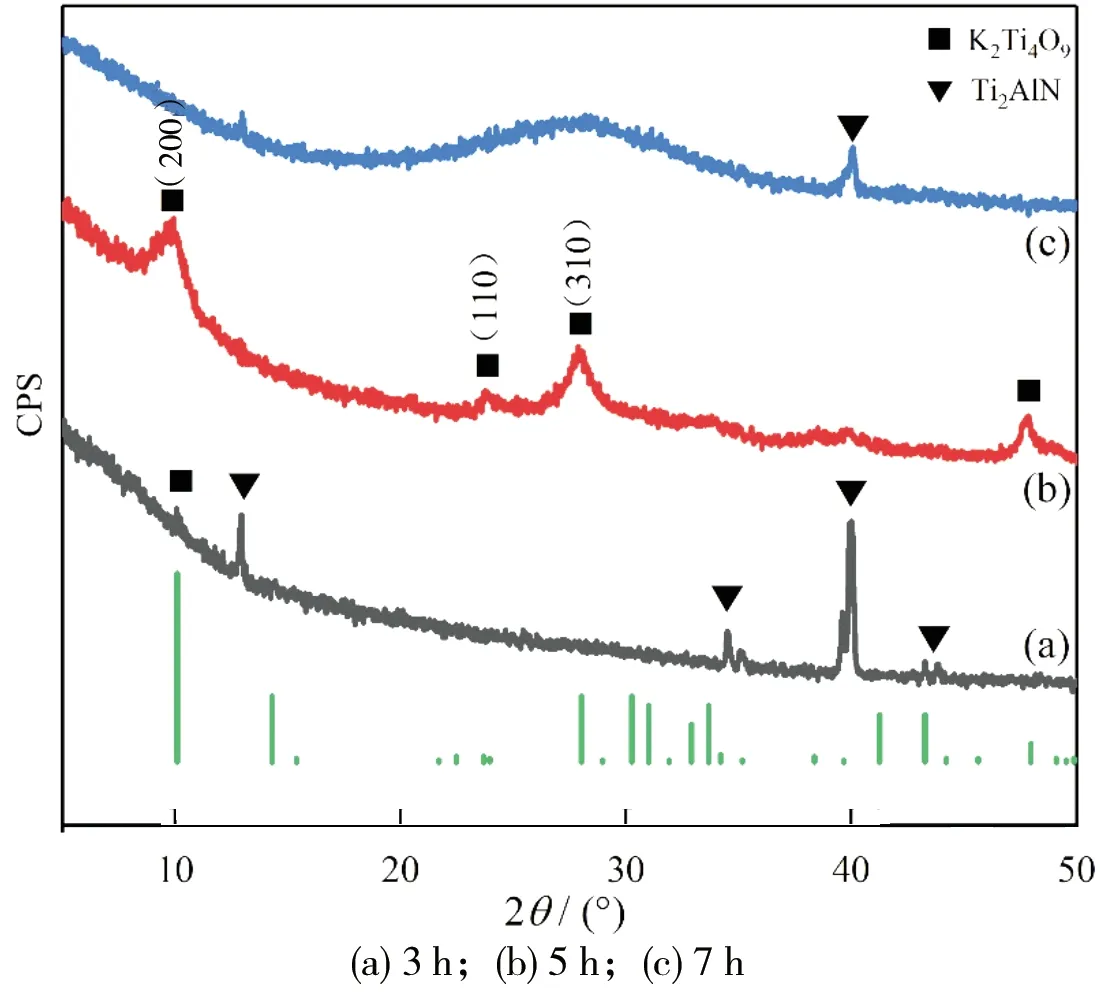
图3 不同反应时间下制备的K2Ti4O9粉体XRD图谱
2.4 K2Ti4O9粉体的微观形貌与结构表征
图4所示为最佳试验反应条件下制备的K2Ti4O9粉体的SEM图,从图4中A可以观察到K2Ti4O9单片结构呈瓣状,各单片排列成簇呈现层状、花状形貌,直径为0.3~0.5 μm,并且各瓣状物之间层次分明,分散性好,尺寸相对较均匀。B处一些板块状的形貌是Ti2AlN没有反应完全所致,在C处则能观察到一些呈现球状纳米氧化铝杂质。对C处使用EDS进行定性半定量分析以确定组成成分,结果见图5。从图5可以看到C处主要含有碳、铝、钾、钛和氧5种元素,其中碳元素原子百分比为28.5%,这主要是反应过程中一缩二乙二醇碳化所导致的,铝、钾、钛和氧元素的原子百分比分别为1.14%,1.67%,3.05%和65.64%,K与Ti的原子个数比接近1∶2,这进一步证明生成了K2Ti4O9。

图4 K2Ti4O9粉体SEM形貌

图5 K2Ti4O9粉体EDS图
针对产生的少量纳米氧化铝进行除杂处理,根据多次实验,最后用0.1 mol/L的盐酸与之反应,然后离心干燥后进行XRD和SEM表征测试。图6所示为最优试验条件制备的K2Ti4O9粉体经盐酸除杂前后XRD衍射图谱,从图6(a)和(b)可以看出,衍射曲线(b)在18°,31°和38°附近的纳米氧化铝的峰形已经完全消失,证明盐酸除杂效果良好。图7所示为K2Ti4O9盐酸除杂后SEM图,可以观测到图4对应C处的颗粒状氧化铝基本反应完全,这与图6中XRD的分析结果相符,而且从A处可以观测到K2Ti4O9层状、花状形貌得以保持。
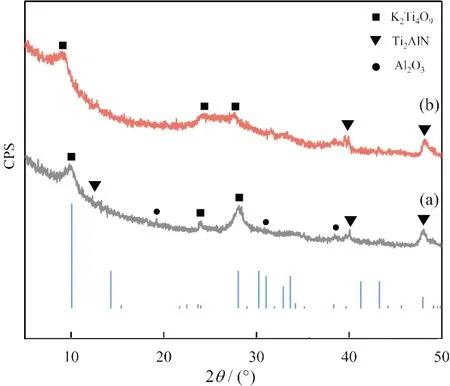
图6 盐酸除杂前(a)后(b)K2Ti4O9粉体XRD图谱

图7 盐酸除杂后K2Ti4O9粉体SEM图
3 结论
1)采用溶剂热法成功制备了K2Ti4O9粉体,该实验在常压低温条件下进行,具有制备工艺简单、设备原料成本低和对环境友好等优点。
2)试验最佳反应条件为:反应温度控制在200~210 ℃,反应时间为5 h,通气速率为2.5 L/min。
3)通过0.1 mol/L盐酸对最佳试验反应条件制备的K2Ti4O9粉体进行除杂处理,获得了高纯度的K2Ti4O9粉体。
4)通过MAX相化合物Ti2AlN制备的K2Ti4O9直径为0.3~0.5 μm,具有独特的花状、分层形貌。

