磁场反转下趋磁细菌运动学特性分析及与鞭毛的关系
陈海涛 陈林杰 石宏开 杜军渭 宋 涛,3
磁场反转下趋磁细菌运动学特性分析及与鞭毛的关系
陈海涛1,2,3陈林杰1石宏开1,2,3杜军渭1宋 涛1,3
(1. 中国科学院电工研究所生物电磁学北京市重点实验室 北京 100190 2. 中国科学院大学 北京 100049 3. 中-法趋磁多细胞生物进化与发育联合实验室 北京 100190)
趋磁细菌是能沿磁场方向运动的特殊细菌,其趋磁机制尚存争议。该文通过建立趋磁细菌的运动学方程,仿真分析了反转磁场作用下趋磁细菌AMB-1的运动学特性。结合AMB-1动力学建模分析和实验结果表明,野生型菌株的运动特性与带有鞭毛的长椭球体基本吻合,而敲除类甲基受体趋化蛋白Amb0994后菌株对磁场反转的响应要比野生型菌株快,类似于没有鞭毛的长椭球体,这种行为差异可能是菌株鞭毛功能改变的结果;推测Amb0994可以通过控制鞭毛参与细菌对磁力矩变化的响应。这项研究有助于更深入地了解趋磁细菌的趋磁机制,并为探讨细菌鞭毛功能提供理论分析方法。
磁场 趋磁细菌 动力学模型 鞭毛
0 引言
趋磁细菌是一类能沿磁场方向运动的特殊细菌,其体内含有呈链状排列的单磁畴颗粒——磁小体,使细菌可以感应磁场方向。磁小体一般为平均直径约50nm的单磁畴颗粒,主要由磁铁矿(Fe3O4)或胶黄铁矿(Fe3S4)组成,是感受外界磁场的良好“磁受体”[1-2]。一般认为,趋磁性是趋磁细菌在磁场作用下被动排列而沿磁力线运动的结果,而后发现的趋磁——趋氧性机制进一步解释了这一被动趋磁模型[1]。但也有学者认为,趋磁细菌趋磁性是体内存在的一类磁感受因子主动感受磁力矩而响应磁场作出运动的结果[3-4]。
细菌主动感应环境因子的过程一般涉及一系列信号转导,并依赖跨膜化学受体,即甲基受体趋化蛋白(Methyl-accepting Chemotaxis Proteins, MCPs)。微生物可通过MCPs将外界环境信号传递到组氨酸激酶CheA,进而利用被磷酸化的CheY蛋白与鞭毛蛋白相互作用而影响鞭毛旋转的方向[5-7]。有趣的是,在趋磁细菌中存在许多MCPs的编码基因[8]。已有研究发现,趋磁细菌AMB-1中Amb0994属于特殊的类MCP蛋白,位于细胞的两端,且可以与磁小体链的骨架蛋白MamK相互作用。进一步的过表达Amb0994实验暗示,Amb0994可通过与MamK的C末端相互作用而将信号传递给鞭毛马达系统,从而主动响应磁场运动[7]。此外,Zhu Xuejun等[9]构建了Δ-双基因敲除突变菌株,这一研究暗示Amb0994-0995参与感应磁力矩并主动调节鞭毛旋转方向,使菌株运动方向与外部磁场一致。遗憾的是,目前尚缺乏Amb0994主动响应磁场变化的直接证据。此外,研究显示,趋磁细菌在低磁场下需要更多时间来响应磁场的变化[7, 10],可能不只与使之偏转的磁力矩相关,但目前尚无相关的研究。本文希望通过对反转磁场下趋磁细菌运动学特性的分析来研究其响应磁场的机制。
当施加恒定磁场时,趋磁细菌会顺着磁场方向运动,此时磁场方向突然反转,趋磁细菌的运动会呈现近似U形的转弯轨迹,称为“U型”运动,利用“U型”运动可以获得趋磁细菌磁矩等信息[11-12]。本文将利用野生型和突变的趋磁细菌在磁场反转时运动特性的仿真和实验结果比较,来分析细菌鞭毛在趋磁运动中的作用。
1 趋磁细菌运动学方程
1.1 菌株和培养
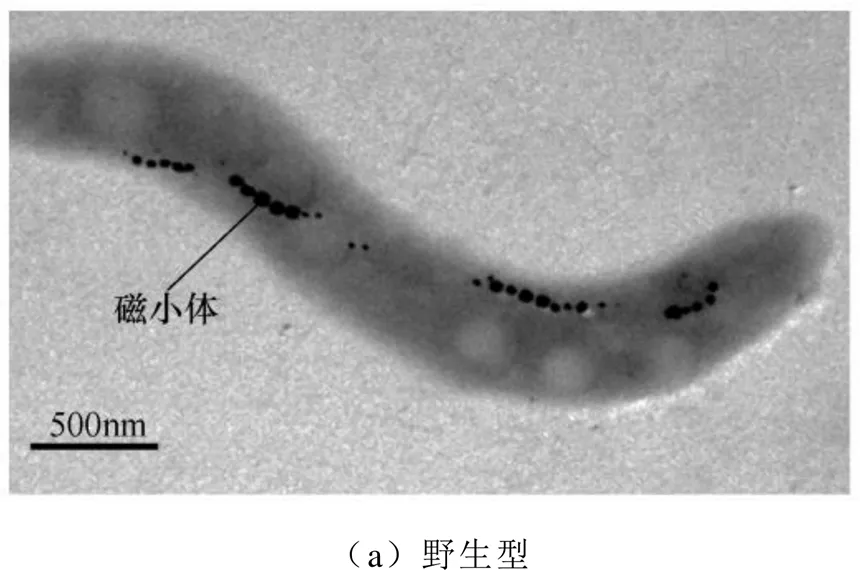
使用趋磁细菌()AMB-1(ATCC700264)为研究对象,AMB-1中Amb0994敲除突变菌株(Δ)按文献[13]获得,Amb0994为类甲基受体趋化蛋白,为类甲基受体趋化蛋白的基因。透射电子显微镜照片如图1所示,其中,磁小体为单磁畴的Fe3O4颗粒。本文的趋磁细菌接种在生长培养基中,并置于28~30℃恒温培养箱中培养[14-15]。当细菌生长至平台期后,分析其在磁场反转下的运动学特性。
1.2 运动学方程
根据趋磁细菌的形态特征,可以利用长椭球体模拟AMB-1细菌。趋磁细菌在磁场下偏转的动力学特性可以用偏微分方程描述为
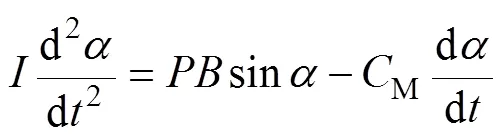
式中,为AMB-1的转动惯量;为一个AMB-1的磁矩;为施加的磁场(反转前后大小不变);为反转前磁场方向与磁矩之间的夹角;为时间。对于AMB-1,磁矩的方向与菌体的长轴相同;M为阻力矩的系数。
其他变量定义为
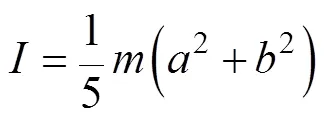
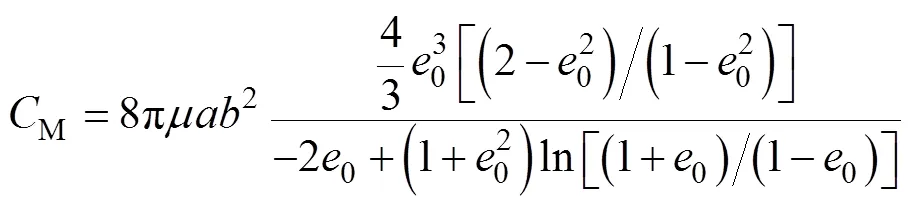

D. M. S. Esquivel和H. G. P. L. De Barros在文献[11]中推导了圆球相关的公式,用类似的方法,本文对椭球情形加以推导。对于微米尺度的趋磁细菌,处于低雷诺数的液体环境下,可以忽略惯性力的影响,趋磁细菌的运动主要受限于液体黏滞阻力。因此有
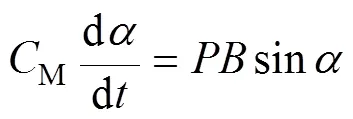
即
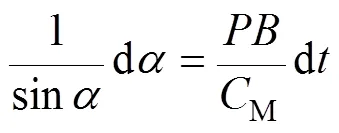
两边积分,有
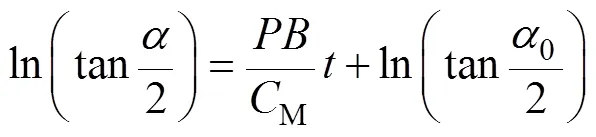
根据顺磁学经典理论,在反转前的磁场下,趋磁细菌的平均方位为
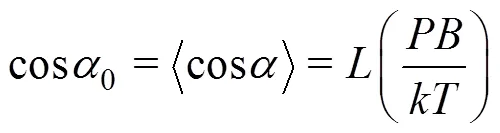
其中
由此根据式(6),可以获得表达式为
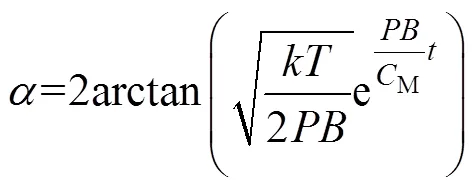
同样根据式(6)也可获得反转时间为
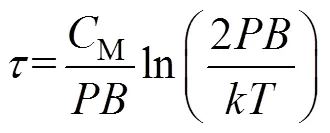
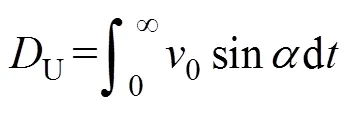

使用式(8),计算了反转磁场下AMB-1的运动轨迹。如果细菌没有鞭毛,或者不考虑鞭毛运动和流体中阻力的影响,则可以使用式(3)定义的M。如果细菌具有鞭毛,并且考虑到鞭毛的影响,则应使用改良的M。根据B. Steinberger等[16]的研究,当将AMB-1建模为含有单鞭毛的长椭球体,即在椭球体主体一端连有固定导线,其M应乘以4.67(±0.47)。在工作中,考虑到鞭毛运动和流体阻力的影响,基于式(3)将M乘以5作为含有鞭毛时的阻力矩系数。另外,文献[15]的研究也表明,近似形状的长椭球体与长圆柱体等的阻力矩系数基本相同,因此本文将趋磁细菌等效为长椭球体,虽然与其实际形状略有差异,但不影响仿真结果的有效性。
2 趋磁细菌运动特性的仿真分析
根据AMB-1细菌的尺寸,将其等效为3.5mm(长轴直径)×0.52mm(短轴直径)×0.52mm(短轴直径)的长椭球体。其磁矩可由=求得,其中,为细菌中磁小体数目,为单个磁小体的体积,为磁小体(Fe3O4)的磁化强度,=480kA/m。
根据上述建立的趋磁细菌运动学模型,利用Matlab软件仿真分析了趋磁细菌在有或无鞭毛情况下的运动学特征。培养基的黏度系数参照海水的黏度系数取为1.08×10-3Pa∙s。根据所建模型进行仿真计算,AMB-1的运动轨迹与实验吻合,菌体会随反转磁场变化做“U型”运动。同时,也仿真分析了不同磁感应强度和磁小体数目下趋磁细菌“U型”运动转弯直径和时间的变化曲线。如图2所示,无论在有鞭毛或无鞭毛情况下,仿真“U型”运动的转弯直径和时间都随外加磁感应强度或磁小体数目的增加而减小,且在低磁感应强度和少的磁小体数目下迅速下降,当达到一定值后变化趋于平缓。在同一磁感应强度或同等磁小体数目下,考虑鞭毛的仿真结果的转弯直径和时间大于无鞭毛的仿真结果,且两者的差异随磁感应强度或磁小体数目的增加逐渐变小。

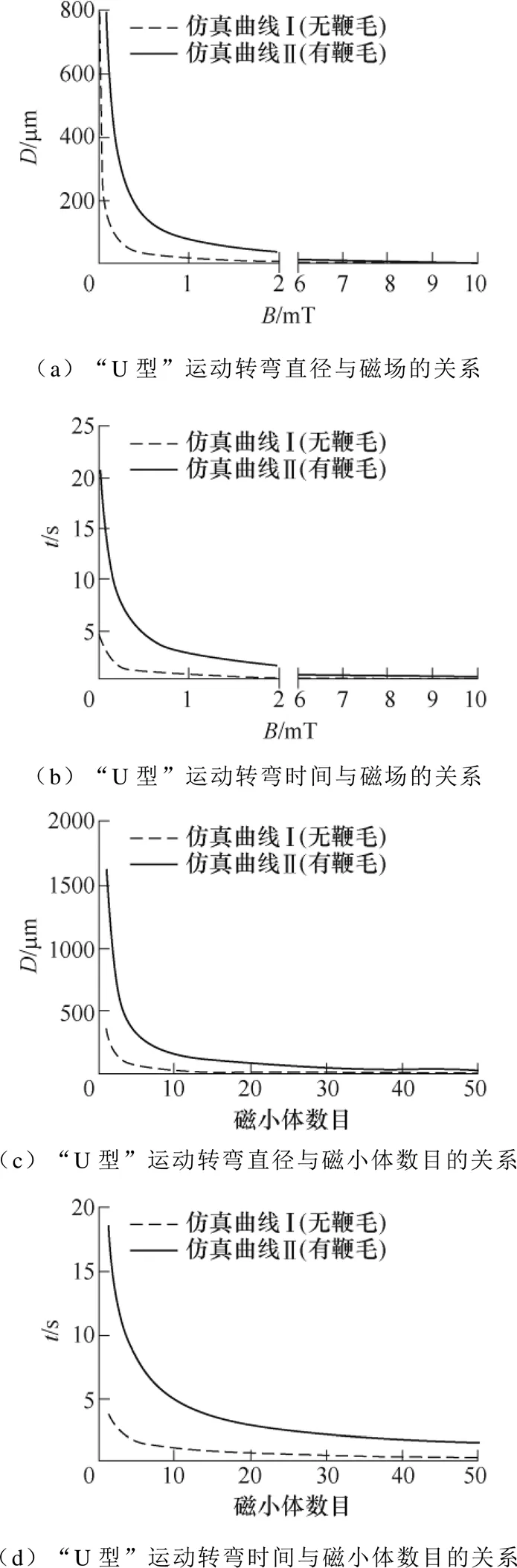
图2 仿真“U型”运动的转弯直径和时间随磁感应强度或磁小体数目的变化
表1 AMB-1的“U型”运动特性的参数计算
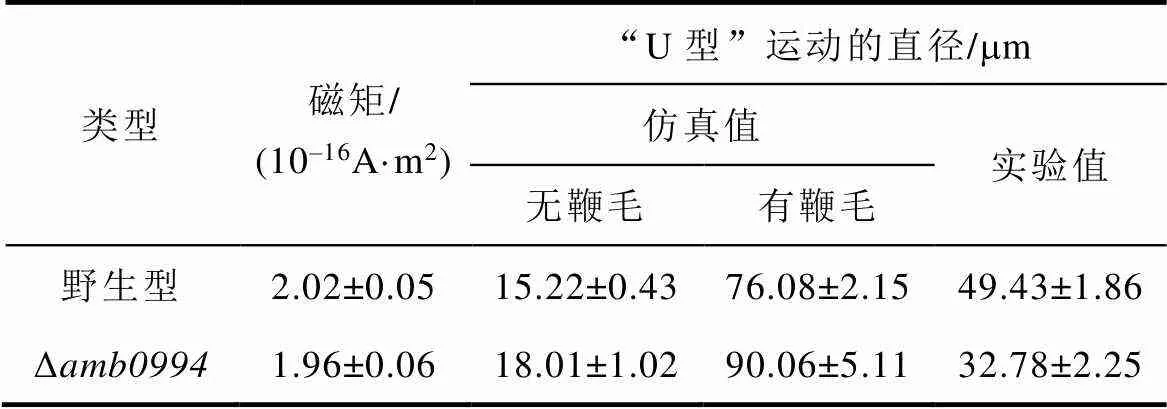
Tab.1 Parameter calculation of “U-turn” movement in AMB-1 cells
结合使用长椭球体仿真在有或无鞭毛情况下模拟细菌在磁场中的运动轨迹,分析有无鞭毛菌株的磁响应行为差异。为了在无鞭毛影响的情况下对AMB-1细菌进行建模,本文按照1.2节中的描述,根据式(3)计算了阻力矩系数M。为了在数学模拟中考虑有鞭毛对AMB-1细菌进行建模,定义有鞭毛情况下运动的阻力矩系数为5M,因而建立了AMB-1运动行为仿真模型。有无鞭毛的“U型”运动轨迹的角度变化仿真结果如图3所示。
3 趋磁细菌运动轨迹的测量与结果分析
3.1 实验装置
本文利用配备有自制电磁线圈的显微镜来分析AMB-1的运动特性[18]。显微设备:采用具有长工作距离镜头的正置显微镜BX53(Olympus,日本),搭载含有高灵敏度sCMOS芯片的Neo sCMOS相机,以实现显微运动实时拍摄。外磁场调控系统:恒定磁场曝露系统由4组矩形线圈和相应的恒流电源组成,每组线圈中两个子线圈的边长约为290~470mm,间距约为300mm;其中,两组线圈分别产生沿轴正方向和负方向的磁场,另两组线圈分别产生沿轴正方向和负方向的磁场[18]。通过调节4组线圈电流大小,这一装置能够在线圈中心40mm× 30mm的平面区域产生0~1.5mT强度可调、水平面方向可调的恒定磁场,均匀性优于2.5%,从而有效控制细菌的运动。
3.2 “U型”运动的测量方法
将4mL菌液滴入载玻片上,盖上盖玻片后,采用上述自制实验装置在1mT均匀磁场(反转前后磁场大小一致)下以33f/s的速度记录菌体的“U型”运动状态。使用ImageJ图像分析软件的MTrackJ插件检测细菌运动的速度和“U型”运动的直径[19-22],共统计约300条“U型”运动轨迹。同时,分析了运动时菌体与磁场间的,以反映磁矩与磁场方向的角度变化曲线。由于AMB-1的磁矩方向与菌体的长轴相同,因此可以通过瞬时速度矢量和磁场线之间的角度来测量。在轨迹中分析了约30个细菌。
3.3 结果与分析
为了研究趋磁行为的机理,通过仿真和实验结果对比,分析了1mT下Δ突变菌株和野生型对照组“U型”运动的转弯直径的差异。实验结果显示,野生型和突变菌株的磁矩无显著差异(>0.05,见表1)。相比野生型对照组,Δ的“U型”轨迹直径更接近无鞭毛的仿真结果,而野生型的“U型”轨迹直径更接近有鞭毛的仿真结果(见表1)。这些结果表明,突变菌株在磁场反转下可以更快地实现“U型”运动。
为了理解上述行为差异,进一步结合仿真和实验分析了突变和野生型菌株的“U型”运动轨迹时的变化。图3为野生型对照组和Δ突变菌株在磁场反转时的变化轨迹。为了比较这些曲线,假定90°的是同时发生的,实验结果表明,对比野生型对照组(见图3a中黑色实线),突变菌株(见图3b中黑色实线)的斜率要抖而尖锐,时间更短。说明突变菌株对磁场的反应要快。仿真结果显示,对比有鞭毛的模拟结果,无鞭毛的模拟曲线(见图3中黑色点画线)时间更短,斜率更陡。这暗示鞭毛的运动受磁响应行为的影响。结合仿真和实验结果分析,由图3b可知,在无鞭毛效应的情况下,Δ的实验结果更接近仿真曲线Ⅰ,而在有鞭毛效应时,对照野生型的实验曲线更吻合仿真的有鞭毛曲线Ⅱ,如图3a所示。由此推测,可能存在一个信号,当施加反向磁场时,该信号会被传递到鞭毛马达蛋白以调节鞭毛和菌体的运动模式,该信号间接地关联了基因和鞭毛的运动。
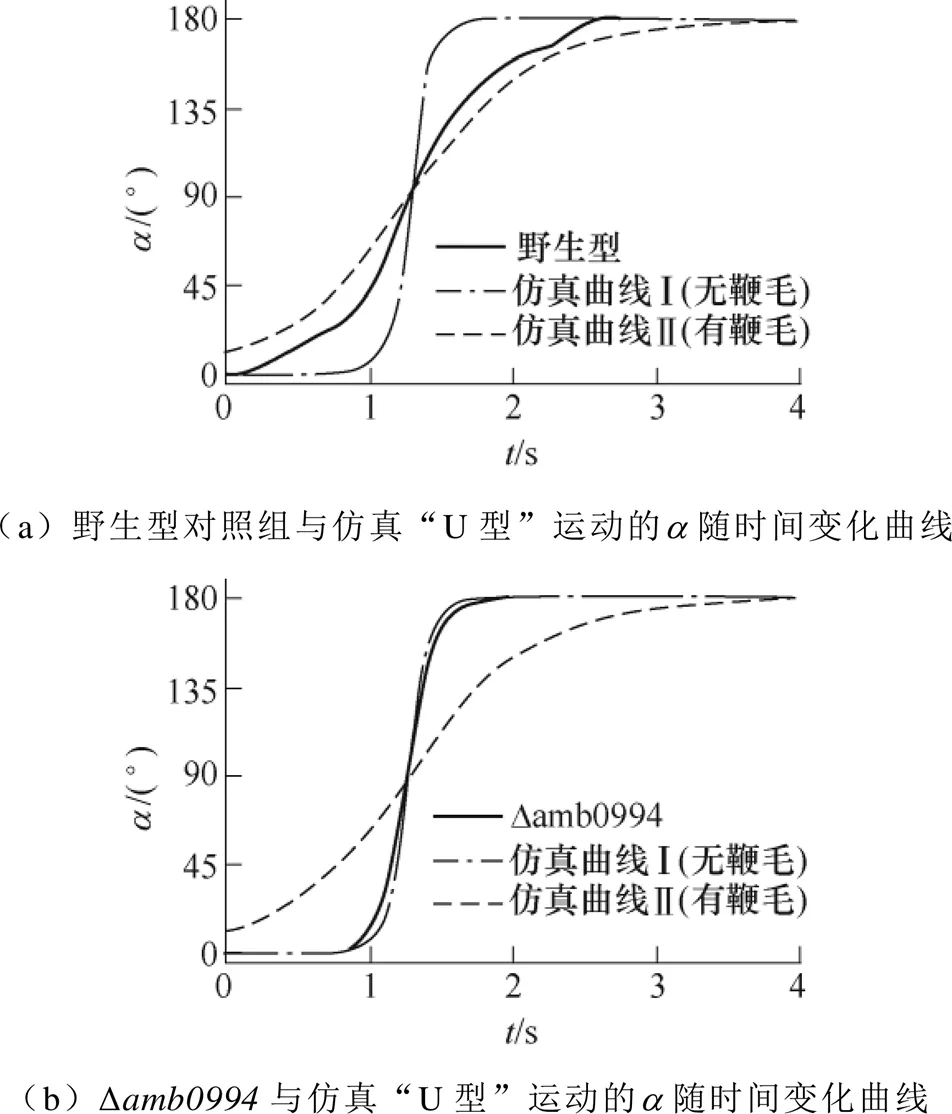
图3 野生型对照组和Δamb0994突变菌株在磁场反转时a 的变化轨迹
根据D. M. S. Esquivel和H. G. P. L. De Barros的分析,反向磁场下趋磁细菌“U型”转弯的直径应与它们的运动速度成正比,而“U型”转弯的时间与它们的运动速度无关[11]。然而,实验结果表明,与对照组相比,突变菌株的反应速度更快,并且其“U型”转弯的直径小于野生型对照组。通过对AMB-1仿真模型的分析,可以认为,突变菌株响应反向磁场的“U型”转弯轨迹的直径较小的原因与鞭毛的影响有关。“U型”运动时菌体与鞭毛连接变化的模拟如图4所示。对于野生型AMB-1,菌体与鞭毛之间的完美连接会导致细菌在流体中具有更高的阻力,Amb0994可能会调控鞭毛的旋转速度,以适应环境或磁场干扰,如图4a所示。对于突变体,缺少Amb0994可能会影响鞭毛与菌体之间的连接,不能调节鞭毛马达的旋转而保持在适当速度,如图4b所示。当细菌的磁小体链与磁场线有一定夹角时,会产生磁力矩;类MCP Amb0994通过与MamK相互作用可以感应磁力矩,并将信号传输至鞭毛马达[7]。结果暗示,Amb0994可能通过控制鞭毛与菌体的连接方式参与细菌对磁力矩变化的响应。细菌在低磁感应强度下仍能保持活跃的运动能力,但是它们需要更多时间来响应磁场的变化[7,10]。这种现象进一步解释了为什么含Amb0994的细菌可以主动感应外部磁场以协调其运动,而不是完全被动地定向。另一研究显示,当将AMB-1细菌施加于局部磁场梯度时,它们会突然发生运动反转,这一结果暗示其不仅可以感应磁场而向磁场方向运动,还可以响应磁场梯度的变化。研究者推测,这一响应磁场变化的信号可能通过Amb0994与MamK的相互作用,从而传递信号来影响菌体的运动状态[23]。因此,结合理论和实验分析,可以进一步证实以下假设:Amb0994可认为是主动磁传感器,将磁信号传输到鞭毛系统以控制鞭毛的运动。但是,菌体和鞭毛之间对磁场变化作出反应的运动协调性尚不清楚。
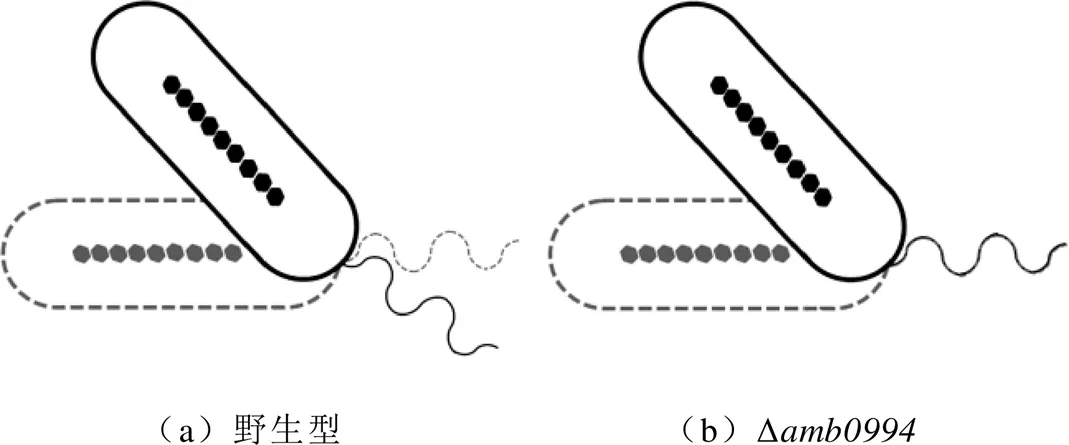
图4 “U型”运动时菌体与鞭毛连接变化的模拟
4 结论
本文通过建立的趋磁细菌运动学方程,仿真分析了趋磁细菌AMB-1在磁场方向反转情况下的运动轨迹,并与野生型和突变菌株在磁场反转时运动特性的实验结果进行比较。在磁小体合成能力不变的情况下,突变菌株对磁场突然反转的响应更接近于仿真的无鞭毛椭球体,而野生型菌株的结果更接近于有鞭毛的椭球体。这表明Amb0994的缺失使得菌体与鞭毛的连接发生了变化,或者菌体鞭毛随菌体变化调整姿态的能力变弱,而野生型在Amb0994的作用下主动感受磁力矩影响鞭毛的运动状态而响应磁场变化。因而,本研究对趋磁细菌运动特征的分析不仅有利于深入研究趋磁机理,也为揭示鞭毛的驱动机制提供仿真模型。
[1] Frankel R B, Bazylinski D A. Magnetosomes and magneto-aerotaxis[J]. Contributions to Microbiology, 2009, 16: 182-193.
[2] Chen Haitao, Li Jinhua, Xing Xiang, et al. Unexpected diversity of magnetococci in intertidal sediments of Xiaoshi island in the north yellow sea[J]. Journal of Nano-Materials, 2015, 16(1): 1-11.
[3] Greenberg M, Canter K, Mahler I, et al. Observation of magnetoreceptive behavior in a multicellular magnetotactic prokaryote in higher than geomagnetic fields[J]. Biophysical Journal, 2005, 88(2): 1496- 1499.
[4] Pan Yongxin, Lin Wei, Li Jinhua, et al. Reduced efficiency of magnetotaxis in magnetotactic coccoid bacteria in higher than geomagnetic fields[J]. Biophysical Journal, 2009, 97(4): 986-991.
[5] Sourjik V. Receptor clustering and signal processing in E coli chemotaxis[J]. Trends in Microbiology, 2004, 12(12): 569-576.
[6] Falke J J, Hazelbauer G L. Transmembrane signaling in bacterial chemoreceptors[J]. Trends in Biochemical Sciences, 2001, 26(4): 257-265.
[7] Philippe N, Wu Long-Fei. An MCP-like protein interacts with the MamK cytoskeleton and is involved in magnetotaxis inAMB-1[J]. Journal of Molecular Biology, 2010, 400(3): 309-322.
[8] Fukuda Y, Okamura Y, Takeyama H, et al. Dynamic analysis of a genomic island insp. strain AMB-1 reveals how magnetosome synthesis developed[J]. Febs Letters, 2006, 580(3): 801-812.
[9] Zhu Xuejun, Ge Xin, Li Ning, et al. Angle sensing in magnetotaxis ofAMB-1[J]. Integrative Biology, 2014, 6(7): 706- 713.
[10] Lefèvre C T, Song Tao, Yonnet J P, et al. Characteri- zation of bacterial magnetotactic behaviors by using a magnetospectrophotometry assay[J]. Applied and Environmental Microbiology, 2009, 75(12): 3835- 3841.
[11] Esquivel D M S, De Barros H G P L. Motion of magnetotactic microorganisms[J]. Journal of Experi- mental Biology, 1986, 121(1): 153-163.
[12] 陈昌友, 宋涛, 杨岑玉, 等. 趋磁细菌动力学分析及细菌机器人的构建[J]. 机器人, 2015, 37(5): 588- 593.
Chen Changyou, Song Tao, Yang Cenyu, et al. Dynamic analysis of magnetotactic bacteria and construction of bacterial microrobot[J]. Robot, 2015, 37(5): 588-593.
[13] Chen Haitao, Zhang Shengda, Chen Linjie, et al. Efficient genome editing ofAMB-1 by CRISPR-Case9 system for analyzing magnetotactic behavior[J]. Frontiers in Microbiology, 2018, 9: 1569.
[14] Yang Chendong, Takeyama H, Tanaka T, et al. Effects of growth medium composition, iron sources and atmospheric oxygen concentrations on pro- duction of luciferase-bacterial magnetic particle complex by a recombinantAMB-1[J]. Enzyme and Microbial Technology, 2001, 29(1): 13-19.
[15] Matsunaga T, Sakaguchi T, Tadokoro F. Magnetite formation by a magnetic bacterium capable of growing aerobically[J]. Applied Microbiology and Biotechnology, 1991, 35(5): 651-655.
[16] Steinberger B, Petersen N, Petermann H, et al. Movement of magnetic bacteria in time-varying magnetic-fields[J]. Journal of Fluid Mechanics, 1994, 273(1): 189-211.
[17] Zhao Luze, Wu Dan, Wu Long-Fei, et al. A simple and accurate method for quantification of magnetosomes in magnetotactic bacteria by common spectrophotometer[J]. Journal of Biochemical and Biophysical Methods, 2007, 70(3): 377-383.
[18] 王馨, 魏树峰, 陈昌友, 等. 用于磁性微机器人的外磁场调控系统设计与研制[J]. 电工电能新技术, 2016, 35(2): 75-80.
Wang Xin, Wei Shufeng, Chen Changyou, et al. Design and fabrication of external magnetic field controlled system for magnetic micro-robots[J]. Advanced Technology of Electrical Engineering and Energy, 2016, 35(2): 75-80.
[19] Zhang Shengda, Petersen N, Zhang Weijia, et al. Swimming behaviour and magnetotaxis function of the marine bacterium strain MO-1[J]. Environmental Microbiology Reports, 2014, 6(1): 14-20.
[20] Zhang Weijia, Zhang Shengda, Wu Long-Fei. Measurement of free-swimming motility and magnetotactic behavior of magnetococcus massalia strain MO-1[J]. Methods in Molecular Biology (Clifton, N J), 2017, 1593: 305-320.
[21] Murat D, Herisse M, Espinosa L, et al. Opposite and coordinated rotation of amphitrichous flagella governs oriented swimming and reversals in a magnetotactic spirillum[J]. Journal of Bacteriology, 2015, 197(20): 3275-3282.
[22] Meijering E, Dzyubachyk O, Smal I. Imaging and spectroscopic analysis of living cells: optical and spectroscopic techniques[M]. San Diego: Elsevier Academic Press Inc, 2012: 183-200.
[23] Gonzalez L M, Ruder W C, Mitchell A P, et al. Sudden motility reversal indicates sensing of magnetic field gradients inAMB-1 strain[J]. ISME Journal, 2015, 9(6): 1399- 1409.
Kinematic Characteristics Analysis of Magnetotactic Bacteria under Magnetic Field Reversal and Its Relationship with Flagella
1,2,311,2,311,3
(1. Beijing Key Laboratory of Bioelectromagnetism Institute of Electrical Engineering Chinese Academy of Sciences Beijing 100190 China 2. University of Chinese Academy of Sciences Beijing 100049 China 3. France-China International Laboratory of Evolution and Development of Magnetotactic Multicellular Organisms Beijing 100190 China)
Magnetotactic bacteria are special bacteria that can move in the direction of a magnetic field, but their magnetotactic mechanism is still controversial. In this paper, by establishing the kinematic equation of magnetotactic bacteria, the kinematic characteristics ofAMB-1 under the action of reversal magnetic field were analyzed. Combined with the AMB-1 dynamic modeling analysis and experimental results, it is shown that the motility characteristics of the wild-type strain are basically consistent with the prolate ellipsoid with flagella, the response of methyl-accepting chemotaxis like Amb0994 protein deleted mutant strain to abrupt reversals of magnetic field is faster than that of the wild-type strain, similar to an ellipsoid without flagella. This behavior difference may be caused by changes in flagella function. It is indicated that, Amb0994 can participate in the cellular response to magnetic torque changes by controlling flagella. This paper helps to understand the magnetotaxis mechanism in magnetotactic bacteria and provides a theoretical analysis method for exploring the function of bacterial flagella.
Magnetic field, magnetotactic bacteria, dynamic model, flagella
TM153
10.19595/j.cnki.1000-6753.tces.201280
国家自然科学基金重点资助项目(51937011)。
2020-09-24
2020-09-27
陈海涛 女,1988年生,博士研究生,研究方向为生物电磁技术。E-mail: chenhaitao@mail.iee.ac.cn
宋 涛 男,1968年生,研究员,博士生导师,研究方向为生物电磁技术、永磁技术及应用。E-mail: songtao@mail.iee.ac.cn(通信作者)
(编辑 崔文静)

