紫草素对肾透明细胞癌抗凋亡作用与机制研究
沃奇军 项 飞 张大宏
肾细胞癌是起源于肾实质泌尿小管上皮系统的恶性肿瘤,又称肾腺癌,占肾恶性肿瘤的80%~90%,是泌尿系统最常见恶性肿瘤之一[1-2]。肾细胞癌的发病机制至今尚不明确,而放化疗药物在临床使用过程中均不敏感,导致患者整体生存率无法提高[3]。肿瘤细胞的抗凋亡是放化疗药物不敏感的重要因素,肿瘤细胞的凋亡分为多种,而在肾细胞癌中,抗失巢凋亡是肾细胞癌转移过程中的关键因素[4-5]。近年研究表明,许多中药在抗肿瘤治疗中发挥重要作用[6-7]。此前研究发现,紫草提取物紫草素在多种肿瘤中具有显著的抗肿瘤作用[8-17]。本研究探究紫草素对肾细胞癌凋亡和抗失巢凋亡的可能作用及机制。
1 实验材料
1.1 细胞株 786-O [786-0]人肾细胞腺癌细胞(2019 年新引进)由中国科学院干细胞库提供。培养于10%FBS 的DMEM 培养基中,取对数生长期细胞进行后续实验。
1.2 中 药 紫草素(批号5156421)购自成都曼斯特生物科技有限公司。将紫草素利用PBS 溶解成1mg/mL 储液于-80℃保存。低剂量组设置为1μg/mL,中剂量组设置为2μg/mL,高剂量组设置为4μg/mL。对照组加入相应体积的PBS。
1.3 试 剂 CCK8 细胞活力检测试剂盒(批号265189)购自北京索莱宝科技有限公司;软琼脂(批号87183)购自北京擎科新业生物技术有限公司;poly-HEMA(批号2316a)购自西格玛奥德里奇(上海)贸易有限公司;PI-Annexin V 凋亡检测试剂盒(批号237236)购自赛默飞世尔科技(中国)有限公司;局部粘着斑激酶(FAK,批号454683)、磷酸化局部粘着斑激酶(p-FAK,批号252454)、蛋白激酶B(Akt,批号54861)、磷酸化蛋白激酶B(p-Akt,批号564684)、Src 蛋白(Src,批号2487)、磷酸化Src 蛋白(p-Src,批号483452)、糖原合酶激酶3β(GSK3b,批号68a326)、磷酸化糖原合酶激酶3β(p-GSK3b,批号65821)单抗均购自CST,actin 作为内参。
2 实验方法
2.1 CCK8 检测肾透明癌细胞活力 将紫草素溶液786-O 人肾细胞腺癌细胞消化计数后按2000/孔铺板于96 孔板中。紫草素溶液分为四组,分别为对照组、低剂量组(1μg/mL)、中剂量组(2μg/mL)和高剂量组(4μg/mL),每组5 个复孔。细胞铺板生长过夜后加入紫草素,48h 后检测加入CCK8 孵育2h,测定450nmol 处吸光度值。
2.2 软琼脂细胞集落实验 同上分为四组,将药物与DMEM 稀释的软琼脂稀释液混合后重悬消化离心的细胞,细胞密度设置为2000 个/mL。铺板于24孔板中,37℃培养7 天后取出拍照,每组设置10 个复孔,每个复孔选取5 个视野计算细胞集落数。细胞数>30 记为一个集落。
2.3 Poly-HEMA 细胞条件培养 同上实验分为4组,将poly-HEMA 2mL 加入6 孔板中,37℃保存,10min 后加入786-O 人肾细胞癌单细胞悬液。24h 后观察细胞聚团情况。
2.4 流式细胞术检测786-O 人肾细胞癌细胞凋亡将收集的786-O 人肾细胞癌细胞用PBS 稀释至5×106个/mL。按照PI-Annexin V 凋亡检测试剂盒说明书进行后续操作。
2.5 细胞caspase-3 活力检测 将786-O 肾透明细胞癌细胞消化计数后接种在铺有胶原蛋白或非粘附性poly-HEMA 的96 孔板上,包括空白组(只含培养基),对照组,低、中、高剂量组,阳性对照组[暴露于TRAIL(100ng)+Velcade(100nmol/L)处理16h],于37℃培养箱孵育6~24h。根据Caspase-Glo 3/7 测定法用试剂盒检测caspase-3 的活化。主要步骤为在开始测定之前,准备Caspase-Glo 3/7 试剂,使试剂平衡至室温,拌匀。从培养箱中取出装有已处理细胞的96 孔板,平衡至室温。将100μL Caspase-Glo 3/7 试剂加到96 孔板的每个孔中。在平板振荡器中以300~500rpm 轻轻混合溶液30s,在室温下孵育2h 后进行照度计读数。
2.6 Western blot 检测FAK、Akt、Src、GSK3b 蛋白磷酸化情况 收集药物处理48h 的细胞,裂解蛋白测定蛋白浓度,加入6X loading,100℃煮10min 后上样。每孔蛋白上样量20μg,经过SDS-PAGE 电泳后,转膜封闭,4℃过夜孵育一抗(一抗稀释比均为1:1000)。TBST 洗膜后孵育荧光二抗1h,在odyssey荧光扫膜仪进行显影。
2.7 RT-PCR 检测FasL、Bim mRNA 表达 将高剂量紫草素处理48h 的细胞,通过trizol 法提取细胞RNA 后逆转为cDNA,使用SYBR Green 法进行荧光定量PCR。PCR 程序为:95℃预变性5min;95℃变性15s;60℃退火30s;72℃延伸15s。以GAPDH 作为内参。引物购自北京擎科新业生物技术有限公司,引物详细序列如下:GAPDH(上游引物:5' TGTGGGCATCAATGGATTTGG 3';下游引物:5' ACACCATGTATTCCGGGTCAAT 3')、FasL(上游引物:5' TGCCTTGGTAGGATTGGGC 3';下游引物:5' GCTGGTAGACTC-TCGGAGTTC 3')、Bim(上游引物:5' CATATAACCCCGTCAACGCAG 3';下游引物:5' GCAGCCGCCACAAACATAC 3')。
2.8 统计学方法 应用GraphPad Prism 6 软件进行统计分析,计量资料采用均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用SNK-q 检验。P<0.05 表示差异有统计学意义。
3 实验结果
3.1 紫草素对肾透明细胞癌细胞活力的影响 与对照组比较,中、高剂量紫草素均能显著抑制肾透明细胞癌细胞活力(P<0.01)。见表1。
3.2 紫草素对集落形成的影响 与对照组比较,紫草素低、中、高剂量组细胞集落数明显减少(P 均<0.01),且呈剂量依赖性下降。见表2。
3.3 紫草素对poly-HEMA 条件下细胞聚集的影响 786-O 肾透明细胞癌细胞在Poly-HEMA 中,分别加入低、中、高剂量的紫草素培养24h,在倒置微镜下观察细胞形态,可观察到对照组细胞大部分成团聚集,而低、中、高剂量组细胞聚团减少,尤其在高剂量紫草素处理后,细胞几乎不形成聚团。见图1。
表1 CCK8 检测各组细胞活力比较(%,)
表1 CCK8 检测各组细胞活力比较(%,)
注:对照组为PBS 处理24h;低剂量组为1μg/mL 紫草素处理24h;中剂量组为2μg/mL 紫草素处理24h;高剂量组为4μg/mL 紫草素处理24h;与对照组比较,aP<0.01
表2 各组细胞集落数比较(个,)

表2 各组细胞集落数比较(个,)
注:对照组为PBS 处理24h;低剂量组为1μg/mL 紫草素处理24h;中剂量组为2μg/mL 紫草素处理24h;高剂量组为4μg/mL 紫草素处理24h;与对照组比较,aP<0.01
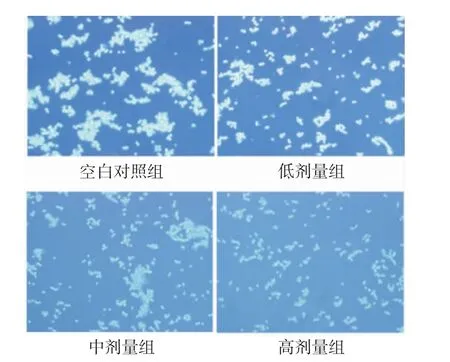
图1 紫草素对肾透明细胞癌细胞聚集的作用
3.4 紫草素对poly-HEMA 条件下细胞凋亡的影响低剂量组(8.04±0.98)%、中剂量组(19.35±1.22)%及高剂量组(35.25±1.35)%与对照组(0.40±0.52)%比较差异均有统计学意义(P<0.05 或P<0.01)。见图2。
3.5 紫草素对caspase-3 活力的影响 紫草素处理铺于胶原蛋白上的786-O 肾透明细胞癌细胞能明显降低caspase-3 活力(P<0.05,P<0.01)。同时铺板于非粘附性poly-HEMA 的细胞caspase-3 活性也随着紫草素剂量的增加而增加(P<0.05,P<0.01)。见表3-4。
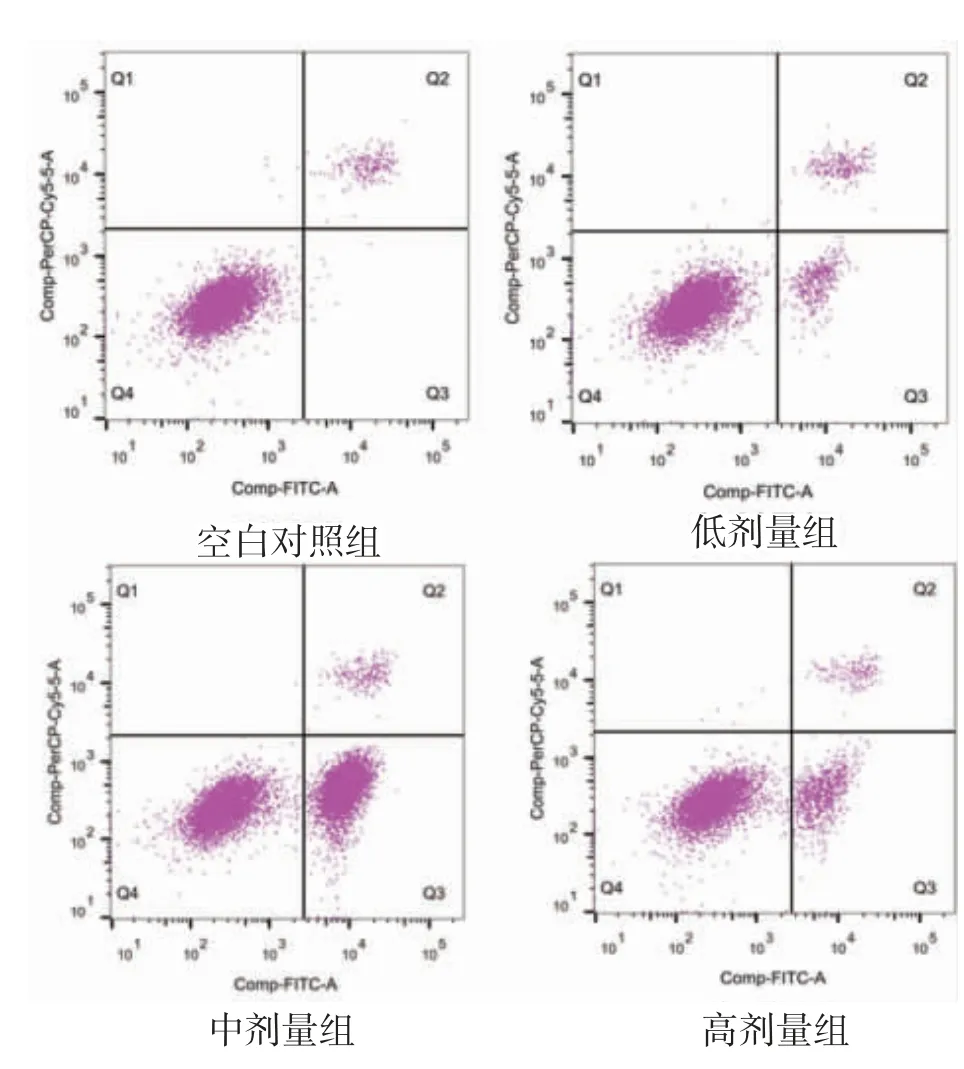
图2 紫草素对肾透明细胞癌失巢凋亡的作用
表3 紫草素对粘附生长肾透明细胞癌caspase-3 活力的影响()

表3 紫草素对粘附生长肾透明细胞癌caspase-3 活力的影响()
注:空白组为只含培养基;对照组为PBS 处理24h;低剂量组为1μg/mL紫草素处理24h;阳性对照组为TRAIL(100ng)+Velcade(100nmol/L)处理16h;中剂量组为2μg/mL 紫草素处理24h;高剂量组为4μg/mL紫草素处理24h;与对照组比较,aP<0.05,aaP<0.01
表4 紫草素对非粘附生长肾透明细胞癌caspase-3 活力的影响()

表4 紫草素对非粘附生长肾透明细胞癌caspase-3 活力的影响()
注:空白组为只含培养基;对照组为PBS 处理24h;低剂量组为1μg/mL紫草素处理24h;阳性对照组为TRAIL(100ng)+Velcade(100nmol/L)处理16h;中剂量组为2μg/mL 紫草素处理24h;高剂量组为4μg/mL紫草素处理24h;与对照组比较,aP<0.05,aaP<0.01
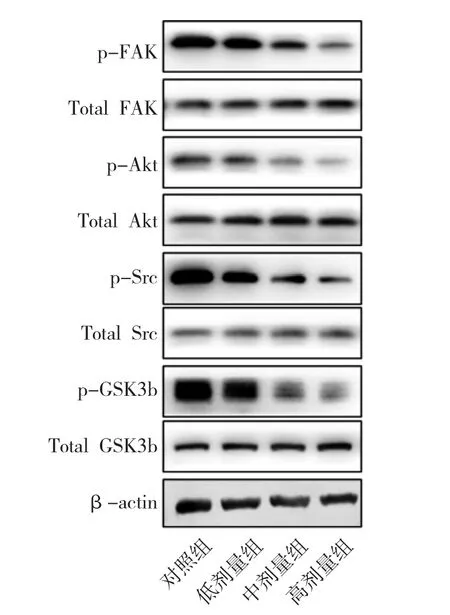
图3 紫草素抑制786-O 肾透明细胞癌FAK/Akt/Src/GSK3b信号活化
3.6 紫草素对FAK、Akt、Src、GSK3b 信号激活的影响 Western blot 结果显示,紫草素能明显降低786-O 肾透明细胞癌细胞FAK、Akt、Src、GSK3b 的磷酸化激活,与对照组比较均有显著性差异,且信号轴活化水平与紫草素的浓度存在剂量依赖性。见图3。
3.7 紫草素对凋亡信号靶基因FasL、Bim 表达的影响 高剂量紫草素能明显降低FasL、Bim 转录水平(P<0.01)。见表5。
表5 FasL、Bim 转录水平相对表达量比较()

表5 FasL、Bim 转录水平相对表达量比较()
注:对照组为PBS 处理24h;高剂量组为4μg/mL 紫草素处理24h;与对照组比较,aP<0.01
4 讨论
目前临床肾细胞癌的治疗策略以放化疗为主,但是肾细胞癌对放疗和化疗均不敏感的问题一直存在,其中一个重要的原因即肾细胞癌异常的抗凋亡能力[11,13]。
紫草素在众多肿瘤的治疗中发挥重要作用[8-12]。本研究通过CCK8 实验检测发现,紫草素能有效抑制肾细胞癌细胞活力。进一步通过软琼脂细胞集落实验和poly-HEMA 条件培养发现紫草素能明显抑制肾透明细胞癌细胞失巢凋亡抵抗的能力。且这种作用具有剂量梯度依赖性。本研究发现,低、中、高剂量的紫草素均能明显促进癌细胞的凋亡,进一步明确了紫草素对肾细胞癌抗凋亡能力的抑制作用。事实上,紫草素的抗凋亡作用在其他肿瘤中也存在类似的研究,Wu 等[14]发现,低剂量紫草素能诱导黑色素瘤细胞caspase 信号活化,促进细胞发生凋亡,此外紫草素对肺癌、前列腺癌等多种细胞也有类似的作用[15]。因此,对紫草素的进一步体内研究将有利于促进紫草素成为新型肿瘤治疗潜在药物。
经典的细胞凋亡分子机制为p53 激活促凋亡蛋白Bax,Bax 导致细胞色素C 的释放和caspase 的活化[16]。本研究发现抑制紫草素能明显升高肾细胞癌在贴壁和悬浮状态下caspase-3 活性。同时通过检测抗凋亡相关信号FAK、Akt、Src、GSK3b 的磷酸化激活,紫草素作用后明显抑制了相关信号的激活,通过对凋亡信号下游靶基因表达的定量检测我们发现下游靶基因FasL、Bim 促凋亡分子的表达明显升高,提示紫草素可能通过抑制抗凋亡信号并增强促凋亡信号达到抑制肾细胞癌的作用。

