根系修剪对枳生长及相关基因表达的影响
黄咏明,宋 放,王 策,姚京磊,王志静,何利刚,吴黎明,蒋迎春
(湖北省农业科学院 果树茶叶研究所,湖北 武汉 430064)
根系是植物吸收水分和养分的主要器官,其功能与根系形态和生理特性相关[1]。适当抑制根系顶端优势,能改善根系形态结构和分布,提高根系整体活力和苗木成活率[2]。侧根相比主根更能充分地与土壤中的水分和矿物质营养接触[3],也更容易感知外界环境的刺激[4]。因此,侧根的多少与根系的整体活力及水分和养分的利用率密切相关[5]。主根修剪是苗木培育过程中常用的根系干扰技术[6],通常以切断主根来促进侧根的发生。例如,在葡萄[7]、桃[8]试管苗移栽时进行根系修剪可促进新根系的形成和生长。
植物根系生长发育离不开细胞的分裂与分化,而植物激素可能是整合细胞周期与根系发育的关键因子[9],其含量变化受遗传特征、栽培措施等的影响[10]。根系修剪促进侧根生长可能与根部IAA含量增加有关[11]。侧根的发育是植物激素信号途径相关的转录因子、受体蛋白及上下游基因共同作用的结果。Meng等[12]指出,IAA11、IAA13、HEMEOXYGENASE1(HOX1)、CYCLOPHILIN2(CYP2)等基因是IAA信号途径中调控水稻侧根发育的关键基因。Zhu等[13]从水稻根系中克隆了一个控制侧根发育最关键的Aux/IAA基因OsIAA11。随后,Kitomi等[14]克隆了侧根发育控制基因OsIAA13,而OsIAA13对侧根的调控可能与OsIAA11类似,可通过调控下游相关基因的表达来影响侧根的发育。Kang等[15]发现,OsCYP2功能缺失突变体Oscyp2的侧根发育存在缺陷。另外,Guo等[16]和Han等[17]分别在番茄和玉米中发现HOX1基因参与调控侧根的形成。目前,有关植物内源激素与根系形成的关系已开展了大量研究,也逐渐明确了各种激素调控根系发育的作用关系[18-21]。近年来,研究者广泛开展了根系修剪或断根对植物根系形态构建、生理生化响应的研究[22-23],但在分子水平上研究根系修剪与植物侧根形成的关系还鲜见报道。
柑橘是一种典型的根毛较少且营养吸收效率较低的果树,需要健壮发达的根系提高对水分和养分的接触面积和吸收效率。因此,可利用根系修剪作为调控柑橘根系形态构建的一项农业技术措施,但相关的作用机制还不清楚。鉴于此,本研究以柑橘栽培常用砧木——枳[Poncirustrifoliata(L.)Raf.]为试材,研究根系修剪对枳实生苗生长发育、根系构型以及营养吸收的影响,并通过分析调控侧根发育相关基因的表达,初步探讨根系修剪影响柑橘根系发育的分子作用机制,以期为柑橘优质壮苗的培育提供理论依据。
1 材料与方法
1.1 试验材料
枳果实采自湖北省农业科学院果树茶叶研究所国家柑橘原种保存及良种繁育基地。2018年3月19日和2019年3月21日分别从果实中取出种子,用1.0 mol·L-1NaOH溶液搓洗种子去除果胶,蒸馏水清洗3次后,用75%乙醇在超净台中进行消毒30 s,随后用2%的次氯酸钠消毒15 min,最后用无菌水清洗3次。将清洗好的种子撒播于事先经过高压蒸汽(0.11 MP,121 ℃,1 h,下同)灭菌处理的河沙中,并置于昼/夜温度为25℃/22℃、相对湿度为80%的培养箱中进行催芽。催芽试验地点为湖北省农业科学院果树茶叶研究所南湖大楼生理实验室。
2.2 试验处理
待枳实生苗长至4~6片真叶时进行移栽,选取茎粗、株高、叶片数一致的48株枳实生苗,分成4组,每组12株,移苗前分别进行4种不同水平的根系修剪处理,处理一为全根处理(即不进行根系修剪处理,RP0),处理二为轻度根系修剪处理(即切除1/3的主根,RP1),处理三为中度根系修剪处理(即切除1/2的主根,RP2),处理四为重度根系修剪处理(即切除2/3的主根,RP3)。根系修剪处理后的实生苗种植于经过高压蒸汽灭菌的基质中,每4株1盆,每个处理共计3盆。试验用盆规格:上口径16 cm,下口径11 cm,高14 cm。每盆装入基质3.0 kg,基质由土、河沙按2∶1(体积比)混合而成。试验材料置于温度为25 ℃,相对湿度为60%~70%的温室中培养,试验期间每周每盆浇300 mL的1/2 Hoagland营养液2次。2018年和2019年的试验处理一致。
1.3 生理指标测定
待植株生长3个月后,将植株从基质中取出,用清水轻轻清洗根和叶片后,用吸水纸擦干,立即检测植株生长指标(株高、茎粗、鲜重),每个处理中一半的根系尽快用锡箔纸包好并液氮速冻后保存于-80 ℃冰箱内,用于提取RNA;另一半放入80 ℃烘箱杀青2 h后,再转入55 ℃烘箱烘干72 h后用于植株营养元素的检测。
采用EPSON V7700彩色根系扫描仪扫描根系,并用WinRHizo根系分析软件分析根系扫描图片,获取枳实生苗的根长、侧根数、根表面积等根系构型数据。
利用H2SO4-H2O2法消煮,使用靛酚蓝比色法测定植株根系N元素的含量,并使用电感耦合等离子光谱仪(ICP)测定根系P、K、Ca、Mg、B、Fe、Na、Zn等元素的含量。
1.4 实时荧光定量PCR(qRT-PCR)检测
取保存于-80℃的枳实生苗根系样品,使用液氮磨样并分装,随后按照说明书的方法使用Trizol(Life,美国)提取总RNA。使用NanoDrop2000检测RNA的浓度,并用琼脂糖凝胶电泳检测RNA的完整性。随后用5X All-in-one Master Mix with AccuRT Genomic DNA Removal Kit(ABM,加拿大)试剂盒进行去除RNA中的基因组DNA并反转录合成cDNA。
通过Blast方法在甜橙基因组(http://citrus.hzau.edu.cn/cgi-bin/orange/blast)中检索水稻中已报道的根系发育相关基因在柑橘中的同源基因[12],并使用NCBI的Primer-Blast程序设计定量PCR引物,引物序列见表1。

表1 引物序列Table 1 Primer sequences
使用Applied Biosystems PCR-7500仪器进行实时荧光定量PCR检测,具体步骤参照EvaGreen 2X qPCR Maste Mix-Low ROX(ABM,加拿大)试剂盒说明书进行。qRT-PCR反应体系为10 μL:Acer qpcr SYBR Green mix 5 μL、正反向引物各0.5 μL、cDNA模板0.5 μL、ddH2O 3.5 μL。每个处理做3个生物重复和3个技术重复,使用Elongation factor 1 α基因作为内参,数据的处理采用相对定量法,参照2-ΔΔCt法进行分析[24-26]。
1.5 统计分析
采用SAS(8.1)软件的ANOVA过程进行处理间的差异显著性检验,并使用LSD法进行多重比较分析。
2 结果与分析
2.1 根系修剪对枳植株生长发育的影响
2018年试验结果表明,与RP0相比,RP1对枳实生苗株高、茎粗和鲜重没有显著影响(P<0.05);RP2增加了枳实生苗株高和茎粗,显著增加了地上部和根系鲜重(P<0.05);RP3降低了枳实生苗株高和地上部鲜重,显著降低了根系鲜重(P<0.05)。2019年试验结果表明,与RP0相比,RP1显著增加了枳实生苗株高(P<0.05),但显著降低了植株茎粗(P<0.05),而对植株鲜重没有显著影响;RP2显著增加了株高和茎粗,以及地上部和根系鲜重(P<0.05);RP3显著降低了根系鲜重(P<0.05),但对株高、茎粗、地上部鲜重没有显著影响(表2)。由此可见,适度根系修剪(RP2)能够促进植株生长,增加生物量,轻度或重度根系修剪处理对植株生长无效应或负效应。

表2 不同根系修剪处理下枳实生苗生长情况Table 2 The growth of Poncirus trifoliata seedlings under different root pruning treatments
2.2 根系修剪对枳根系构型的影响
根系修剪处理促进了枳实生苗侧根的发生,改变了根系构型,且RP2植株根系构型最优(图1)。2018年和2019年的试验均表明,与RP0相比,RP1和RP3增加了枳实生苗侧根数量,但对根系的总长度、表面积和平均长度没有显著影响;RP2显著(P<0.05)增加了侧根数、根系总长度和根系表面积(表3)。由此可见,不同程度的根系修剪均能促进侧根的生长,其中RP2对枳实生苗根系构型参数促进效果最优。
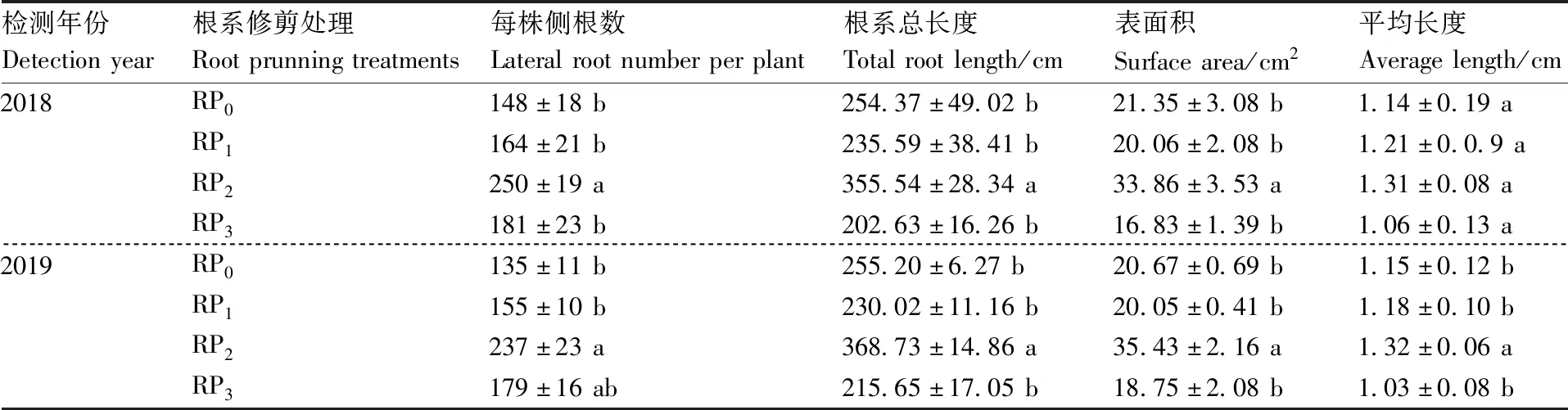
表3 不同根系修剪处理下枳实生苗根系构型参数Table 3 The root architecture system parameters of Poncirus trifoliata seedlings under different root pruning treatments
2.3 根系修剪对枳实生苗根系营养元素含量的影响
2018年和2019年的试验结果表明,不同水平根系修剪处理对枳实生苗根系大量元素、中量元素和微量元素含量影响不同(表4)。整体来看,与RP0相比,RP1、RP2和RP3均增加了枳实生苗根系大量元素和微量元素含量,但差异显著水平各异。RP1仅显著增加了植株根系Ca元素含量,RP2显著增加了植株P、K、Ca、B、Fe、Na和Zn元素的含量,RP3显著提高了植株N、K、Mg和Zn元素的含量(P<0.05)。这说明一定程度的根系修剪处理有利于枳实生苗对部分营养元素的吸收和积累,其中RP2效果最好。
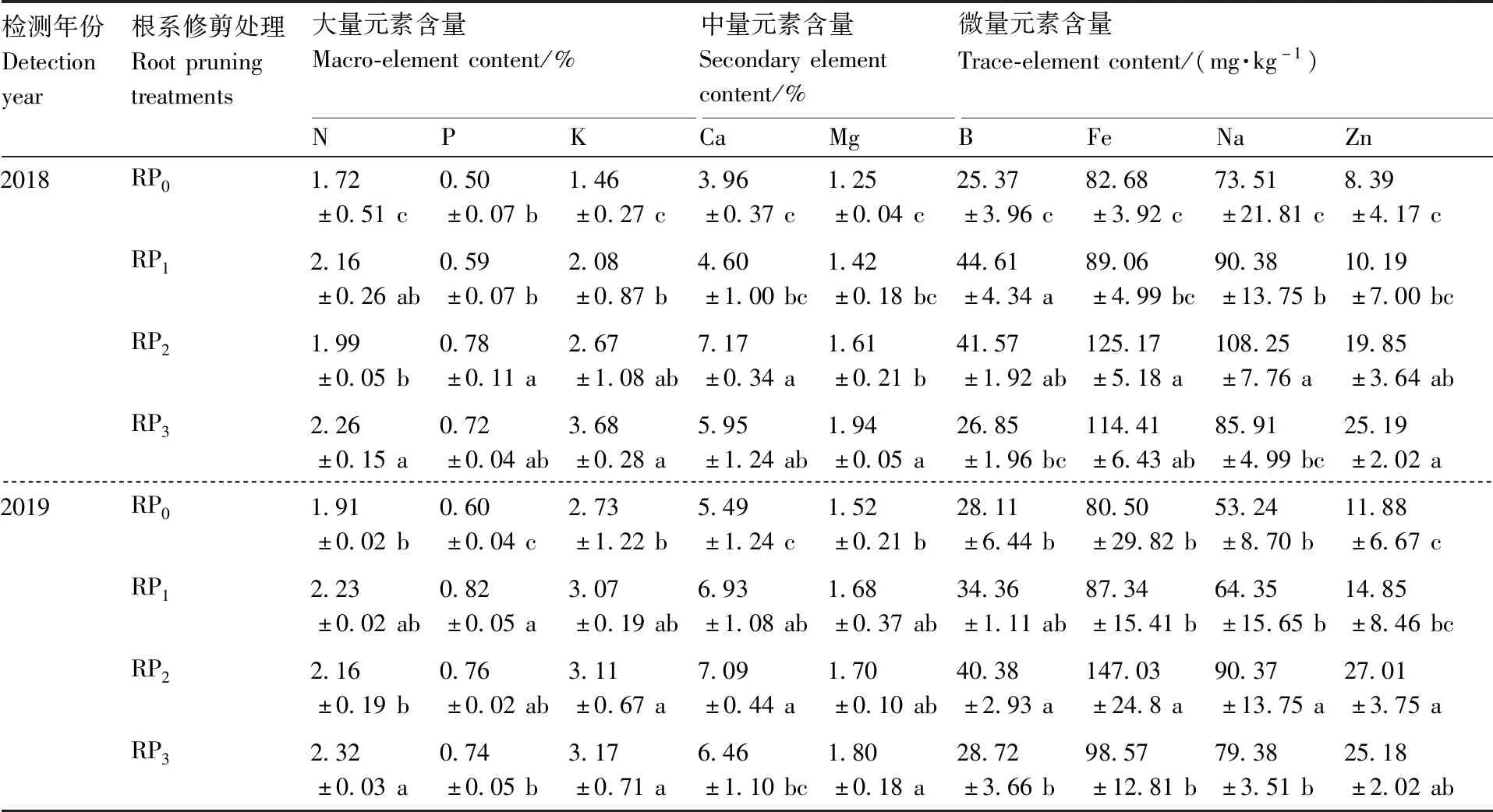
表4 不同根系修剪处理下枳实生苗根系营养元素含量Table 4 The contents of nutrient elements in roots of Poncirus trifoliata seedlings under different root pruning treatments
2.4 根系修剪对枳侧根发育相关基因表达的影响
为了初步探讨根系修剪处理调控侧根发育的分子机理,本研究选取了4个已经报道的侧根生长发育关键基因(HOX1、CYP2、IAA11、IAA13)进行qRT-PCR检测(图2)。与RP0相比,HOX1基因在根系修剪处理后的表达量均升高,但仅RP2植株根系HOX1的表达量显著增加;RP1对CYP2基因表达量无显著影响,RP2和RP3均显著增加了植株根系CYP2基因的表达量,且两者间差异显著;RP1和RP2均显著降低了植株根系IAA11基因表达量,但RP3未达到显著水平;RP1、RP2和RP3均显著降低了IAA13基因表达量,说明不同根系修剪处理诱导侧根发育关键基因不同的表达模式。
3 讨论
前人研究表明,断根处理能够诱导植物侧根的发生,促使根系更加发达[27]。本研究中,从4种根系修剪水平处理后的根系形态来看,中度根系修剪(RP2)的枳实生苗侧根最多且根系构型形态最好。这与许建兰等[8]在桃根尖基部切去根长1/2的研究结果一致。但与Zhang等[28]在核桃上的研究结果不尽相同,重度根系修剪(切除2/3主根)比中度根系修剪(切除1/3主根)对根系分支和表面积增加效果更显著。这可能与树种类型有关,基因型不同响应根系修剪程度的策略可能不同。此外,根系修剪诱导了枳实生苗主根剪口处多条侧根的形成(图1)。主根修剪会诱导苗木形成多主根型(multiple-taprooted)根系,从而减轻主根的变形螺旋,并优化根系的对称性,进而潜在地降低苗木发生倒伏的风险[29]。因此,适宜强度的根系修剪可优化根系在土壤中的形态分布,促进植株根系在土壤中稳扎。
根系修剪可促进地上部营养物质向地下运输,以帮助根系形态的重新建成。Budiarto等[30]指出,柑橘根系被修剪50%后,糖分会立即转移到根系为新根生长提供充足的营养储备。本研究中,重度根系修剪(RP3)显著降低了枳实生苗根系鲜重,但中度根系修剪(RP2)显著增加了枳实生苗株高、茎粗和鲜重,促进了植株生长。这说明,根系修剪程度过重会消耗更多的能量来恢复根系功能,从而间接地抑制了地上部的生长发育。RP2促进枳实生苗生长可能与优化的根系构型提高了养分吸收效率有关。因为,根系构型的改善能够增加水分和养分的利用率,从而增加植物的生物量[31]。Bréda等[32]指出,根系修剪通过诱发植株形成密集而庞大的根系使植株获得充足的水分和养分是一种补充机制。这也解释了本研究中根系修剪处理植株要比对照植株营养元素含量高些,特别是RP2植株具有较高的B、Fe、Na、Zn等营养元素含量。
本研究中,根系修剪促进了枳实生苗根系HOX1和CYP2基因的表达,但抑制了IAA11和IAA13基因的表达,且基因表达差异性依赖于根系修剪水平。有研究指出,HOX1参与了生长素(IAA或IBA)和茉莉酸甲酯(MJ)诱导不定根或侧根的形成[33-35]。IAA家族基因IAA11和IAA13是侧根发育重要的负调控基因[13-14],而CYP2基因突变体可通过诱导IAA11的积累,从而抑制生长素信号调控侧根的发育[36],暗示根系修剪可能通过诱导HOX1和CYP2基因的表达,并抑制IAA11和IAA13基因的表达来促进柑橘植株侧根的发生及生长。这也表明,环境因子可通过诱导侧根发育相关基因不同的表达模式,从而调控侧根的发育。
综上所述,中度根系修剪(RP2)优化了枳实生苗根系构型,改善了植株营养水平,促进了植株生长,在柑橘幼苗移栽过程中可以进行适度的根系修剪处理来诱发侧根,提高苗木质量。同时本研究初步揭示了不同根系修剪水平条件下HOX1、CYP2、IAA11、IAA13等侧根发育关键基因表达量的变化规律,为深入挖掘根系修剪调控柑橘植株生长发育的分子机制打下了基础。

