薏苡叶斑病病原菌生物学特性及防治药剂毒力评估
侯翔宇,黄世勇,姚锦爱,谢世勇,黄建成 *
(1. 福建省作物有害生物监测与治理重点实验室/福建省农业科学院植物保护研究所,福建 福州 350013;2. 武夷山市种子站,福建 武夷山 354300)
0 引言
【研究意义】薏苡(Coix lacryma-jobiL.),又名薏苡仁、苡米、苡仁等,属禾本科(Gramineae)薏苡属(Coix),是我国传统的药食兼用的食品,具有丰富的营养价值及药用功效,在福建、贵州、云南、广西等均有种植[1−2]。福建省薏苡种植面积约7 000 hm2,年产量约2.0×107kg。近年来,在福建薏苡种植基地调查发现薏苡叶斑病发病严重,发病初期引起水渍状浅黄色病斑,严重时造成黄褐色病变直至死亡。经鉴定该病是由(Curvularia coicisCastellani)侵染薏苡叶片引起的薏苡叶斑病 (Coix leaf spot, CLS) ,是薏苡产区重要的真菌病害,田块病株率高达80 %以上,造成产量下降,严重制约薏苡的生产[3],目前,对薏苡叶斑病主要从病原鉴定、发生情况及防治方法等方面进行研究,在多篇文献中报道使用多菌灵、百菌清等传统杀菌剂作为主要的化学防治药剂[4−5],但长期施用这些药剂,易使病原菌抗药性增强,防治效果不佳。因此,明确薏苡叶斑病病原菌生物学特性,评估市面上用于防治薏苡叶斑病药剂的防控潜力,对于该病害田间科学用药和高效防治具有重要意义。【前人研究进展】国内学者研究表明,氯氟醚菌唑、吡唑醚菌酯、咯菌腈等三类新型药剂,对多种植物叶斑病具有不错的防治效果。潘连富等[6]明确了氯氟醚菌唑悬浮剂对香蕉叶斑病病原菌暗双孢菌(Cordana musae)的田间防效,认为该药对香蕉叶斑病的防治效果较好;代玉立等[7]采用菌丝生长速率法测定了闽南地区4 个薏苡产区72 株薏苡叶斑病菌对吡唑醚菌酯的敏感性,认为吡唑醚菌酯对薏苡叶斑病有较好的防治效果,李戌清等[8]研究了14 种杀菌剂对番茄叶斑病病原菌番茄匍柄霉(Stemphylium lycopersici)菌丝生长的抑制作用,结果表明咯菌腈对番茄叶斑病效果最好。【本研究切入点】关于薏苡叶斑病菌(C. coicis)的生物学特性及其防治药剂毒力评估的研究有待深入进行。【拟解决的关键问题】明确薏苡叶斑病病原菌的生物学特性,测定氯氟醚菌唑、吡唑醚菌酯、咯菌腈等防治药剂的毒力指数并评估它们二元复配剂的联合作用效果。
1 材料与方法
1.1 供试材料
供试药剂为97 %氯氟醚菌唑原药(Mefentrifluconazole,三唑类,巴斯夫欧洲公司)、96 %吡唑醚菌酯原药(Pyraclostrobin,甲氧基丙烯酸酯类,江苏耘农化工有限公司)、98 % 咯菌腈原药(Fludioxonil,吡咯类,西安近代科技实业有限公司),对照药剂为98.1 %多菌灵原药(Carbendazim,苯并咪唑类,辉丰农化股份有限公司)。
供试菌株为薏苡叶斑病菌(Curvularia coicis),由福建省农业科学院植物保护研究所分离保存。
供试培养基马铃薯葡萄糖琼脂(PDA)培养基:新鲜去皮马铃薯200 g、葡萄糖20 g、琼脂粉16 g、去离子水1000 mL。察氏(Czapek)培养基:硝酸钠3 g、磷酸氢二钾1 g、硫酸镁0.5 g、氯化钾0.5 g、硫酸亚铁0.01 g、蔗糖30 g、琼脂粉16 g、蒸馏水
1000 mL。
1.2 病原菌生物学特性测定
1.2.1 温度对病原菌菌丝生长的影响 用无菌的5 mm
直径打孔器打取培养5 d 的病原菌边缘菌饼转接于PDA 培养基中央,分别置于10、15 、20、25 、30、35 、40 ℃恒温暗培养,6 d 后采用十字交叉法测量菌落直径。每处理3 皿,重复3 次。
1.2.2 pH 对病原菌菌丝生长的影响 取直径为5 mm
的菌饼接种于用0.1 mol·L−1HCl 和0.1 mol·L−1NaOH调配pH 为4、5、6、7、8、9、10 的PDA 培养基上,后置于28 ℃恒温培养,6 d 后采用十字交叉法测量菌落直径。每处理3 皿,重复3 次。
1.2.3 光照条件对病原菌菌丝生长的影响 取直径为5 mm 的菌饼转接于PDA 培养基中央,分别置于全黑暗、全光照和黑暗光照交替(12 h/12 h)3 种不同光照条件下,28 ℃恒温培养,6 d 后采用十字交叉法测量菌落直径。每处理3 皿,3 个重复。
1.2.4 不同碳源、氮源对病原菌菌丝生长的影响以察氏培养基为基础培养基,将培养基中的蔗糖分别替换成等量的淀粉、麦芽糖、乳糖、葡萄糖,制成不同碳源的培养基以不含碳源培养基作为对照;采取同样的方法将等量的蛋白胨、牛肉浸膏、酵母、硫酸铵分别替换培养基中的硝酸钠,制成不同氮源的培养基,以不含氮源培养基为对照。再将5 mm 的活化菌饼接于不同碳源、氮源培养基中央,28 ℃恒温培养,6 d 后采用十字交叉法测量菌落直径。每处理3 皿,重复3 次。
1.3 室内毒力试验
1.3.1 薏苡叶斑病病原菌防治药剂的毒力测定与评估采用菌丝生长速率法测定[9]。将氯氟醚菌唑、吡唑醚菌酯、咯菌腈和多菌灵的质量浓度均设为0.002、0.01、0.05、0.25、1.25 和6.25 mg·L−1,无菌操作条件下,在PDA 培养基内加入各药剂母液,制成系列浓度的含药PDA 培养基平板。供试菌株在PDA 平板上纯化培养4~5 d 后,用5 mm 规格打孔器打取菌落边沿新鲜菌饼接种于含不同质量浓度药剂的PDA 平板中央,每处理3 皿,重复3 次,后置于28 ℃恒温培养,6 d 后用十字交叉法测量每个培养基的菌落直径。计算供试药剂每个处理浓度对菌丝生长的抑制率,并计算其对供试菌株的有效抑制中浓度EC50和毒力指数。菌丝生长抑制率/%=[(对照组菌落直径-药剂处理组菌落直径)/(对照组菌落直径−菌饼直径)]×100。毒力指数TI=(对照药剂EC50/供试药剂EC50)×100。
1.3.2 薏苡叶斑病病原菌防治药剂联合作用测定与评估 在1.3.1 的基础上,将3 种供试药剂进行复配,设定氯氟醚菌唑与咯菌腈、氯氟醚菌唑与吡唑醚菌酯、吡唑醚菌酯与咯菌腈共3 组混剂组合,每个组合均按有效成分质量配比9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9 复配,质量浓度均设为0.002、0.01、0.05、0.25、1.25 和6.25 mg·L−1;根据3 组混剂组合各自设定的配比和浓度,按照1.3.1 的方法配制成系列浓度的含药培养基平板,以不含药的PDA 培养基作空白对照,每个处理3 皿,重复3 次;取菌龄一致、直径5 mm 的菌饼分别接种于每个培养基平板中央,后置于28 ℃恒温培养,6 d 用十字交叉法测量每个培养基的菌落直径,计算3 组混剂组合每个处理浓度对菌丝生长的抑制率和每组复配药剂的抑制中浓度EC50及共毒系数CTC。共毒系数计算法,以单剂EC50较低者为标准药剂计算混剂共毒系数(CTC):单剂毒力指数TI=(标准药剂EC50/供试药剂EC50)×100、复配剂实际毒力指数ATI=(标准药剂EC50/复配剂EC50)×100、复配剂理论毒力指数TTI=TIA×PA+TIB×PB(TIA 和TIB 分别为单剂A 和单剂A 的毒力指数,PA 和PB 分别为复配剂中各单剂的有效成分百分含量)和共毒系数CTC=(复配剂的实际毒力指数ATI/复配剂理论毒力指数TTI)×100。共毒系数分级:(CTC≥120 为增效作用,80≤CTC<120 为相加作用,CTC<80 为拮抗作用)。
1.4 数据统计与分析
用DPS 7.05 软件计算毒力回归方程、有效抑制中浓度EC50及相关系数等数据,利用Duncan’s 新复极差法对生物学特性结果进行显著性分析。
2 结果与分析
2.1 生物学特性
2.1.1 温度对病原菌菌丝生长的影响 病原菌在10~40 ℃条件下均能生长,10~25 ℃菌丝生长速度呈升高趋势,25~40 ℃菌丝生长速度呈下降趋势。菌丝适宜生长温度为25~30 ℃,在25 ℃条件下菌丝生长最快,培养 6 d 菌落直径为 85.33 mm(图1)。结果表明,该病原菌最适生长温度为25 ℃,对低温和高温具有一定耐性。

图1 不同温度对病原菌菌丝生长的影响Fig. 1 Effect of temperature on C. coicis mycelial growth
2.1.2 pH 对病原菌菌丝生长的影响 病原菌在pH 4~10 条件下均能生长,pH 4~8 菌丝生长速度呈升高趋势,pH 9~10 菌丝生长速度呈下降趋势。菌丝适宜生长pH 为7~9,在pH 8 条件下菌丝生长最快,培养 6 d 菌落直径为80.00 mm(图2),结果表明,该病原菌喜偏碱性或中性环境,最适生长pH 值为 8。
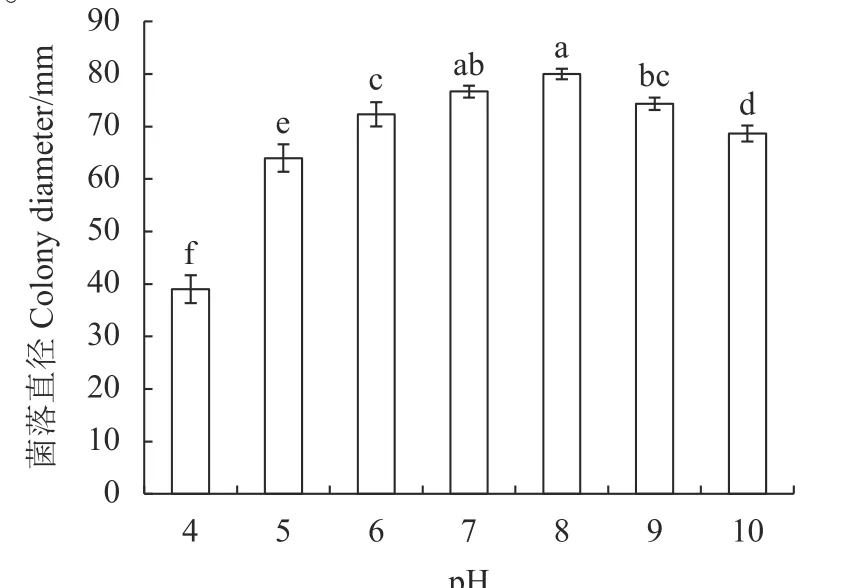
图2 不同pH 对病原菌菌丝生长的影响Fig. 2 Effect of pH on C. coicis mycelial growth
2.1.3 光照条件对病原菌菌丝生长的影响 表1 结果显示,病原菌在全黑暗、黑暗光照交替和全光照处理下均能较好地生长,培养 6 d 菌落直径分别为80.33、79.67、80.67 mm,相互之差异不显著,说明光照条件对该病原菌菌丝生长影响不显著。

表1 光照条件对病原菌菌丝生长的影响Table 1 Effect of light exposure on C. coicis mycelial growth
2.1.4 不同碳氮源对病原菌菌丝生长的影响 试验结果(表2)表明,病原菌在供试5 种碳源中均能生长,且生长速度差异明显。以淀粉为碳源的培养基中菌落生长速度最快,培养 6 d 的菌落直径为74.33 mm,其次是以蔗糖、葡萄糖和乳糖为碳源的培养基处理组,其菌落生长速度均显著高于缺碳源的对照,其中以麦芽糖为碳源的培养基上菌落生长速度最低。不同氮源的结果显示,病原菌在以蛋白胨为氮源的培养基中菌落生长速度最快,培养6 d 后直径达83.67 mm;在以酵母、牛肉浸膏和硝酸钠为氮源的培养基上,菌落生长速度明显高于缺氮源的对照组,而以硫酸铵为氮源的培养基菌落生长速度最低。因此,病原菌最佳供试碳源为淀粉、最佳供试氮源为蛋白胨。

表2 不同碳氮源对病原菌菌丝生长的影响Table 2 Effects of carbon and nitrogen sources on C. coicis mycelial growth
2.2 薏苡叶斑病病原菌防治药剂的毒力测定与评估
试验结果(表3)显示,供试的3 种杀菌剂对薏苡叶斑病病原菌均具有不同程度的抑制作用,其中氯氟醚菌唑的抑菌效果最好,EC50为0.0055 mg·L−1,毒力指数是多菌灵的234.83 倍;其次为吡唑醚菌酯,EC50为0.0132 mg·L−1,毒力指数是多菌灵的97.84倍、最后为咯菌腈,EC50为0.0152 mg·L−1,毒力指数是多菌灵的84.97 倍。说明这3 种药剂对薏苡叶斑病病原菌的毒力高于多菌灵,具有较好的防控潜力。

表3 薏苡叶斑病防治药剂的毒力评估Table 3 Toxicity of fungicides on C. coicis
2.3 薏苡叶斑病病原菌防治药剂联合作用测定与评估
2.3.1 氯氟醚菌唑与吡唑醚菌酯对薏苡叶斑病病原菌联合作用的测定与评估 由表4 可知,氯氟醚菌唑与吡唑醚菌酯混剂组合的9 个有效成分质量配比均对薏苡叶斑病菌起到有效的抑制作用,抑制中浓度EC50为0.0035~0.0092 mg·L−1;它们的共毒系数CTC均大于120,所有配比表现为增效作用。其中5∶5 配比的增效作用最明显,共毒系数CTC为221.85。说明氯氟醚菌唑与吡唑醚菌酯合理比例复配能显著增加防治薏苡叶斑病菌的效果,两者复配的最佳有效成分质量配比为5∶5。
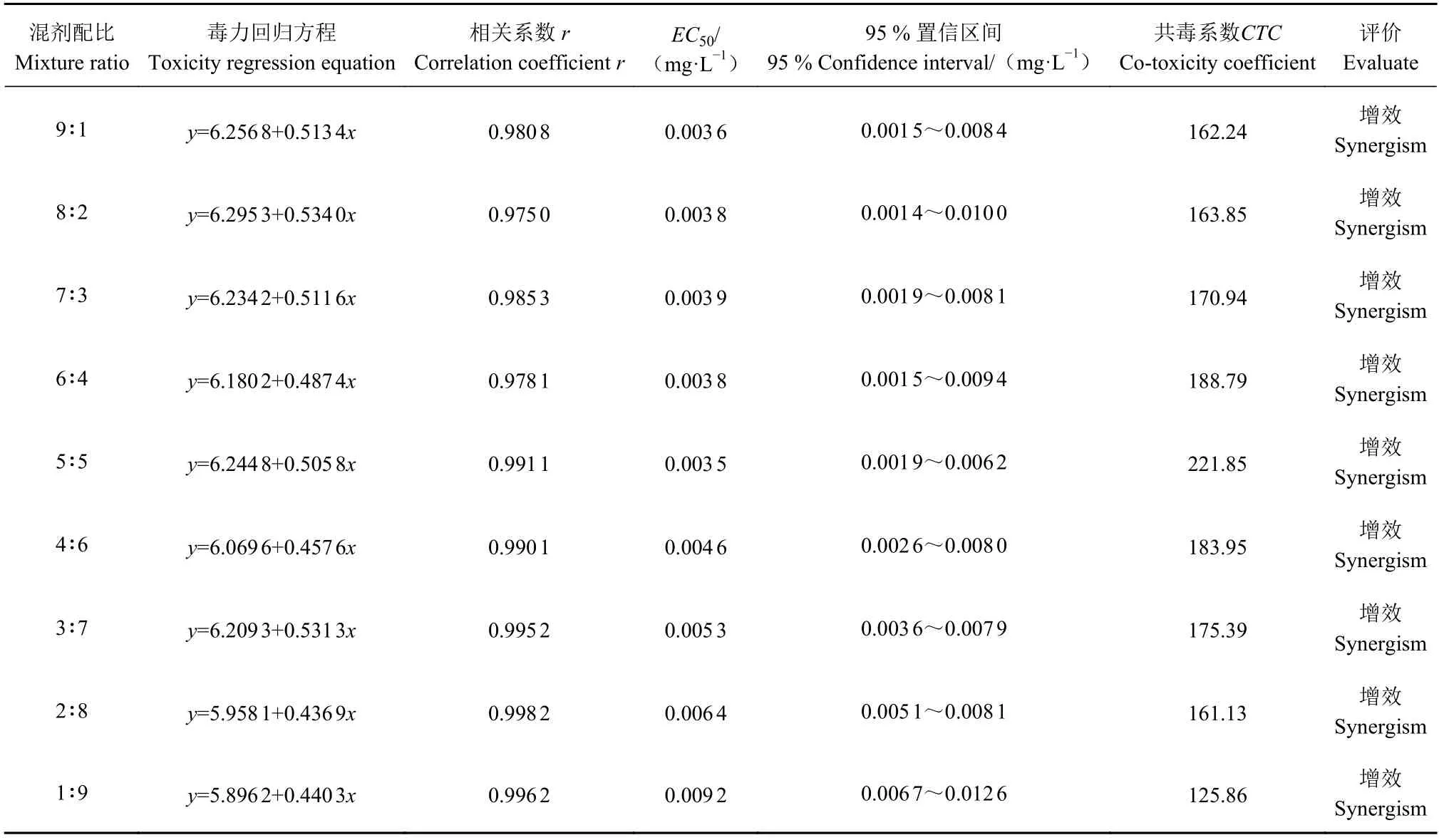
表4 氯氟醚菌唑与吡唑醚菌酯对薏苡叶斑病病原菌的联合作用Table 4 Toxicity of mefentrifluconazole and pyraclostrobin combination on C. coicis
2.3.2 氯氟醚菌唑与咯菌腈对薏苡叶斑病病原菌联合作用的测定与评估 由表5 可知,氯氟醚菌唑与咯菌腈混剂组合的9 个有效成分质量配比对薏苡叶斑病菌较好的抑制作用,EC50为0.009 5~0.014 2 mg·L−1;但所有配比均表现不具有增效作用,9∶1、8∶2、7∶3、5∶5 和4∶6 配比的共毒系数CTC小于80,表现为拮抗作用,其他4 个配比的共毒系数CTC大于80 且小于120,表现为相加作用。可见,氯氟醚菌唑与咯菌腈复配不具有增效作用,适用单剂防控薏苡叶斑病。
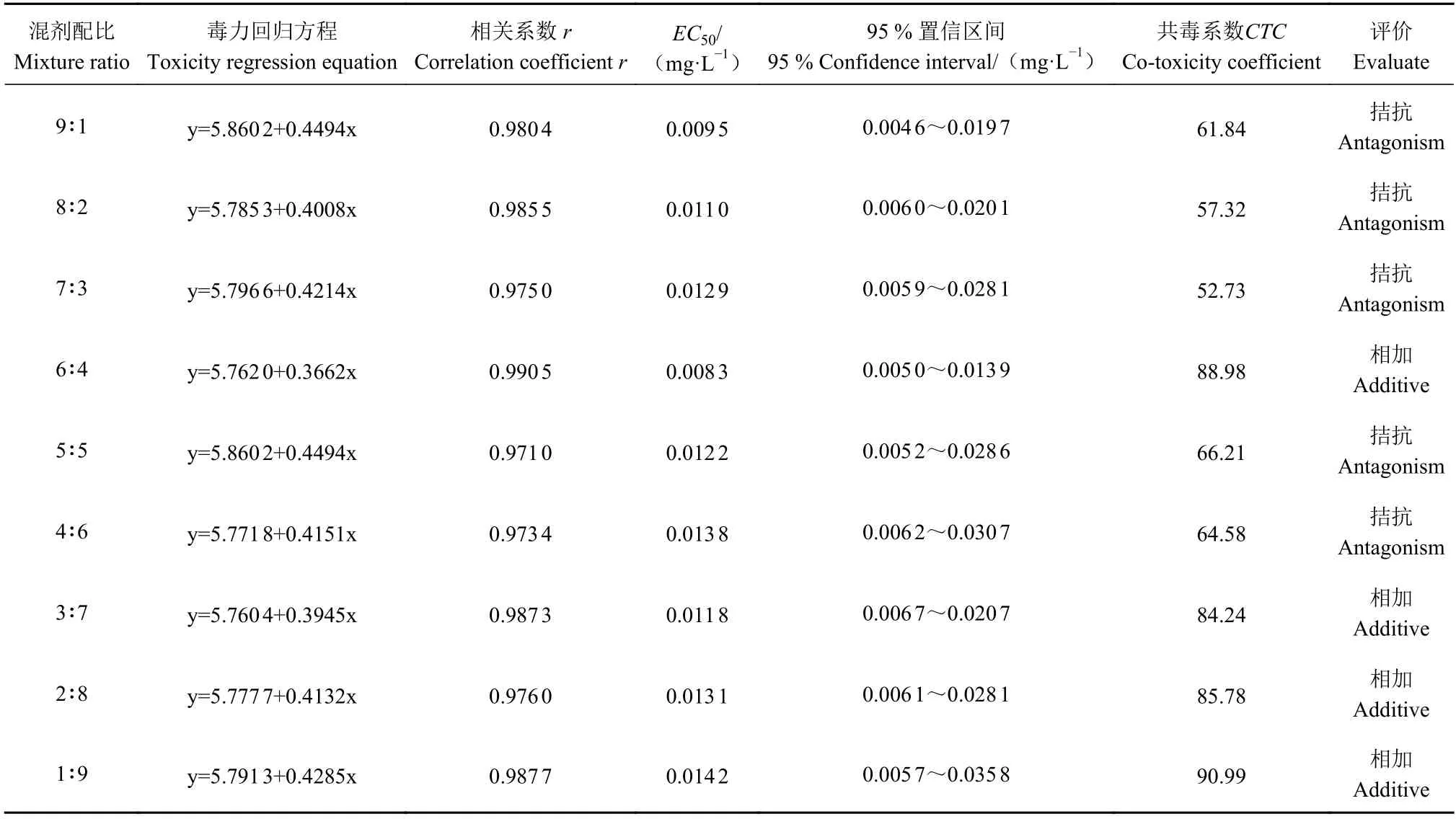
表5 氯氟醚菌唑与咯菌腈对薏苡叶斑病病原菌的联合作用Table 5 Toxicity of mefentrifluconazole and fludioxonil combination on C. coicis
2.3.3 吡唑醚菌酯与咯菌腈对薏苡叶斑病病原菌联合作用的测定与评估 由表6 可知,吡唑醚菌酯与咯菌腈混剂组合的9 个有效成分质量配比对薏苡叶斑病有较好的抑制作用,EC50为0.0118~0.0203 mg·L−1;但所有配比均表现不具有增效作用,5∶5、4∶6 和1∶9 配比的共毒系数CTC小于80,表现为拮抗作用;其他6 个混剂配比的共毒系数CTC大于80 且小于120,表现为相加作用。可见,吡唑醚菌酯与咯菌腈复配不具有增效作用,适用单剂防控薏苡叶斑病。

表6 吡唑醚菌酯与咯菌腈对薏苡叶斑病病原菌的联合作用Table 6 Toxicity of pyraclostrobin and fludioxonil combination on C. coicis
3 讨论与结论
病原菌的生物学特性是监控病害发生的前提条件,目前国内尚未有薏苡叶斑病病原菌(Curvularia coicis)的生物学特性研究的报道。本研究表明,该病原菌适宜在25~30 ℃下生长,最适生长温度为25 ℃,与李润根等[10]报道百合叶斑菌(C. pseudobrachyspora)的生长温度相似;在pH 为4~10 均能生长,在pH 为7~9 生长较快,最适pH 为8,与郑肖兰等[11]报道玉米弯孢霉叶斑病菌(C. lunata)的生长pH 范围相似;该病原菌能利用供试的5 种碳源和5种氮源,最佳碳源为淀粉,最佳氮源为蛋白胨;在全黑暗、黑暗光照交替和全光照3 种培养条件下菌丝生长速度差异不显著,与徐辉等[12]报道水稻弯孢叶斑病病原(C. lunata)的生长光照条件研究结果相符。
薏米叶斑病的防治以化学防治为主,但长期使用传统的杀菌剂,如多菌灵、百菌清等,易导致抗药性的产生。因此,需对市面上可用于防治薏苡叶斑病的药剂进行毒力评估,以期找到具有防控潜力的药剂。同时,通过农药复配技术可以达到减药增效,延缓抗药性产生的作用[13−14]。本研究评估了3 种类型杀菌剂对薏苡叶斑病病原菌(C. coicis)的毒力及其联合作用。试验结果显示,氯氟醚菌唑、吡唑醚菌酯和咯菌腈这3 类防治药剂对薏苡叶斑病病原菌均有很好的抑制作用,毒力指数分别为多菌灵对照的234.83、97.84、84.97 倍;进一步评估它们之间复配联合作用,发现仅氯氟醚菌唑与吡唑醚菌酯复配联合作用表现为增效作用,其中5∶5 配比的增效作用最显著,共毒系数CTC达221.85;而氯氟醚菌唑与咯菌腈、吡唑醚菌酯与咯菌腈这2 种复配联合作用均未表现出增效作用。
可见,氯氟醚菌唑、吡唑醚菌酯和咯菌腈均具有较好的防控潜力,在实际应用中可替代多菌灵使用;氯氟醚菌唑与吡唑醚菌酯合理比例复配对抑制薏苡叶斑病菌有明显的增效作用,有助于提高薏苡叶斑病的防治效果,降低生产成本。后续试验中,可进一步评估氯氟醚菌唑与吡唑醚菌酯复配混剂在应用时,药剂残留及对非靶标生物的影响等指标,为薏苡叶斑病防治药剂的选择、应用及延缓抗药性的产生提供参考。

