Pae下调miR-106a-5p/PTEN对白血病细胞增殖、凋亡的影响
张彦芬,高大,易媛媛,赵荣伟
(1. 内蒙古医科大学附属医院 血液科,呼和浩特 010050;2.内蒙古医科大学附属医院 妇产科,呼和浩特 010050)
白血病是儿童和青少年最常见的恶性血液系统疾病之一[1]。克隆性白血病细胞由于分化障碍,增殖失控,凋亡受阻等导致其在骨髓或其他造血组织中异常集聚,并浸润其他组织和器官,同时抑制造血组织的正常功能。目前对白血病的主要治疗方法有放疗、化疗和异基因造血干细胞移植等[2]。尽管化疗和异体移植的联合应用提高了疗效,但化疗药物的副作用如导致心律不齐,加剧弥散性血管内凝血以及产生耐药性等降低了疾病的治愈率[2]。因此,寻找更加安全有效的治疗药物迫在眉睫。丹皮酚(paeonol,Pae),又称牡丹酚或芍药醇,是牡丹根皮和徐长卿的主要活性成分,具有免疫调节和心脑血管保护等多种药理作用[3]。有体外实验表明,Pae可杀伤多种恶性肿瘤细胞[4],有可能成为恶性肿瘤治疗药物。孙国平等[5]发现,Pae可抑制白血病细胞增殖,但其对白血病细胞凋亡的影响尚未见报道,而它杀伤白血病细胞的机制仍不清楚。第10号染色体缺失的磷酸酶及张力蛋白同源物(phosphatase and tension homologue deleted on chromosome 10,PTEN)作为抑癌基因,过表达可抑制白血病细胞的增殖、迁移和侵袭,促进细胞凋亡并导致细胞周期阻滞于G0/G1期[6-7]。miR-106a在多种白血病细胞系中表达上调,其在白血病发生、发展过程中可能发挥一定作用[8]。研究通过体外实验探究Pae对白血病细胞增殖、凋亡的影响,进一步观察Pae对miR-106a-5p和PTEN表达的影响,探究其作用机制,以期为白血病的临床治疗提供新方法和新思路。
1 材料与方法
1.1 实验材料、试剂与仪器收集2016年1月至2017年1月于内蒙古医科大学附属医院血液科收治的初诊白血病患者8例,经血象和骨髓病理活检临床确诊。白血病细胞K562,购自中国科学院上海细胞库;Pae试剂,购自上海谱振生物科技有限公司;RPMI 1640培养液,购自Hyclone公司;LipofectamineTM2000转染试剂和TRIzol抽提试剂,购自Invitrogen公司。抗miR-106a-5p、miR-NC抗体、miR-106a-5p mimics、miR-NC、siPTEN和siNC,购自北京华大基因研究中心有限公司;双荧光素酶报告基因检测试剂盒,购自Promega公司。MTT试剂、二甲基亚砜(dimethyl sulfoxide,DMSO)、Annexin V-FITC/PI试剂盒、放射免疫沉淀实验(radioimmunoprecipitation assay,RIPA)裂解液、BCA蛋白定量试剂盒、PVDF膜、Western blotting洗涤液及封闭液,购自北京索莱宝科技有限公司。兔抗人PTEN、GAPDH、CyclinD1、Bcl-2、p21及Bax多克隆抗体,购自Santa Cruz公司;羊抗兔IgG-HRP,购自武汉博士德生物工程有限公司。凝胶成像系统,来自伯乐生命医学产品(上海)有限公司;荧光定量PCR仪,来自ABI公司;FCM,来自BD公司;酶标仪,来自AWARENESS TECHNOLOGY INC公司。
1.2 细胞的培养、转染与分组参照文献[9]方法分离初诊白血病患者原代白血病细胞。使用RPMI 1640培养液分别培养该原代白血病细胞及K562细胞。细胞培养条件为湿度95%,温度37 ℃,CO2体积分数5%。当细胞铺底率至约80%时,用胰蛋白酶消化后传代。
药物处理:取对数生长期K562细胞,用RPMI 1640完全培养液调整密度,以2×105个/孔细胞密度接种于96孔板,于细胞培养箱培养24 h。分别给予不同浓度的Pae溶液[5](0、15、30、60 mg/mL)处理,依次标记为Con组、Pae 15 mg/L组、30 mg/L组和60 mg/L组,培养24、48及72 h后,进行下一步研究。
细胞转染:取对数生长期的白血病细胞K562,用RPMI 1640完全培养液调整细胞密度,以2×105个/孔接种于96孔板。当细胞铺底率达60%时,用LipofectamineTM2000脂质体转染技术将抗miR-106a-5p和抗miR-NC抗体分别转染至K562细胞,依次命名为抗miR-106a-5p组和抗miR-NC组。将2组细胞置于培养箱常规培养6 h,更换新鲜培养液后继续培养,以待后续研究。按照上述转染方法分别将miR-106a-5p mimics、miR-NC、siPTEN和siNC转染至K562细胞,用30 mg/mL Pae溶液处理,并依次分为Pae+miR-106a-5p组、Pae+miR-NC组、Pae+siPTEN组和Pae+siNC组,培养24、48及72 h后进行后续研究。
1.3 qRT-PCR检测用TRIzol试剂分别抽提各组K562细胞总RNA,检测其纯度;反转录为cDNA,进行qRT-PCR扩增。引物由北京华大基因研究中心有限公司合成,序列如下(表1)。miR-106a-5p和PTENmRNA的检测分别以U6和GAPDH为内参,其相对表达量采用2-△△Ct法计算。

表1 引物序列
1.4 Western blotting检测药物处理或转染后48 h,收集各组K562细胞,用RIPA裂解液裂解,提取总蛋白。通过BCA蛋白定量试剂盒调整蛋白浓度。沸水浴3~5 min使蛋白充分变性,冷却至室温备用。取30 μg变性蛋白,进行SDS-PAGE,结束后转移至PVDF膜。用洗涤液洗膜,后用封闭液室温封闭1 h。除去封闭液,加入抗PTEN、GAPDH、CyclinD1、Bcl-2、p21及Bax一抗(1∶1 000),置侧摆摇床4 ℃孵育过夜。洗涤液洗膜后,加入相应二抗(1∶1 000)室温孵育2 h,化学发光法显色。凝胶成像系统采集图像,分析目的条带灰度值。
1.5 MTT法检测取转染及未转染K562细胞,接种于96孔板,按照1.2分组给予不同剂量药物处理,培养24、48及72 h后于每孔加入MTT溶液(20 μL/孔);孵育4 h后,吸净孔内液体,每孔加入150 μL DMSO,摇床均摇10 min至其完全溶解。酶标仪检测光密度D(490 nm)。
1.6 FACS检测取药物处理或转染48 h的各组K562细胞,胰蛋白酶消化,离心弃上清液后收集各组细胞,PBS漂洗2次。加入适量结合缓冲液重悬细胞,按照Annexin V-FITC/PI试剂盒说明书依次加入5 μL Annexin V-FITC和5 μL PI,混匀后FCM检测细胞凋亡情况。
丁珰这个人物是很值得深入挖掘的。她倾心于风流倜傥的石中玉,憎厌这不解风情的石破天。道德品质,在他心中实在无关紧要。她喜欢刺激的人生,喜欢风流的浪子。她将自己的爱情看得比什么都重要,却把别人的爱情踩在脚底。她的爱是如此的狂烈,而又是如此的虚无,像极了她的小名,叮叮当当,热闹而又缥缈。
1.7 双荧光素酶报告基因实验通过靶基因预测数据库TargetScanHuman 7.1网站(http://www.targetscan.org/vert_71/)预测miR-106a-5p的靶基因。查询发现miR-106a-5p的5’端能与PTEN的3’UTR特异性结合,猜测PTEN是miR-106a-5p的靶基因。为验证这一预测,构建野生型WT-PTEN和突变型MUT-PTEN的PTEN3’UTR荧光素酶报告基因载体。按1.2中LipofectamineTM2000脂质体转染法将miR-106a-5p和miR-NC分别与WT-PTEN和MUT-PTEN共转染至K562细胞,于细胞培养箱(湿度95%,温度37 ℃,CO2体积分数5%)培养48 h。收集各组细胞,按照双荧光素酶报告基因检测试剂盒说明书检测各组细胞PTEN的表达。

2 结果
2.1 Pae对初诊白血病患者原代白血病细胞增殖、凋亡的影响与Con组相比,Pae处理24 h后各组原代白血病细胞的增殖能力差异不显著;与Con组相比,Pae处理48、72 h后各组白血病细胞增殖能力显著下降(P<0.05,图1A)。与Con组相比,Pae 15 mg/L组、30 mg/L组及60 mg/L组原代白血病细胞的凋亡率显著升高(P<0.05,图1B)。

注:A. Pae对初诊白血病患者原代白血病细胞增殖能力的影响;B. Pae对初诊白血病患者原代白血病细胞凋亡率的影响。与Con组比较,*P<0.05。图1 Pae对初诊白血病患者原代白血病细胞增殖和凋亡的影响
2.2 Pae对白血病细胞K562增殖、凋亡的影响与Con组相比,Pae处理24 h后, K562细胞的增殖能力变化不显著;Pae处理48和72 h后,各组K562细胞增殖能力显著下降(P<0.05,图2A)。与Con组相比,15 mg/L组K562细胞凋亡率[(6.51±0.13)%vs(14.06±0.60)%]显著升高,CyclinD1[(0.79±0.00)vs(0.68±0.00)]和Bcl-2[(0.92±0.00)vs(0.76±0.00)]表达水平均显著降低,p21[(0.21±0.00)vs(0.37±0.00)]和Bax[(0.16±0.00)vs(0.31±0.00)]表达水平均显著升高;与Con组相比,30 mg/L组K562细胞凋亡率[(6.51±0.13)%vs(24.26±0.92)%]显著升高,CyclinD1[(0.79±0.00)vs(0.46±0.00)]和Bcl-2[(0.92±0.00)vs(0.51±0.00)]表达水平均显著降低,p21[(0.21±0.00)vs(0.57±0.00)]和Bax[(0.16±0.00)vs(0.47±0.00)]表达水平均显著升高;与Con组相比,60 mg/L组K562细胞凋亡率[(6.51±0.13)%vs(28.66±0.18)%]显著升高,CyclinD1[(0.79±0.00)vs(0.33±0.00)]和Bcl-2[(0.92±0.00)vs(0.36±0.00)]表达水平均显著降低,p21[(0.21±0.00)vs(0.78±0.00)]和Bax[(0.16±0.00)vs(0.74±0.00)]表达水平均显著升高。(均P<0.05, 图2B~2E)
以上结果表明,Pae可抑制白血病细胞K562增殖,促进细胞凋亡,其抑制或促进程度与Pae的浓度存在一定剂量效应。
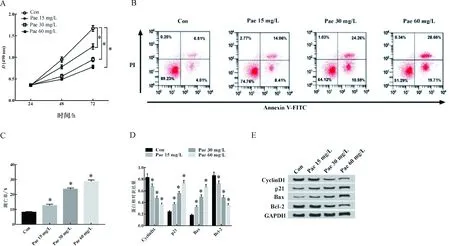
注:A. Pae对K562细胞增殖的影响;B~C. Pae对K562细胞凋亡的影响;D~E. Pae对K562细胞增殖、凋亡相关蛋白表达的影响。与Con组比较,*P<0.05 。图2 Pae对K562细胞增殖、凋亡及相关蛋白表达的影响
2.3 Pae对白血病细胞K562miR-106a-5p、PTEN表达的影响与Con组相比,Pae 15 mg/L组[(1.21±0.00)vs(0.99±0.00)]、30 mg/L组[(1.21±0.00)vs(0.50±0.00)]及60 mg/L组[(1.21±0.00)vs(0.41±0.00)]miR-106a-5p的表达水平显著降低;与Con组相比,Pae 15 mg/L组[(0.31±0.00)vs(0.47±0.00)]、30 mg/L组[(0.31±0.00)vs(0.75±0.00)]及60 mg/L组[(0.31±0.00)vs(0.83±0.00)]PTEN的表达水平显著升高。(均P<0.05, 图3A、3B)
以上结果表明,Pae可抑制白血病细胞K562miR-106a-5p的表达,促进PTEN的表达,其抑制或促进程度与Pae的浓度存在一定剂量效应。
以上结果表明,抑制miR-106a-5p表达可抑制白血病细胞K562的增殖,促进其凋亡并影响相关蛋白表达。

注:A. Pae对K562细胞miR-106a-5p mRNA表达的影响;B. Pae对K562细胞PTEN蛋白表达的影响。与Con组比较,*P<0.05。图3 Pae对K562细胞 miR-106a-5p、PTEN表达的影响
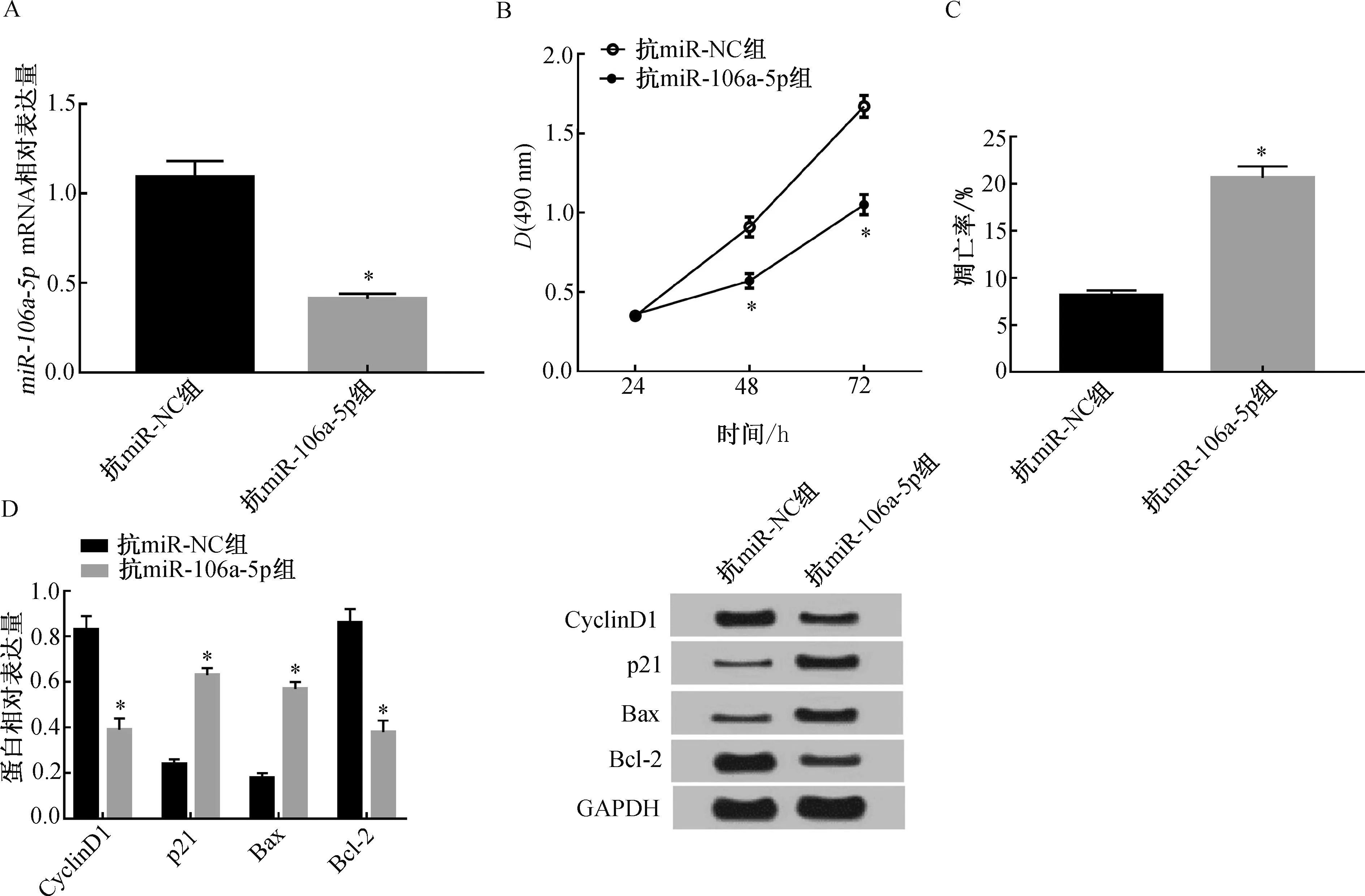
注:A. miR-106a-5p mRNA相对表达量;B. 抑制miR-106a-5p表达对白血病细胞K562增殖的影响;C. 抑制miR-106a-5p表达对K562细胞凋亡的影响;D.抑制miR-106a-5p表达对K562细胞增殖、凋亡相关蛋白表达的影响。与抗miR-NC组比较,*P<0.05。图4 抑制miR-106a-5p表达对白血病细胞K562增殖、凋亡及相关蛋白表达的影响
2.5 过表达miR-106a-5p对Pae作用下白血病细胞K562增殖、凋亡的影响与Con组相比,Pae组K562细胞miR-106a-5p表达水平显著降低[(1.21±0.00)vs(0.48±0.00),P<0.05];与Pae+miR-NC组相比, Pae+miR-106a-5p组K562细胞miR-106a-5p表达水平显著升高[(0.46±0.00)vs(0.79±0.00),P<0.05]。(图5A)
Pae作用24 h后,Con组、Pae组、Pae+miR-NC组和Pae+miR-106a-5p组K562细胞增殖能力无显著变化(P>0.05),48和72 h后,Pae组K562细胞增殖能力显著低于Con组,Pae+miR-106a-5p组增殖能力显著高于Pae+miR-NC组(均P<0.05,图5B)。与Con组相比,Pae组K562细胞凋亡率显著增加[(6.51±0.13)%vs(24.26±0.92)%],CyclinD1和Bcl-2的表达水平显著降低[(0.79±0.00)vs(0.46±0.00)、(0.92±0.00)vs(0.51±0.00)],p21和Bax的表达水平显著升高[(0.21±0.00)vs(0.77±0.00)、(0.16±0.00)vs(0.67±0.00)](均P<0.05,图5C、5D)。与Pae+miR-NC组相比,Pae+miR-106a-5p组K562细胞凋亡率显著下降[(24.00±0.38)%vs(15.69±0.76)%],CyclinD1和Bcl-2的表达水平显著升高[(0.37±0.00)vs(0.64±0.00)、(0.33±0.00)vs(0.62±0.00)],p21和Bax的表达水平显著降低[(0.78±0.00)vs(0.41±0.00)、(0.68±0.00)vs(0.40±0.00)](均P<0.05,图5C、5D)。以上结果表明,过表达miR-106a-5p可显著逆转Pae对白血病细胞K562的增殖抑制和凋亡促进作用。

注:A. miR-106a-5p相对表达量;B. 过表达miR-106a-5p可逆转Pae对K562细胞增殖的抑制作用;C. 过表达miR-106a-5p可逆转Pae对K562细胞凋亡的促进作用;D. 过表达miR-106a-5p对Pae作用下K562细胞增殖、凋亡相关蛋白表达的影响。与Con组比较,*P<0.05;与Pae+miR-NC组比较,#P<0.05。图5 过表达miR-106a-5p可逆转Pae对白血病细胞K562增殖、凋亡的影响
2.6 miR-106a-5p靶向PTENmiR-106a-5p与PTEN3’UTR存在特异性结合位点(图6A)。与miR-NC+WT-PTEN共转染组比较,miR-106a-5p mimics+WT-PTEN共转染组K562细胞荧光素酶活性显著降低[(1.10±0.00)vs(0.41±0.00),P<0.05,图6B]。与miR-NC+MUT-PTEN共转染组比较,miR-106a-5p mimics+MUT-PTEN共转染组K562细胞荧光素酶活性差异无统计学意义[(1.09±0.00)vs(1.09±0.00),P>0.05, 图6B]。与miR-NC组相比,miR-106a-5p组K562细胞PTEN表达水平显著降低[(0.39±0.00)vs(0.07±0.00)];与抗miR-NC组相比,抗miR-106a-5p组K562细胞PTEN表达水平显著升高[(0.41±0.00)vs(0.82±0.00)]。(均P<0.05,图6C)
以上结果表明,在K562细胞中,miR-106a-5p可负调控PTEN的表达。

注:A. PTEN的3’UTR含miR-106a-5p的互补核苷酸序列;B. 双荧光素酶报告基因实验;C. miR-106a-5p调控PTEN的表达。与miR-NC组比较,*P<0.05;与抗miR-NC组比较,#P<0.05。图6 miR-106a-5p靶向调控PTEN的表达
2.7 抑制PTEN表达对Pae作用下白血病细胞K562增殖、凋亡的影响Pae作用24 h后,Con组、Pae组、Pae+siNC组和Pae+siPTEN组K562细胞增殖能力变化差异无统计学意义(P>0.05);48、72 h后,Pae组细胞增殖能力显著低于Con组,Pae+siPTEN组细胞增殖能力显著高于Pae+siNC组(均P<0.05,图7A)。
与Con组比较,Pae组细胞凋亡率显著升高[(6.51±0.13)%vs(24.26±0.92)%],CyclinD1和Bcl-2表达水平显著降低[(0.79±0.00)vs(0.46±0.00)、(0.92±0.00)vs(0.51±0.00)],PTEN、p21和Bax表达水平显著升高[(0.31±0.00)vs(0.74±0.00)、(0.21±0.00)vs(0.74±0.00)和(0.16±0.00)vs(0.67±0.00)];与Pae+siNC组比较,Pae+siPTEN组K562细胞凋亡率显著降低[(24.37±1.17)%vs(12.80±0.26)%],CyclinD1和Bcl-2表达水平显著升高[(0.47±0.00)vs(0.64±0.00)、(0.51±0.00)vs(0.69±0.00)],PTEN、p21和Bax表达水平显著降低[(0.82±0.00)vs(0.58±0.00)、(0.73±0.00)vs(0.49±0.00)、(0.68±0.00)vs(0.39±0.00)]。(均P<0.05,图7B~7C)
可见,抑制PTEN表达可显著逆转Pae对白血病细胞K562的增殖抑制和凋亡促进作用。
3 讨论
近年来,随着对中药研究的不断深入,Pae的抗肿瘤活性被不断揭示。Pae在体内外均具有抑制前列腺癌细胞生长的作用[10],其还可诱导卵巢癌细胞的凋亡[11]。Pae与阿奇霉素的联合应用可抑制乳腺癌细胞增殖并促进肿瘤细胞凋亡[12]。Pae还可通过下调MMP-2和MMP-9蛋白表达,抑制人胃癌BGC823细胞生长、迁移和侵袭[13]。研究首先鉴定其对白血病患者原代白血病细胞的影响,结果显示Pae呈浓度依赖性地抑制细胞增殖,促进细胞凋亡。随后,以白血病细胞K562为研究对象的进一步功能研究发现,Pae呈浓度依赖性地抑制K562细胞增殖,促进细胞凋亡,这与孙国平等[5]的研究结果相一致。同时,qRT-PCR和Western blotting检测结果显示,Pae呈浓度依赖性地抑制CyclinD1和Bcl-2表达,促进p21和Bax表达,与其抗增殖、促凋亡作用吻合。此外,Pae呈浓度依赖性地抑制miR-106a-5p表达,促进PTEN表达。研究结果提示,Pae对白血病细胞的增殖抑制作用和凋亡促进作用可能与调控miR-106a-5p和PTEN表达有关。

注:A. 抑制PTEN表达可逆转Pae对K562细胞增殖的抑制作用;B. 抑制PTEN表达可逆转Pae对K562细胞凋亡的促进作用;C. 抑制PTEN表达对Pae作用下K562细胞增殖、凋亡相关蛋白表达的影响。与Con组比较,*P<0.05;与Pae+siNC组比较,#P<0.05。图7 抑制PTEN表达可逆转Pae对白血病细胞K562增殖、凋亡及相关蛋白表达的影响
miR-106a-5p为miR-17家族成员。大量研究表明,miR-106a-5p在胃癌[14]、结肠癌[15]等多种肿瘤组织和细胞中异常低表达,参与调控肿瘤的发生发展。例如,miR-106a-5p通过靶向PAK5抑制肾癌细胞的迁移和侵袭[16],还可靶向HMGA2抑制骨肉瘤细胞的增殖、迁移和侵袭[17]。张文娟[18]通过基因芯片技术证实,抗肿瘤药物DMC可使慢性粒细胞白血病细胞中miR-106a-5p表达下调,证明miRNA在白血病的发展中发挥重要作用。研究显示,抑制miR-106a-5p表达后,K562细胞的增殖能力显著降低,凋亡率显著增加,CyclinD1和Bcl-2的表达显著降低,p21和Bax的表达显著增加,与Pae对白血病细胞的作用一致。以上研究结果提示,Pae通过下调miR-106a-5p表达抑制白血病细胞增殖,促进其凋亡,而也有类似研究证明miR-106a-5p在不同肿瘤中发挥不同作用。
PTEN是最早发现的具有双特异磷酸酶活性的抑癌基因。有研究表明,急性髓细胞白血病和急性淋巴细胞白血病中PTEN表达均显著下调[19-20]。慢性淋巴细胞白血病中PTEN的低表达可能与miR-26a和miR-214的异常表达有关[21]。miR-21还可通过调控PTEN/AKT信号通路抑制白血病细胞K562的增殖和迁移[22]。双荧光素酶报告基因实验和Western blotting检测结果显示,PTEN是miR-106a-5p的靶基因,miR-106a-5p可负调控PTEN的表达。由此提示,miR-106a-5p/PTEN信号通路在Pae针对白血病细胞增殖和凋亡的调控中发挥一定作用。为进一步证明Pae是通过下调miR-106a-5p/PTEN轴调控K562细胞增殖及凋亡的,将miR-106a-5p mimics或siPTEN转染至K562细胞,随后用Pae处理,研究发现过表达miR-106a-5p或抑制PTEN表达可逆转Pae对白血病细胞增殖、凋亡的影响。以上研究结果提示,Pae通过miR-106a-5p/PTEN轴参与调控白血病细胞的增殖和凋亡。然而,除miR-106a-5p/PTEN轴外,还可能存在其他调控途径,这些问题将是进一步研究的重点。
综上所述,Pae可通过下调miR-106a-5p/PTEN信号通路蛋白抑制白血病细胞的增殖,促进其凋亡,这为白血病的临床治疗提供了新的方法和思路。

