GDF-15对糖尿病小鼠肝损伤保护作用的实验研究
张泓娇,王小梅,王雅光,田鹤,穆长征
(1.锦州医科大学组织学与胚胎学教研室;2.锦州医科大学附属第一医院;3.锦州医科大学研究生学院,辽宁 锦州 121000)
糖尿病严重危害着人们的健康,其中2型糖尿病(type 2 diabete,T2DM)患者居多[1]。肝损伤是糖尿病并发症之一[2]。T2DM患者由于高血糖症出现,导致蛋白功能丧失,进而使肝脏氧化损伤。转氨酶升高是肝脏损伤的判断指标之一,肝脏中最常见的转氨酶是丙氨酸转移酶(alanine transferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST);已糖激酶(hexokinase,HK)和丙酮酸激酶(pyruvate kinase,PK)是调控糖酵解的酶,糖酵解是维持血糖稳定的重要因素,HK、PK升高会导致血糖升高,血糖升高会使炎症标志物升高,最终使活性氧(ROS)升高。丙二醛(malondialdehyde,MDA)作为氧化物的代表,可损伤肝细胞膜以及线粒体膜,从而损伤肝细胞。肝细胞损伤后,有大量的细胞因子产生,如肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)等。
生长分化因子-15[3](growth differentiation factor-15,GDF-15)是一种氧化应激蛋白。在正常状况下,GDF-15大量表达在胎盘及前列腺等少数的组织。在肿瘤、炎症、心血管疾病以及外伤等各种应激状态下,GDF-15会大量表达[4]。目前,有实验证明它是肝脏损伤的新型标志物,并且通过免疫抑制、抗凋亡、抗炎和促进氧化代谢等方面对肝脏起到保护作用[5]。临床研究报道血清中GDF-15水平可作为一个有效的生物标志物,用于评估肝脏纤维化和慢性肝病的严重程度[6]。本文将通过炎症因子的检测等方法进一步探讨GDF-15可能对糖尿病诱导的肝损伤的保护作用。
1 资料与方法
1.1 模型建立及分组
C57BL/6J雄性小鼠(4~8周龄)60只(锦州医科大学实验动物中心提供),体重18~22 g,适应性饲养1 w,随机选取10只作为正常对照组,其余50只小鼠高脂饮食喂养2 w,腹腔注射STZ按(40 mg/kg体重),每天监测血糖,当小鼠空腹血糖达到(≥12 mmol/L)时,为造模成功[7]。按体重选取状态较好的小鼠30只随机分为3组,继续高脂饮食喂养30 d,具体分组及处理方法,见表1。
表1 动物分组及处理因素
1.2 取材及标本制备
小鼠眼眶取血,EP管收集血液,4 ℃冰箱静止2 h,低温离心取上清,-80 ℃冰箱保存备用。取血后小鼠灌流,立即取出肝组织,一部分称重-80 ℃冰箱保存备用;另一部分修剪成1 cm3小块,多聚甲醛固定,石蜡包埋、切片,用于HE和免疫组织化学染色。
1.3 血糖和体重监测
每天监测小鼠空腹血糖和体重并做记录,取体重和血糖变化最大的几天(第1、3、7、14、30天)作为血糖和体重变化依据。
1.4 血清中ALT和AST含量的测定
取-80 ℃冰箱保存备用的血清,按照试剂盒说明书进行ALT和AST水平的测定。
1.5 肝组织中TG、TC、SOD、MDA、HK及PK的测定
取各组小鼠冻存的肝组织40 mg,按肝组织重量(g)∶体积(mL)=1∶9的比例加入360 mL的生理盐水,制成匀浆,4 ℃离心10 min,取上清即为10%的肝匀浆液,将其分成两份,一份用于检测TG、TC、SOD、MDA值;另一份用生理盐水1∶9比例稀释成1%肝组织匀浆液,测定HK、PK酶的活力,卡马斯亮蓝试剂盒测定蛋白浓度。
1.6 ELISA检测血清和肝组织中TNF-α、IL-1β和IL-6含量
取-80 ℃冰箱保存备用的血清和冻存的肝组织,ELISA检测血清和肝组织中TNF-α、IL-1β和IL-6含量,具体检测方法按试剂说明书操作。
1.7 HE染色观察肝组织形态学改变
石蜡切片二甲苯脱腊,梯度酒精浸水,苏木素伊红染色,脱水,中性树胶封片,光镜下观察肝细胞形态改变并摄像。
1.8 免疫组化检测肝组织中TNF-α、IL-1β和IL-6蛋白表达
采用二步法 DAB 显色检测。操作步骤按试剂盒说明书进行,其中一抗稀释度为1∶200,以已知阳性片作为阳性对照,以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。
1.9 Western Blot方法检测肝组织中TNF-α、IL-1β和IL-6蛋白表达
取冻存的肝组织,组织裂解,BCA法测定蛋白浓度,制胶,上样,电泳,转膜,封闭后加一抗,4 ℃孵育过夜,充分洗膜后,室温下二抗孵育 1 h,使用凝胶成像系统进行拍照,并用 Image J软件进行分析,结果以目的蛋白与β-actin相对表达量表示。
1.10 统计学方法
用SPSS 20.0统计软件包对实验数据进行描述性统计分析、方差分析等统计学处理,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠体重检测结果
各组小鼠体重检测结果:正常组小鼠体重随饲养时间增加;与正常组比较,模型组和PBS组小鼠体重随时间明显下降,差异有统计学意义(P<0.01);与模型组比较,GDF-15组小鼠体重随时间增加明显上升,差异有统计学意义(P<0.01),见表2。
2.2 各组小鼠血糖检测结果
各组小鼠血糖检测结果:正常组小鼠血糖趋于稳定状态;与正常组比较,模型组和PBS组小鼠血糖随时间明显上升,差异有统计学意义(P<0.01);与模型组比较,GDF-15组小鼠血糖随时间增加明显下降,差异有统计学意义(P<0.01),见表3。

表2 各组小鼠体重的变化

表3 各组小鼠血糖的变化
2.3 各组小鼠血清中ALT和AST检测结果
各组小鼠血清中ALT和AST检测结果:与正常组比较,模型组和PBS组小鼠血清中ALT和AST明显增加,差异有统计学意义(P<0.01);与模型组比较,GDF-15组小鼠血清中ALT和AST明显下降,差异有统计学意义(P<0.01),见表4。

表4 各组小鼠血清中ALT和AST的变化
2.4 各组小鼠肝组织中TG、TC、SOD、MDA、HK及PK检测结果
各组小鼠肝组织中TG、TC、SOD、MDA、HK及PK检测结果:与正常组比较,模型组和PBS组小鼠肝组织中TG、TC、MDA明显增加,SOD、HK、PK明显降低,差异有统计学意义(P<0.01);与模型组比较,GDF-15组小鼠肝组织中TG、TC、MDA明显降低,SOD、HK、PK明显增加,差异有统计学意义(P<0.01),见表5。
2.5 各组小鼠HE染色结果
各组小鼠HE染色结果见图1。正常组肝细胞排列整齐,结构清晰,无病理改变;模型组和PBS组小鼠肝细胞出现大量脂肪空泡,提示糖尿病小鼠肝细胞中脂肪沉积;GDF-15组肝细胞中脂肪空泡明显减少。
2.6 各组小鼠血清和肝组织中TNF-α、IL-1β和IL-6检测结果
各组小鼠肝组织与血清中促炎因子(TNF-α、IL-1β、IL-6)检测结果:与正常组比较,模型组和PBS组小鼠肝组织与血清中TNF-α、IL-1β、IL-6明显增加,差异有统计学意义(P<0.01);与模型组比较,GDF-15组小鼠肝组织与血清中TNF-α、IL-1β、IL-6明显下降,差异有统计学意义(P<0.01),见表6~7。
2.7 各组小鼠免疫组化染色结果
各组小鼠免疫组化染色结果见图2~4。正常组TNF-α、IL-1β、IL-6在肝血窦低表达;模型组和PBS组TNF-α、IL-1β、IL-6在肝细胞胞质高表达;GDF-15组TNF-α在肝血窦低表达,肝细胞胞质中未见明显表达,IL-1β、IL-6在肝细胞胞质低表达。

表5 各组小鼠肝组织中TG、TC、MDA、SOD、HK、PK的变化

A代表正常组:肝细胞结构清晰正常;B代表模型组:肝细胞内见大量脂肪空泡;C代表PBS组:肝细胞内见较多脂肪空泡;D代表GDF-15组:肝细胞内见极少量脂肪空泡
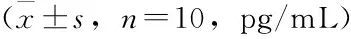
表6 各组小鼠肝组织中促炎因子的变化
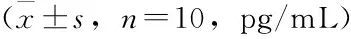
表7 各组小鼠血清中促炎因子的变化
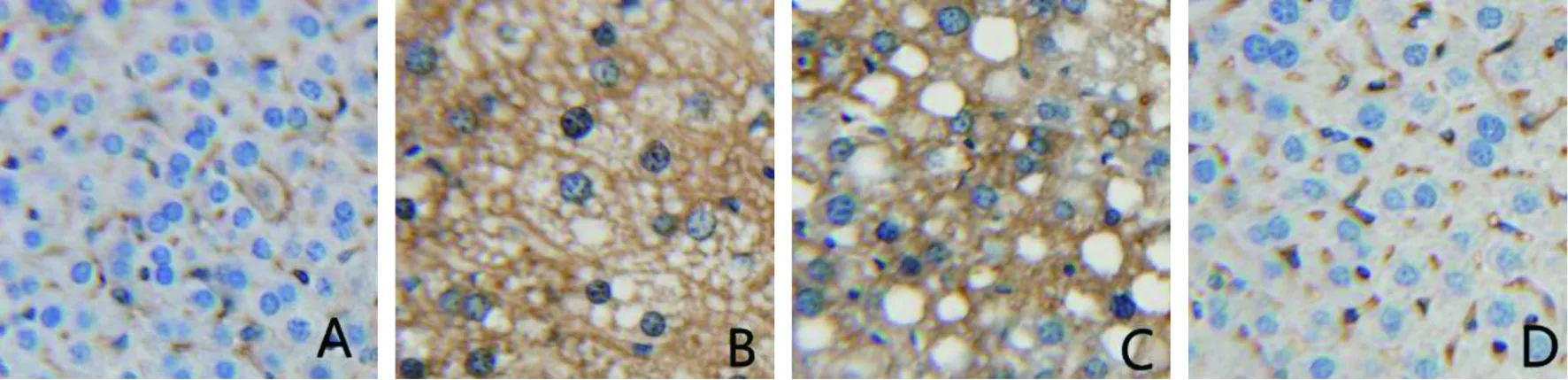
A代表正常组,TNF-α在肝血窦中低表达;B代表模型组,TNF-α在肝细胞胞质内大量表达;C代表PBS组,TNF-α在肝细胞胞质内高表达;D代表GDF-15组,TNF-α在肝血窦中少量表达

A代表正常组,IL-6在肝血窦中低表达;B代表模型组,IL-6在肝细胞胞质内大量表达;C代表PBS组,IL-6在肝细胞胞质内高表达;D代表GDF-15组,IL-6在肝血窦中有表达,在肝细胞胞质内少量表达
2.8 各组小鼠Western Blot检测结果
各组小鼠Western Blot检测结果:与正常组比较,模型组和PBS组小鼠肝组织中TNF-α、IL-1β、IL-6明显增加,差异有统计学意义(P<0.01);与模型组比较,GDF-15组小鼠肝组织中TNF-α、IL-1β、IL-6明显下降,差异有统计学意义(P<0.01),见图5、表8。

图5 各组小鼠肝组织TNF-α、IL-1β和IL-6的表达
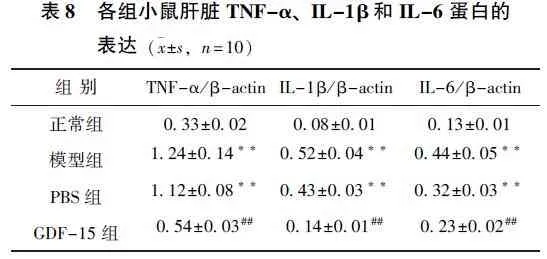
组 别TNF-α/β-actinIL-1β/β-actinIL-6/β-actin正常组0.33±0.020.08±0.010.13±0.01模型组1.24±0.14**0.52±0.04**0.44±0.05**PBS组 1.12±0.08**0.43±0.03**0.32±0.03**GDF-15组0.54±0.03##0.14±0.01##0.23±0.02##
3 讨 论
糖尿病肝损伤是糖尿病常见的并发症之一。对于T2DM的发病机制,目前还未见明确的阐述,主要涉及以下几个方面,如:糖脂质代谢异常、氧化应激、内质网应激、胰岛素抵抗、线粒体功能障碍、炎症反应[8-10]等等。研究显示,在糖尿病以及并发症中发挥重要作用的是炎症反应。当TNF-α、IL -1β、IL-6 等炎症细胞因子大量释放时,可导致糖尿病肝损伤加重,可由非酒精性脂肪肝病发展为非酒精性脂肪肝炎[11]。
转化生长因子GDF-15在体内有广泛的表达,其主要的分泌部位在肝脏和脂肪组织。有研究表明,GDF-15能使高脂饮食的小鼠体内脂肪含量降低[12],同时可使机体能量消耗水平增加;还可通过抑制巨噬细胞活化减少炎症的发生。机体炎症反应时GDF-15水平会有代偿性增高,推测GDF-15可能对机体具有一定保护作用[5]1-5。本实验利用高脂饮食联合STZ诱导C57BL/6J小鼠糖尿病模型,就有关GDF-15对糖尿病小鼠肝损伤的保护作用进行了初步探索研究。
ALT和AST可作为肝细胞损伤的诊断标准之一。本实验血清中ALT、AST的检测结果显示,模型组明显升高,GDF-15组明显下降,说明GDF-15可明显改善糖尿病小鼠的肝功能。肝组织中糖尿病脂质代谢指标TG、TC的检测结果显示:模型组明显升高,GDF-15组明显下降,说明GDF-15可改善糖尿病小鼠的脂质代谢。HK、PK是调控糖酵解的一种酶,肝组织中HK、PK的检测结果显示,模型组明显降低,而GDF-15组明显上升,说明GDF-15能维持糖尿病小鼠血糖的相对稳定。糖尿病小鼠抗氧化指标SOD、MDA的检测结果显示,模型组SOD表达明显降低而MDA表达明显升高,GDF-15组SOD表达明显升高而MDA表达明显降低,表明GDF-15可通过提高机体抗氧化来保护肝脏。
在各种促炎症因子中,TNF-α是最重要的促炎介质之一,在胰岛素抵抗的发生和T2DM的发病过程中发挥着重要作用。TNF-α主要产生于脂肪细胞和(或)外周组织,通过参与产生ROS和激活各种转录介导的通路,诱导组织特异性炎症。TNF-α水平升高诱导脂肪细胞和外周组织的胰岛素抵抗,通过丝氨酸磷酸化削弱胰岛素信号,从而导致T2DM的发展。有文献报道[13],通过抑制促炎细胞因子的表达来预防1型和2型糖尿病。本实验各组小鼠血清和肝组织中TNF-α、IL-6及IL-1β检测结果显示,模型组促炎症因子表达明显上升,GDF-15组促炎症因子表达明显下降;免疫组织化学染色和Western Bolt检测肝组织中NF-α、IL-6及IL-1β表达结果显示:模型组处于高表达,GDF-15组处于低表达。其实验结果与已有文献报道一致,说明GDF-15能抑制促炎细胞因子的表达。有关GDF-15介导改善糖尿病小鼠肝损伤的机制还需进一步的研究来阐明。

