土三七致肝损伤合并肝小静脉闭塞病1例并文献复习
张敏,李倩
(皖南医学院弋矶山医院,安徽 芜湖 241001)
药物性肝损伤是指使用各种处方药或非处方药导致的肝脏损伤,包括化学药物、生物制剂、中药、保健品和膳食补充剂,被定义为化学物质导致的肝脏损害[1]。土三七为菊科菊三七属植物,具有活血化瘀、消肿止痛的功效。在我国的云南、四川等地居多,民间偏方多作为日常保健品、创伤止痛、活血化瘀之用。但其内含有的吡咯烷生物碱(pyrrolizidine alkaloids,PAs)可对肝脏、肺以及神经系统有毒性作用[2]。据统计,发达国家药物性肝损伤的发病率在十万分之一到五千分之一之间,常见药源包括非甾体类抗炎药、抗生素,其中对乙酰氨基酚导致的急性肝衰竭约占50%[3]。我国相关医疗单位的统计数据显示药物性肝损伤约占肝损伤总住院患者的20%,中药占比最高(23%),其余为抗生素(17.6%)、抗肿瘤药物(15%)、激素(14%)、心血管类药物(10%)、非甾体类抗炎药(8.7%)、免疫抑制剂(4.7%)和镇静药(2.6%)[4]。中药导致的高发病率与以下几点相关[5]。首先,中药多为汤剂,其成分复杂,致肝损伤的具体药物来源很难测定;其次,许多中草药和民间偏方无临床安全性测试就被广泛使用;最后保健品和膳食补充剂市场繁杂,购买途径容易、多样。就目前而言,药物性肝损伤的发病率呈现出逐年上升的趋势,已成为重大公共卫生问题。药物性肝损伤作为最常见的药物副作用之一,其病因多样,临床表现复杂,与其他肝脏疾病难以区分,严重时可以导致急性肝衰竭甚至死亡。但目前缺乏简便、特异的检测指标,对临床医师的诊疗工作提出了巨大的挑战。有鉴于此,美国胃肠病学学会在2014年首先发布了关于药物性肝损伤的诊疗指南。中国肝病学会也起草并不断更新了一份指南,旨在规范我国药物性肝损伤的诊治[1]257-274。一方面我国人口基数大,使用的药物数量和种类相对较多、获得药物的途径多样且药物滥用现象严重。另一方面,人们对于药物的安全性认识不足均使我国药物性肝损伤的发病率不断上升[6]。为了强化临床医师对药物性肝损伤的认识,避免诊疗误区,现对我科收治的1例因服用土三七导致药物性肝损伤的患者进行如下回顾报道。
1 病例资料
患者,男,64岁,曾因畏寒、发热、腹胀半月余至当地县级医院就诊,明确诊断为血吸虫性肝病,经治疗肝功能正常后好转出院。因听信当地偏方以土三七泡酒每日饮用有保肝之效(药材经我院药剂科鉴定为菊科植物菊三七的根茎,又称土三七,具有活血化瘀之效)。患者每日中午、晚上饭前分别饮用药酒约200 g。20多天前突然出现腹胀,无其他不适症状。患者自觉不影响日常生活,未予重视并坚持服用药酒。后症状逐渐加重不能耐受,且出现腹痛、恶心、食欲下降及胸闷,遂至当地医院就诊,行胃镜检查未见明显异常,查腹部B超示:腹腔大量积液。经保肝、利尿治疗后症状不能缓解,且有继续加重的趋势,为进一步诊治转至我院。患者否认近期有外出旅游史和自行使用其他药物的情况,否认慢性病及传染病史。入院询问病史后嘱患者立即停用药酒。
体格检查:皮肤粘膜无黄染,巩膜轻度黄染,淋巴结无肿大。腹膨隆、广泛压痛,肝脏超过肋缘2 cm、下缘饱满,脾肋下未及,听诊肠鸣音正常。实验室检查:白蛋白31.7 g/L、总胆红素42.92 μmol/L、谷草转氨酶224 U/L、谷丙转氨酶290 U/L,患者白细胞数、血小板数正常,红细胞3.78×1012/L、血红蛋白110 g/L,凝血酶原时间15.2 s,国际标准化比值1.32,凝血酶原时间活度62%,CA125 671 U/mL。腹部CT检查示:肝脏弥漫性低密度改变,增强后呈地图样改变,考虑炎性改变可能;腹盆腔积液。腹部MRI显示病灶主要位于汇管区,沿肝静脉、胆管走行分布,3支肝静脉明显变细、门静脉正常,见图1。结合患者服用药酒史,根据中华医学会对肝小静脉闭塞病的专家共识诊断标准对患者做此初步诊断。因患者症状严重不能耐受,先行腹腔置管引流改善症状。考虑为药物性肝损伤,予以异丙草酸镁保肝、抗生素抗感染及营养支持治疗,针对肝小静脉闭塞病予以低分子肝素抗凝,在初步诊断确立、已积极采取相关治疗措施的基础上需排除其他可能的病因。包括:(1)病毒性肝炎:患者肝炎全套示乙肝疫苗接种后获得抗体,既往戊肝感染史已处于恢复期,排除病毒性肝炎可能;(2)自身免疫性肝炎:患者免疫全套均阴性予以排除;(3)消化系统恶性肿瘤:患者为老年男性且肿瘤指标CA125轻度升高,但腹水常规、生化送检均为漏出液且多次送检脱落细胞均未见癌细胞。患者治疗2 w余后症状明显改善,复查肝功能:谷草转氨酶74 U/L、谷丙转氨酶70 U/L、总胆红素28.69 μmol/L。由于肝功能指标明显下降且患者自觉无症状,予以出院带药,嘱其1个月后复查。后门诊随诊肝功能完全正常,患者痊愈,见图2。

A、B、C代表三支肝静脉明显变细;D代表病灶主要位于汇管区
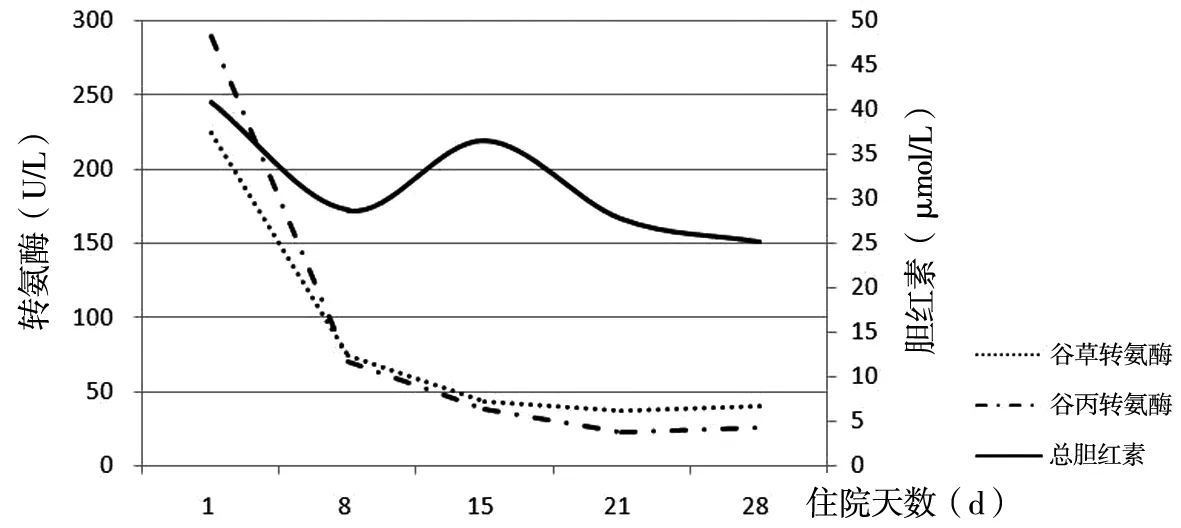
图2 入院后患者肝功能指标变化趋势图
2 讨 论
肝小静脉闭塞病又名肝窦阻塞综合征(hepatic veno-occlusive disease,HVOD),其最早的报道可追溯至1920年,是指由各种原因导致的肝小静脉、肝血窦和小叶间静脉内皮细胞水肿变性、 坏死、脱落形成微血栓栓塞血管,以肝脏肿大、黄疸、腹水为主要临床表现的一种肝脏血管性疾病[7]。该病预后差、病死率高、治疗手段有限[8-9]。在西方国家致病原因主要与骨髓造血干细胞移植相关;在我国主要与服用相关中药制剂相关,土三七相关制剂为其中最常见最突出的致病因素且相关报道逐年增多,占比高达50%~96.3%[10-11]。由于不正规的服用以及没有严格的医学监测和质量把控,发病群体多为农民及无业人员,常常在引发严重临床症状后才就医救治[12]。相关研究表明,肝小静脉闭塞病患者44%以上可完全康复,约23%死于肝功能衰竭[13]。土三七对肝脏的毒性作用机制尚未完全明确。本病例中患者肝损伤的发生机制主要与以下几点相关:首先,不饱和型PAs经胃肠道吸收入血转运至肝脏在肝细胞内经肝脏细胞色素P-450代谢后形成脱氢吡咯烷生物碱(dehydropyrrolizidine alkaloids,DHPAs)再进一步转化为脱氢裂碱(dehydroretronecine,DHR)。这两种物质会影响机体蛋白质和核酸的正常代谢从而诱使肝窦内皮细胞、库普弗细胞等窦状隙内皮细胞的死亡,这些死亡的细胞形成栓子阻塞相关血运,最终可致肝脏微循环障碍[14-16]。其次,有相关实验指出通过消耗谷胱甘肽导致肝窦和小静脉的内皮细胞DHPAs、DHR的损伤更加敏感从而使肝小静脉变细、阻塞致肝淤血、纤维化等[17-18]。最后,肝损伤后凝血功能的异常可能也参与肝细胞的损伤、纤维增生。有相关文献指出[19],土三七泡酒比泡水对肝脏毒性更高,高浓度的水煎液肝脏毒性明显高于低浓度的水煎液[20]。因此本例患者肝损伤更为严重。幸运的是,本病例患者肝损伤仅处于中度,治疗效果显著。
药物性肝损伤的具体发生机制复杂,到目前为止尚未得到完全认识。但基本可以归纳为药物本身及其代谢产物的直接损害以及肝细胞有害因子和保护因子的失衡。药物本身及其代谢产物导致的直接肝损伤具有剂量依赖性和可以被复制的特点,并可进一步经免疫和炎症反应引起氧化应激最终通过各种分子机制导致肝细胞损伤,如内质网应激反应可以促进药物性肝损伤的进程[21]。而特异性的肝损伤已知的机制主要包括基因多态性导致的相关代谢酶和转运蛋白功能的异常[22]。另外,人白细胞抗原多态性使肝脏对肝损药物更易产生适应性免疫反应从而引起肝脏损伤。
虽说肝穿刺活检是诊断肝小静脉闭塞病的金标准。但患者常常伴有腹水和凝血功能异常,患者往往难以接受创伤性的检查和导致出血、局部感染扩散等风险[23]。近年来,与药物性肝损伤相关的血清学标志物被不断发现和报道。如细胞角蛋白18凋亡片段(CK-18Fr)、人可溶性肿瘤坏死因子相关凋亡诱导配体等(sTRAIL)。但这些新型标志物对于诊断药物性肝损伤的特异性较差,还需要大量资料来验证其的临床价值[24]。随着影像技术的不断发展,HOVD患者往往具有较典型的影像学特点,如肝实质密度减低,延时期肝实质内呈“地图样”强化,肝脏密度不均匀减低,肝静脉显示不清或不显影[25]。因此临床诊断多结合临床表现及影像学结果[26-27]。另外,在药物性肝损伤中,肝细胞、胆管上皮细胞和肝内血管上皮细胞是主要受损细胞。在绝大多数的药物性肝损伤患者中,仅个别病例病理改变与已知药物相符,因此通过病理检测来与其他类型的肝损害相鉴别具有重要的意义。
药物性肝损伤的患者中,有肝病病史的患者超过6%,从而导致诊断为原先肝病的复发或加重的误诊率大大提高[19]1024-1026。因此全面的询问患者用药史和排除其他原因所致的肝损伤对于建立药物性肝损的诊断具有重要的意义。目前国际公认的HVOD诊断标准是Seatile标准和Baltimore标准[28]。由于国内HVOD病因主要以服用PAs植物引起者居多,因此,中华医学会消化病学分会肝胆疾病协作组参照以上标准,制定了《吡咯生物碱相关肝窦阻塞综合征诊断和治疗专家共识意见(2017年,南京)》诊断标准[29]:患者有 PAs药物服用史,且存在以下3项或通过病理确诊:(1)腹胀和(或)肝区疼痛、肝大和腹水;(2)TBIL升高或其他肝功能异常;(3)典型CT或MRI表现。有文章指出HVOD需着重注意与布加综合征、急性重型肝炎以及肝硬化失代偿期相鉴别[30]。在本病例中,虽然因患者拒绝接受相关有创检查缺乏病理学资料,通过结合我们对照此诊断标准可明确诊断。同时经治疗后患者相应的症状、体征迅速好转,病情控制良好等预后情况亦可逆向诊断。
本篇报道的病例随着人们对健康认识的不断提高逐渐减少,但对临床医生来说,在原有肝炎、自身免疫性肝病史或其他肝脏疾病的患者中建立准确的临床诊断至关重要。值得注意的是,在本病例中患者服用土三七的同时有饮酒史、既往有血吸虫肝病史且患者为老年男性,肿瘤指标异常,需要通过相关检验、检查以排除相关肝损疾病,切忌因思维定势而导致漏诊。在建议患者停用药酒和积极的保肝、抗凝等治疗后,患者转氨酶下降迅速,进一步提示土三七为造成肝损害的病因。在这种情况下,停用肝损药物是解决肝损伤至关重要的一步。同时希望通过此文加强民众对安全使用土三七等民间偏方的意识,最大程度的降低此类事件的发生。在中草药制剂发扬光大的同时使其不良反应最小化。

