乳腺癌易感基因1蛋白在脑胶质瘤中的表达及对替莫唑胺敏感性的影响
赵晓军,乔志刚,梁挺宇,安艳玲
1.山西省肿瘤医院神经外科,太原030013;2.山西卫生健康职业学院护理学院,太原030619
脑胶质瘤是中枢神经系统常见的原发性肿瘤,其生长方式呈浸润性,具有极强的侵袭性,经手术切除后患者的复发率较高、预后较差[1]。乳腺癌易感基因1(breast cancer susceptibility gene 1,BRCA1)蛋白是一种组织特异性肿瘤抑制因子,能够参与DNA 损伤修复过程,且与紫杉醇、铂类及替莫唑胺等多种药物的肿瘤耐药性密切相关[2-4]。目前的研究显示,BRCA1 表达异常与肺癌[5]、乳腺癌[6]等多种恶性肿瘤的发生发展密切相关。但有关其在脑胶质瘤中的表达情况,以及是否影响脑胶质瘤细胞对化学治疗(化疗)药物的敏感性尚不清楚。因此,本研究通过检测BRCA1 蛋白在脑胶质瘤中的表达,分析其与患者临床病理特征之间的相关性,并进一步通过体外抑制BRCA1 的表达,分析其对脑胶质瘤细胞替莫唑胺(temozolomide,TMZ)敏感性的影响,从而探索BRCA1 是否可作为脑胶质瘤临床治疗的新靶点,以期为已对化疗药物产生耐药性的脑胶质瘤患者提供新的治疗手段。
1 对象与方法
1.1 研究对象、主要试剂与仪器
1.1.1 试验对象 选择2010 年1 月—2017 年12 月于山西省肿瘤医院神经外科行手术切除的脑胶质瘤患者104 例作为研究组,同时选择头颅损伤行内减压手术治疗的患者30 例作为对照组。研究组的纳入标准:①经组织病理学证实为脑胶质瘤。②首次发病,术前未接受放射治疗(放疗)、化疗、免疫治疗及手术治疗等。③无其他神经系统疾病。排除标准:①临床病例资料不全。②术前发生肿瘤卒中。③合并其他恶性肿瘤者。本研究已获得山西省肿瘤医院伦理委员会的审批(审批号:20150817-L),所有参与本研究的患者均已签署知情同意书。
1.1.2 实验细胞株 人脑胶质瘤细胞株U251购自中国科学院上海生命科学研究院细胞资源中心。
1.1.3 主要试剂与仪器 鼠抗人BRCA1 单克隆抗体(Santa Cruz,美国),羊抗鼠IgG聚合物(Proteintech,美国),DAB 显色试剂盒(北京索莱宝科技有限公司),CCK-8 试剂盒(上海碧云天生物技术有限公司),反转录试剂盒(Sigma,美国);fDSP 彩色摄像系统(Biometra,美国),石蜡包埋机(Leica,德国),烤片机(沈阳恒松科技有限公司),全自动免疫组织化学染色机(Leica,德国),基因扩增仪(杭州博日科技股份有限公司)。
1.2 研究方法
1.2.1 患者资料收集、组织标本获取及处理 收集所有患者的年龄、性别等临床资料;同时,收集研究组患者脑胶质瘤组织标本及对照组患者头颅损伤脑组织标本,参考世界卫生组织中枢神经系统肿瘤分级标准对研究组患者的病理组织进行分类和分级。本研究所有患者的临床资料及病理组织标本均来自山西省肿瘤医院病理科,所有组织在离体后迅速经10%甲醛固定,常规石蜡包埋后待检。
1.2.2 免疫组织化学法检测BRCA1蛋白表达 使用切片机将石蜡包埋后的2 组标本制成厚约4µm 的切片,经烤片、脱蜡、乙醇水化后用柠檬酸缓冲液高温高压行抗原修复,使用过氧化氢去除内源性过氧化物酶,滴加鼠抗人BRCA1 单克隆抗体稀释液(1∶100),4 ℃孵育过夜,洗涤后滴加羊抗鼠IgG 聚合物稀释液(1∶100),室温下孵育30 min,洗涤后滴加链霉亲和素-过氧化物酶,室温下孵育30 min 后行DAB 显色。而后经苏木精复染、中性树胶封片后,于显微镜下观察。
BRCA1 蛋白表达判定如下:在400 倍镜下随机选取每张切片的5 个视野,通过染色强度评分及BRCA1 阳性细胞计数进行综合评估。染色强度为0~3 分:0 分为无染色,1 分为弱阳性,2 分为中阳性,3 分为强阳性。阳性细胞计数为0~4 分:0 分为阳性细胞百分比为0,1 分为1%~25%,2 分为26%~50%,3 分为51%~75%,4 分为76%~100%。将切片的2项得分累计相加,总分≤3分记为BRCA1阴性表达,总分>3分记为阳性表达。
1.2.3 细胞培养 将U251 细胞置于含有10%胎牛血清、100µg/mL 青霉素-链霉素的DMEM 培养液中,于37 ℃、5%CO2培养箱中恒温培养。细胞密度达80%时,采用0.25%胰酶进行消化传代。
1.2.4 细胞转染及分组 以3×103/孔将U251 细胞接种于6 孔板中,于37 ℃、5%CO2培养箱中进行恒温培养。待细胞生长至80%时,将U251 细胞随机分为3 组,使用Lipofectamine 2000 试剂盒进行转染实验,即分别向3 组细胞转染shRNA-BRCA1 沉默载体(sh-BRCA1 组)、shNC-BRCA1空表达载体(sh-NC 组)及空白对照磷酸盐缓冲液(Blank组),而后继续培养48 h。
1.2.5 反转录及定量聚合酶链反应检测BRCA1 mRNA 表达 使用定量聚合酶链反应(quantitative PCR,qPCR)检测转染效果。使用TRIzol 提取3 组细胞的总RNA,使用反转录试剂盒将RNA 反转录成cDNA,以β-肌动蛋白(β-actin)作为内参。按照qPCR 试剂盒说明书以cDNA为模板检测BRCA1 mRNA 表达,引物序列如表1 所示。BRCA1 mRNA的相对表达量计算采用2-ΔΔCT方法。
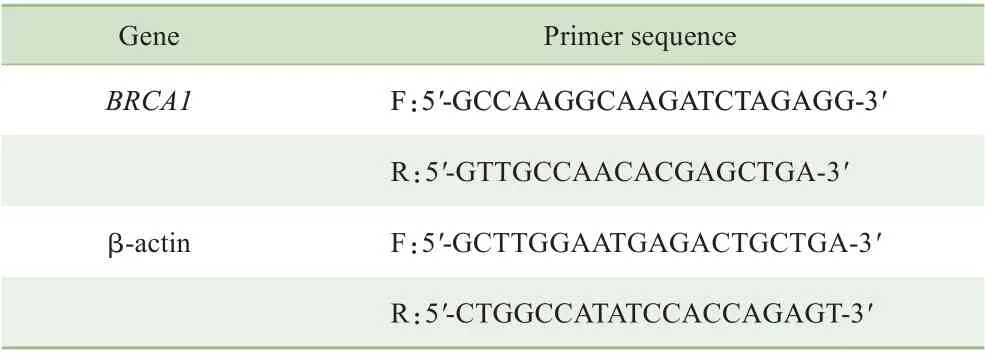
表1 qPCR引物序列Tab 1 Primer sequences for qPCR
1.2.6 CCK-8 法检测细胞增殖活性及对TMZ 敏感性 收集转染后的3组细胞,经胰酶消化后制成单细胞悬液。按照说明书步骤,将已转染的细胞以3×103/孔接种至96 孔板中,每组(不同时间及浓度)均设置6个复孔。①细胞增殖活性检测:于37 ℃、5%CO2培养箱中继续培养24、48 和72 h 后,向每孔加入10 μL CCK-8 溶液,继续孵育2 h后用酶标仪检测各孔于450 nm处的吸光度D(450 nm)值。②TMZ敏感性检测:于37 ℃、5%CO2培养箱中恒温培养至细胞贴壁,加入10 µL 不同浓度的TMZ 使孔中的TMZ 终浓度分别为0、50、100 及200µmol/L,继续培养48 h 后向每孔加入10 μL CCK-8 溶液,继续孵育2 h 后用酶标仪检测各孔于450 nm处的吸光度D(450 nm)值。
1.3 统计学分析
采用SPSS 22.0 软件对研究数据进行统计分析。定性资料采用率或百分比表示,采用χ2检验进行分析;定量资料以x±s 表示,采用One-way ANOVA 进行组间比较;采用Kaplan-Meier 法计算生存率,使用Log-Rank 法进行差异显著性检验。以P<0.05 表示差异具有统计学意义。
2 结果
2.1 2组患者一般资料比较
本研究共纳入104 例脑胶质瘤患者,其中男性56 例、女性48例,年龄为18~67岁,平均年龄为(47.5±7.8)岁;病理组织分级显示,62 例为Ⅰ~Ⅱ级,42 例为Ⅲ~Ⅳ级;病理组织类型显示,30 例为胶质母细胞瘤,48 例为星形细胞瘤,26 例为少突胶质细胞瘤。本研究共纳入30 例头颅损伤患者,其中男性18 例、女性12 例,年龄为20~67岁,平均年龄为(45.2±8.1)岁。对患者的年龄及性别进行统计分析,结果显示2组患者的年龄(P=0.321)、性别(P=0.690)间差异均无统计学意义。
2.2 2组患者BRCA1蛋白表达的比较
免疫组织化学法结果显示,BRCA1 蛋白主要位于细胞质内,但在细胞核内也有一定表达。在30 例对照组组织中有23 例为BRCA1 阳性表达,阳性表达率为76.67%;而在104 例脑胶质细胞瘤组织中有33 例呈阳性,阳性表达率为31.73%;阳性表达率的组间差异具有统计学意义(P=0.009,图1)。
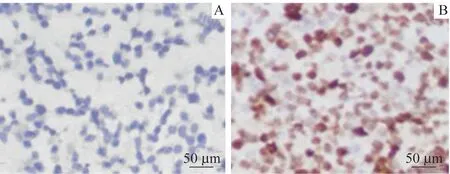
图1 免疫组织化学法检测BRCA1蛋白表达阴性和阳性的镜下示例(×400)Fig 1 Microscopic examples of negative and positive BRCA1 protein expression detected by immunohistochemistry (×400)
2.3 BRCA1蛋白表达与研究组患者临床病理特征之间的关系
BRCA1 蛋白表达与患者的年龄、性别及病理类型无显著相关性,而在Ⅲ~Ⅳ级脑胶质瘤组织中BRCA1 的阳性表达率低于Ⅰ~Ⅱ级,且差异具有统计学意义(P=0.022,表2)。
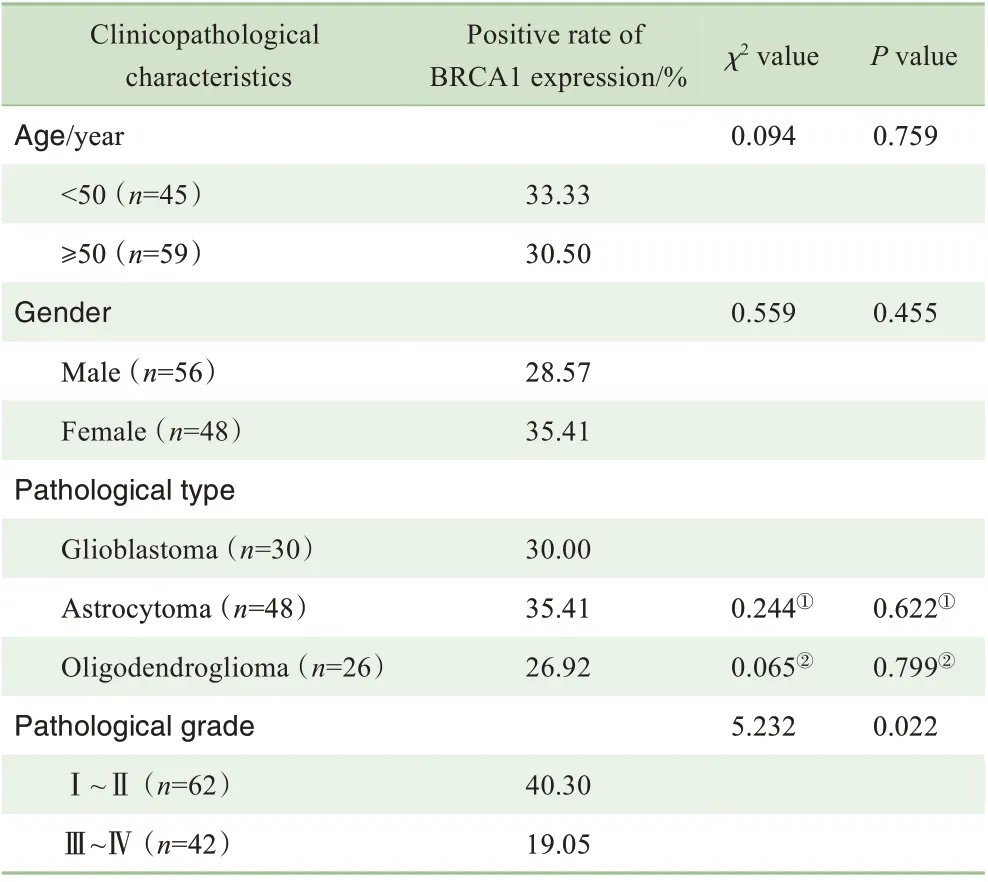
表2 BRCA1蛋白表达与研究组患者临床病理特征之间的关系Tab 2 Relationship between BRCA1 protein expression and clinicopathological characteristics of the patients in the study group
2.4 BRCA1蛋白表达与研究组患者生存率的关系
Log-Rank 法分析结果(图2)显示,BRCA1 蛋白阳性表达患者的总生存率与阴性表达患者相比,差异无统计学意义(P=0.109)。
2.5 BRCA1 mRNA细胞转染效果
采用qPCR检测细胞的转染效果,结果(图3)显示,BRCA1 在U251 细胞中(即Blank 组)有一定的表达,且在sh-BRCA1 组中的表达量低于sh-NC 组(P=0.037)和Blank组(P=0.035),说明转染成功。
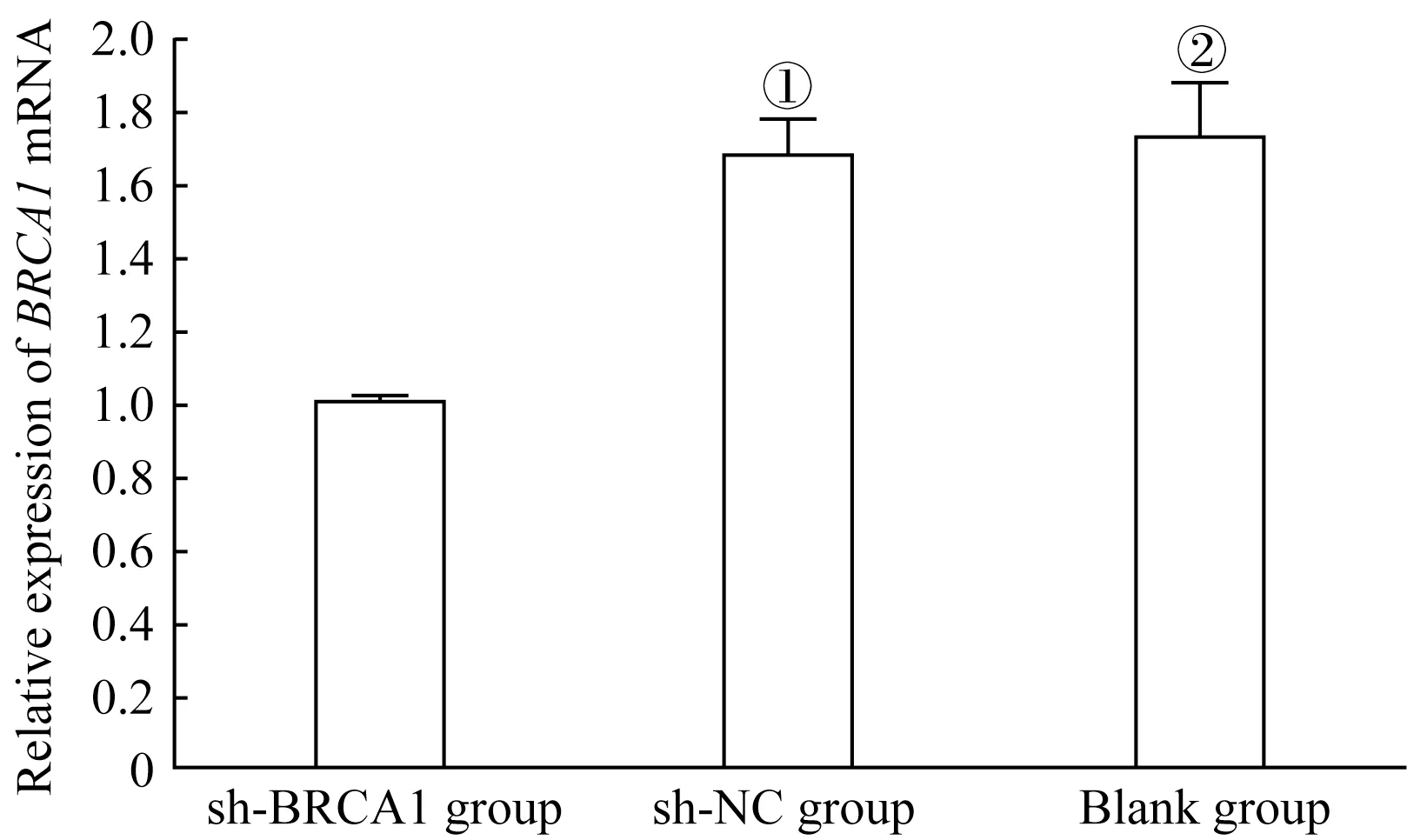
图3 细胞转染后BRCA1 mRNA的表达水平Fig 3 Expression level of BRCA1 mRNA after transfection
2.6 抑制BRCA1表达对U251细胞增殖活性的影响
采用CCK-8 法检测U251 细胞的增殖活性,结果(图4)显示,经培养48、72 h后,sh-BRCA1组细胞的增殖 活 性高于Blank 组(P=0.043,P=0.037)和sh-NC 组(P=0.046,P=0.037);说明抑制BRCA1 表达能够促进癌细胞增殖。
2.7 TMZ对U251细胞增殖活性的影响
经不同浓度的TMZ 处理后,采用CCK-8 法检测3 组U251细胞的增殖活性,结果(图5)显示TMZ对U251细胞均有一定的抑制作用,且呈剂量依赖性;当TMZ 浓度为100、200 µmol/L 时,sh-BRAC1 组的细胞活性显著高于sh-NC 组(P=0.041,P=0.040)和Blank 组(P=0.038,P=0.042)。
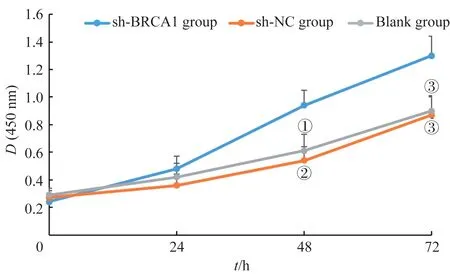
图4 抑制BRCA1表达对3组U251细胞增殖活性的影响Fig 4 Effect of inhibition of BRCA1 expression on proliferation activity of U251 cells in the three groups
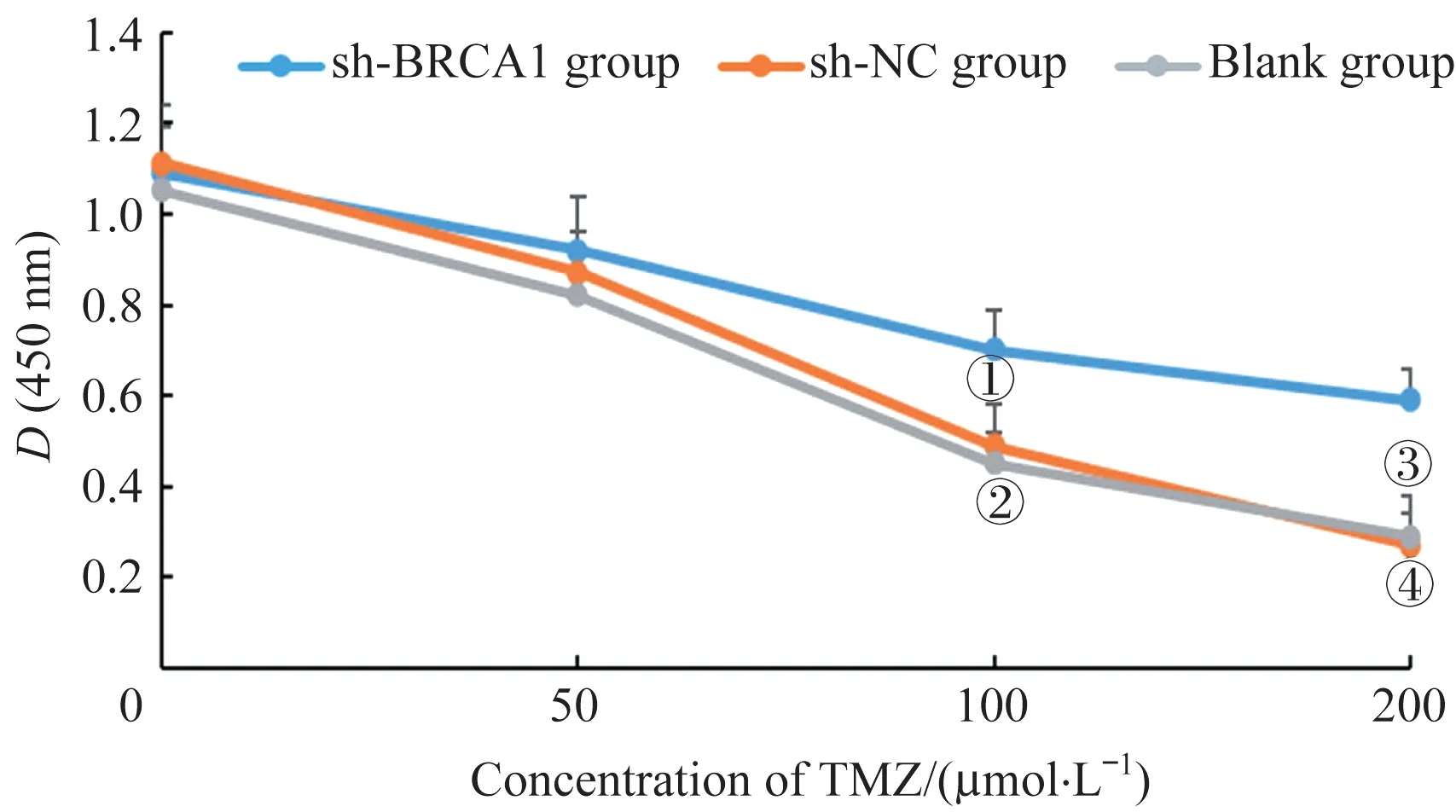
图5 不同浓度TMZ对3组U251细胞增殖活性的影响Fig 5 Effects of different concentrations of TMZ on proliferation activity of U251 cells in the three groups
3 讨论
脑胶质瘤恶性程度较高,约占原发性颅内肿瘤的50%[7]。近年来,脑胶质瘤的发病率和死亡率呈逐渐上升趋势,严重影响人类的生命健康。目前,手术切除、化疗和放疗是脑胶质瘤的主要治疗手段,但患者的5年生存率仍低于5%[8]。有报道指出,BRCA1 在乳腺[6]、卵巢癌[9]等多种肿瘤中呈低表达,推测其可能参与了肿瘤的发生发展过程。进一步研究[10-11]表明,BRCA1蛋白能够调控细胞周期,参与DNA 损伤修复过程,且具有抑制恶性肿瘤生长的作用。研究[12]显示,消化系统肿瘤细胞的细胞质中BRCA1 和BRCA2 的低表达水平与肿瘤晚期淋巴结转移密切相关,而细胞质中高表达BRCA1 和BRCA2 的患者预后较好。另有研究[13-14]表明,BRCA1在多种肿瘤中表达异常,且与患者的临床病理特征存在一定相关性。本研究采用免疫组织化学法检测了对照组及研究组的BRCA1 蛋白表达情况,结果发现研究组BRCA1蛋白阳性表达率低于对照组,即BRCA1在脑胶质瘤中呈低表达,推测其可能与胶质瘤的发生发展有关。随后,本研究分析了BRCA1 蛋白表达与胶质瘤患者临床病理特征之间的关系,结果显示BRCA1 的表达与患者的年龄、性别、病理类型无显著相关性,但与肿瘤病理分级显著相关,说明BRCA1 可能与肿瘤的恶性程度相关;但进一步对BRCA1 与患者生存率之间的关系分析发现,BRCA1 阳性表达患者的总生存率与阴性表达患者间差异无统计学意义。上述结果表明BRCA1 可能在脑胶质的发生发展过程中发挥了一定作用。
目前,临床上恶性脑胶质瘤的主要治疗手段为手术并辅以TMZ化疗及放疗,但由于患者易对TMZ产生耐药性,因此其治疗效果并不理想。TMZ 主要通过干扰DNA复制、损伤DNA 来抑制肿瘤细胞增殖,从而发挥抗肿瘤的作用。既往研究[15-16]显示BRCA1 在DNA 损伤修复、调节细胞周期及促进细胞增殖过程中发挥重要作用,因此我们推测其可能参与了胶质瘤患者TMZ 耐药性产生的过程。Ding 等[17]研究发现BRCA1 是引起TMZ 诱导的P53 野生型胶质母细胞瘤细胞死亡的潜在靶点,抑制BRCA1能够诱导神经胶质瘤sphere-forming细胞凋亡,增强细胞对化疗药物TMZ的敏感性,提示BRCA1可能成为治疗神经胶质瘤的新靶点。本研究首先从临床患者组织中证实了BRCA1 在脑胶质瘤中低表达且与患者临床病理特征具有一定的相关性,但是BRCA1 是否参与调控脑胶质瘤对化疗药物敏感性尚不清楚。因此,本研究通过体外细胞水平探索了抑制BRCA1表达对脑胶质瘤细胞TMZ敏感性的影响,通过构建BRCA1 低表达脑胶质瘤U251细胞模型,观察不同浓度TMZ对脑胶质瘤U251细胞增殖活性的影响,结果发现抑制BRCA1 表达能够降低脑胶质瘤细胞U251 对TMZ 的敏感性,推测其在胶质瘤TMZ 化疗耐药中可能发挥了重要作用。
目前,关于BRCA1 蛋白在脑胶质瘤中的表达及其对脑胶质瘤耐药性的影响报道较少,本研究初步探究了BRCA1 在脑胶质瘤组织中的表达及其与患者临床病理特征的关系,同时在细胞水平上初步观察了BRCA1 对脑胶质瘤TMZ敏感性的影响,为进一步探究BRCA1在脑胶质瘤中的作用提供了一定的数据基础。本研究尚存在一定的局限性:由于纳入的样本量较少,仅通过检测细胞活性来观察BRCA1 表达对U251 细胞TMZ 敏感性的影响,未进行深入的机制研究,使得本研究结果仅具有一定的代表性。因此,在今后的研究中我们仍需要继续收集病理数据,扩大样本量及研究范围,从分子及细胞水平深入探究BRCA1 在脑胶质细胞瘤中可能的作用机制,从而为脑胶质细胞瘤的临床治疗提供一定的参考。

