蛋白质SUMO化修饰的蛋白质组学研究述评
熊强强,屠 俊,李郡如,3,程金科,左建宏#,陈亚兰#
1.南华大学衡阳医学院转化医学研究室,衡阳421001;2.上海交通大学基础医学院生物化学与分子细胞生物学系,上海市肿瘤微环境与炎症重点实验室,上海200025;3.上海交通大学医学院2016级临床医学八年制,上海200025
蛋白质翻译后修饰的存在极大丰富了蛋白质的多样性,而且为蛋白质响应刺激和发挥功能提供了精密的调控方式。细胞内存在大量的磷酸化和乙酰化等化学修饰,这些修饰的供体主要是ATP 和乙酰辅酶A 等,它们是物质代谢过程中产生的小分子产物;与此不同,泛素和类泛素家族属于小分子蛋白质,它们是由基因编码的,并带有特定的“使命”。目前已知,泛素化修饰与蛋白酶体降解途径密切相关[1],自噬相关蛋白质12(autophagy related 12,ATG12)修饰则与自噬过程密切相关[2]。人体内小分子泛素相关修饰物(small ubiquitin-related modifier,SUMO)化修饰是由活化酶、接合酶和连接酶介导的,而SUMO 的成熟和去修饰过程则由6 种SUMO特异性蛋白酶(SUMO/sentrin-specific proteases,SENPs)催化完成[3]。SUMO 化修饰广泛存在于细胞内各个组分,参与了基因表达、代谢调控、免疫应答和肿瘤发生发展等诸多生理病理调控过程[4],但目前对其主要“使命”尚不明确。对SUMO 化修饰蛋白质进行系统化鉴定和研究,有助于了解SUMO 化修饰的时空分布、响应信号、作用机制和功能表型等,而这些都需要建立在掌握特定的SUMO 化修饰研究方法的基础上。尽管SUMO 化修饰非常重要,但由于SUMO 本身的序列特征和修饰丰度问题,鉴定SUMO 化修饰位点一直是本领域的热点和难点。本文对利用质谱规模化研究哺乳动物中SUMO 化修饰的方法进行总结,供开展相关研究的学者们参考。
1 SUMO化修饰的规模化鉴定概述
要从全局性角度观察SUMO化修饰在特定细胞或组织中的状态和变化,需要通过蛋白质组学的手段规模化鉴定SUMO 化修饰位点。从2004 年到2019 年,已经有近百篇涉及SUMO化修饰组学的文献,其中大部分聚焦于哺乳动物中的SUMO化修饰。此外,还有一些介绍植物或线虫中的SUMO化修饰组学的研究[5-6],在此不作讨论。
在这16年的研究中,从研究成果的数量来看,2014年和2015 年的成果最多(图1A);从鉴定到的修饰蛋白质和修饰位点来看,2017 年和2018 年的成果最丰(图1B、C)。从总体研究趋势来看,2004 年多篇人源细胞中SUMO 化修饰组学研究成果陆续被发表,数十个修饰蛋白质被鉴定,但均未鉴定到修饰位点。2005—2008年,通过串联亲和纯化技术富集SUMO 化修饰蛋白质以及通过突变SUMO 蛋白鉴定修饰位点的技术路线逐步被建立[7-8]。2009—2013年,得益于细胞培养稳定同位素标记(stable-isotope labelling by amino acids in cell culture,SILAC)定量技术和高分辨率质谱的广泛应用,SUMO化修饰组学的研究又开始逐渐增多。在此期间,研究人员针对SUMO 蛋白质的C 端序列进行改造,获得了具体的修饰位点[9-10]。在2011 年和2013 年出现了针对细胞内源性SUMO 化修饰蛋白质进行鉴定的研究,但均未能鉴定到修饰位点[11-12]。在2014 年和2015 年,SUMO 化修饰组学的研究达到高潮,在此期间学者们对SUMO 蛋白质的氨基酸序列进行了多种改造,对富集和洗脱方法也进行了优化,鉴定到的修饰位点数目有了显著增加。2016年出现了多篇综述性论文[13-16],但研究成果数量较少。在2017 年和2018 年,得益于SUMO 突变模式、刺激条件、富集方法、搜库设置的成熟和Q-ExactiveTM等高性能质谱的广泛应用,SUMO 化修饰蛋白质和修饰位点的鉴定数目达到顶峰,且内源性SUMO 化修饰也能鉴定出大量修饰位点[17]。在2019年,由于SUMO化修饰蛋白质组学研究已经相对成熟,规模化鉴定SUMO 化修饰蛋白质和修饰位点被应用在SUMO 化修饰的功能实验中[18-19],而专门针对SUMO 化修饰蛋白质组学技术的研究数量有所减少。下文我们主要从SUMO 蛋白质改造和富集方法方面重点论述,并总结在细胞和组织水平进行SUMO 化修饰蛋白质组学研究的最优路线。
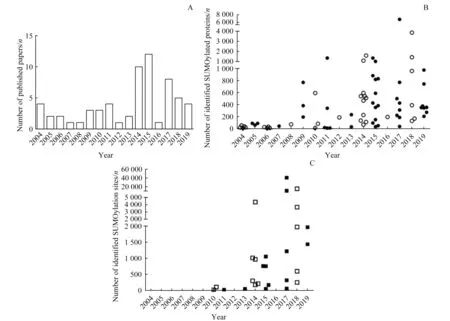
图1 哺乳动物中SUMO化修饰蛋白质组学研究分析Fig 1 Analysis of proteomic study on protein SUMOylation in mammals
2 通过改造SUMO以鉴定修饰位点
在人体中,SUMO存在5种旁系同源物[4,20-21],研究较多 的 是SUMO1、SUMO2 和SUMO3,其 中SUMO2 和SUMO3 的成熟蛋白质序列高度一致,难以区分,所以通常合并研究。这些SUMO的C端缺少赖氨酸或精氨酸,在经过胰酶酶解后,SUMO1和SUMO2/3分别会在修饰底物上残留包含19或32个氨基酸的长链多肽,不利于质谱鉴定修饰位点。因此,为方便质谱鉴定,需要对SUMO进行改造。目前,常用的改造模式为SUMO1-T95R[22]、SUMO2-K0Q87R[23]和SUMO3-Q87RQ88N[24],这些突变改造都使SUMO1、SUMO2 或SUMO3 产生在胰酶酶解后便于质谱鉴定的残留序列,依次分别为GG-K、QQTGG-K 和NQTGG-K,据此可以鉴定修饰位点。当谷氨酰胺在N 端时容易环化,QQTGG-K 转变成pyroQQTGG-K[25-26];而NQTGG-K 容易发生中性丢失产生TGG-K[27],这些也是鉴定位点的搜库指标。我们注意到在这些研究工作中,SUMO1 和SUMO3 的序列计数包含了首位甲硫氨酸;而对SUMO2,研究者在计数其序列时去除了第一个甲硫氨酸,所以经过胰酶酶解后得到的残留肽段仍然是QQTGG。在SUMO2-K0Q87R 中,研究者们将SUMO2上所有的赖氨酸突变成了精氨酸,这样用赖氨酸内肽酶(Lys-C)进行酶解后,SUMO2 不会受到任何切割,仍然保持完整性,因而可以利用其N 端带的His tag再次纯化,进一步富集修饰肽段[23]。在SUMO3-Q87RQ88N 中,研究者将第88 位的谷氨酰胺突变成天冬氨酸,这样可以避免N 端的谷氨酰胺在实验过程中发生改变[27]。上述突变为质谱鉴定修饰位点提供了便利,然而由于突变位点靠近SUMO与靶蛋白质的接合之处,且研究者们没有对野生型SUMO 蛋白质和突变型SUMO 蛋白质在细胞内的结合蛋白质进行全面细致的比较[10,23,27],因而对于突变对SUMO本身修饰行为的影响难以进行全面准确的判定。尽管存在此类风险,但通过突变改变SUMO 的蛋白质序列在样品处理过程中操作便捷,鉴定位点的成功率高,受到大多数研究者的青睐;故此策略仍是当前的主流研究方案。
如果不对SUMO 进行突变,则需要引入多酶进行酶解。例如,对于SUMO1,Cai 等[28]采用Lys-C 和谷氨酸内肽酶(Glu-C) 酶解,得到QTGG 残留肽段;对于SUMO2/3,Hendriks 等[17]采用Lys-C 和天冬氨酸内肽酶(Asp-N)酶解,得到DVFQQQTGG 残留肽段;Lumpkin等[29]采用一种野生型α 裂解蛋白酶(WaLP)在苏氨酸的C端进行切割,从而使SUMO1/2/3都能产生GG残留肽段;不过WaLP能够在多种氨基酸附近进行不同程度的切割,其特异性还需要提高,产生结果的准确性还有待验证。多酶酶解方案既缩短了残留片段以便于后续质谱鉴定修饰位点,又不会影响体内SUMO 本身的修饰行为,是未来很有前景的发展方向,特别是在鉴定内源SUMO的修饰位点方面。未来需要在酶的特异性、有效性和经济性上进行优化,以提高鉴定位点的成功率和准确性。
3 通过亲和纯化富集修饰的蛋白质
在2004 年开展的研究中,研究者们在SUMO 上融合不同的标签,对修饰蛋白质进行富集。有的利用His tag在变性条件下进行富集[30],也有的利用Myc tag 或者HA tag在非变性条件下进行富集[31-32]。His tag与Ni的相互结合不受尿素和盐酸胍等变性溶液的影响,利用变性溶液可以消除大量非共价相互作用,从而去掉一些SUMO 相互作用蛋白质,得到的共价接合的修饰蛋白质相对更多。此外,变性溶液可以在一定程度上抑制去修饰酶SENPs和其他蛋白酶,从而减少蛋白质提取过程中SUMO 修饰蛋白质的降解或去修饰,增加修饰蛋白质的鉴定率。然而,利用His tag 富集修饰蛋白质的特异性不高,这主要是由于真核生物中有较多含poly-His的蛋白质,这些都可能被Ni 富集下来,产生假阳性。针对这一问题,可通过在蛋白质结合过程中加入少量咪唑和在清洗过程中降低溶液的pH 值加以改善。基于His tag 的理论优势和实际效果,研究人员在后续细胞水平的规模化研究中大部分采用了His tag。这样,可以在蛋白质富集过程中尽可能多地富集SUMO 化修饰蛋白质,减少假阴性率,而在后续搜库过程中,通过鉴定到具体修饰位点而减少假阳性率。
除了利用融合标签进行富集外,还有研究者利用SUMO 的抗体富集内源性SUMO 的修饰蛋白质,这对于难以进行转染操作的组织样品非常重要[17,28]。在最初的研究中,利用SUMO1 或SUMO2/3 抗体富集的是修饰蛋白质而非修饰肽段,不仅富集效率低,得到的非修饰肽段多,而且难以鉴定到修饰位点。2017 年本课题组首次报道了规模化鉴定内源性SUMO 的修饰位点的方法[28]。在此方法中,我们合成了将SUMO1 的C 端连接在靶蛋白赖氨酸ε-NH3 上的支链肽段,以此为抗原制备了SUMO1的多克隆抗体(TC)。利用此抗体,我们可以富集经过Lys-C 酶解后的SUMO1 修饰肽段,并经过Glu-C 酶解后鉴定到具体修饰位点。此后,又有研究者设计制备了抗NQTGG 的抗体[27],或直接利用商业化的识别SUMO2/3 C 端的抗体(8A2)富集修饰肽段,并用Asp-N 酶解鉴定到了具体修饰位点[17]。值得一提的是,利用商业化的GG-K 抗体也能有效富集SUMO 化修饰肽段[22,33],这种方法可以整合在标签纯化和抗体纯化过程中[27],从而增加纯度,有利于提高修饰位点的鉴定率。
综上,对于能够转染的细胞而言,最有效便捷的富集方式还是使用His tag;而对于不便转染的组织样品,使用SUMO 的C 端抗体富集修饰肽段则是首选之策。此外,这2种方法还可以结合起来,增加样品纯度以提高修饰位点的鉴定率。
4 细胞样品的SUMO化修饰组学研究
细胞是研究SUMO 化修饰蛋白质组学最便捷的样品,可以通过转染操作进行过表达,还可以对SUMO 序列进行改造,因而鉴定得到更多的修饰位点。通过对培养细胞样品的SUMO 化修饰蛋白质组学研究的方法和结果进行分析和比较,我们发现了针对SUMO1、SUMO2 和SUMO3最有效的研究策略(图2)。
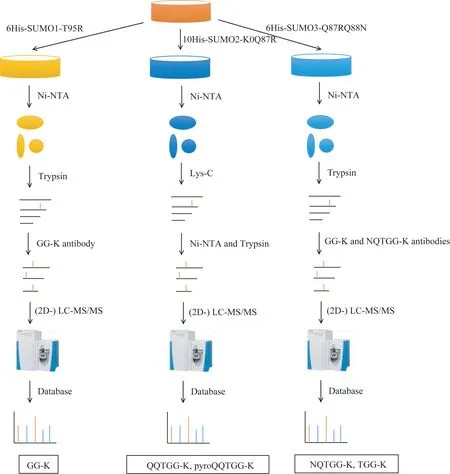
图2 细胞样品中鉴定SUMO修饰位点示意图Fig 2 Sketch map of identification of SUMOylation sites in cell samples
对于SUMO1,首先在细胞中稳定转染6His-SUMO1-T95R,根据需要进行刺激或直接收集细胞。用含有盐酸胍和多种蛋白酶抑制剂的变性裂解液提取蛋白质,并用Ni-NTA磁珠富集SUMO1修饰蛋白质。利用咪唑洗脱后再用胰酶酶解得到肽段,将这些肽段用GG-K试剂盒进行第2轮富集,而后进行质谱鉴定。最初用Ni-NTA一步富集只能鉴定得到14个SUMO1修饰位点[9],而研究者们进一步采用GG-K 富集后可以鉴定得到295个SUMO1修饰位点,近期用此方法将鉴定位点数目进一步扩大到了1 428 个修饰位点[22,34]。由此可见,2 轮富集得到的效果可能更好。如果起始样品很多,可以在质谱鉴定前使用强阳离子交换或高pH 色谱预分离,以鉴定到更多的修饰蛋白质和修饰位点[17,27]。在质谱选择上,现在通常需要Q-Exactive或更高级别的质谱,以增强扫描速度和识别精度。在搜库中,通过设置GG-K可变修饰来鉴定修饰位点。
对于SUMO2,首先在细胞中稳定转染10His-SUMO2-K0Q87R,可以通过热休克和蛋白酶体抑制剂MG132 刺激增强修饰,然后收集细胞并在变性条件下利用Ni-NTA磁珠富集SUMO2 修饰蛋白质。洗脱后用Lys-C 酶解并再次用Ni-NTA 磁珠富集SUMO2 修饰肽段,经过胰酶酶解后进行质谱鉴定。色谱和质谱选择同上述SUMO1鉴定方案。在搜库中,通过设置QQTGG-K 和pyroQQTGG-K 鉴定修饰位点[35]。
对于SUMO3,首先在细胞中稳定转染6His-SUMO3-Q87RQ88N。由于SUMO3 和SUMO2 均能响应热休克和MG132 刺激而增加修饰,因而可对细胞进行这2 种刺激。收集细胞后用Ni-NTA 磁珠富集SUMO3 修饰蛋白质。洗脱后通过胰酶酶解产生NQTGG残留肽段,这些修饰肽段依次用GG-K 抗体和NQTGG-K 抗体富集,然后进行质谱鉴定,色谱和质谱选择同上。在搜库中,通过设置NQTGG-K和TGG-K鉴定修饰位点[27]。
5 组织样品的SUMO 化修饰蛋白质组学研究
对于来源于小鼠或人的组织样本,难以进行转染操作,需要鉴定内源SUMO 的修饰位点。通过分析已发表的相关文献并结合本课题组的近期研究,提出组织样品的SUMO1 和SUMO2/3 的修饰蛋白质组学研究方法(图3)。我们前期在SUMO1修饰最丰富的小鼠睾丸中开展了首次鉴定组织样品内源SUMO 化修饰位点的工作[28],其技术路线也可以应用在其他组织样品中。首先提取组织蛋白质,在变性条件下用Lys-C 酶解。然后,用制备的SUMO1 抗体(TC) 富集SUMO1 修饰肽段,再经过Glu-C 酶解后即可进行色谱分离和质谱鉴定,通过QTGG-K 和pyroQTGG-K 鉴定修饰位点。需要指出的是,我们当初的工作中并未考虑通过pyroQTGG-K 鉴定修饰位点,但基于我们近期的研究测试,pyroQTGG-K 在SUMO1 的修饰位点鉴定中也广泛存在,故提出将此加入可变修饰设置中。对SUMO2/3 的研究与此类似,差异在于需要用SUMO2/3 抗体(8A2)富集SUMO2/3 修饰肽段,在经过Asp-N 酶解后进行质谱鉴定[17]。由于Asp-N酶解特异性问题和切割位置,产生的肽段较长且具有多种中性丢失和切割模式,在搜库时均需考虑。在搜库软件上,除了可以使用传统的MaxQuant 和Mascot 外,pLink非常适合这种发生修饰的“交联肽”的鉴定[28]。
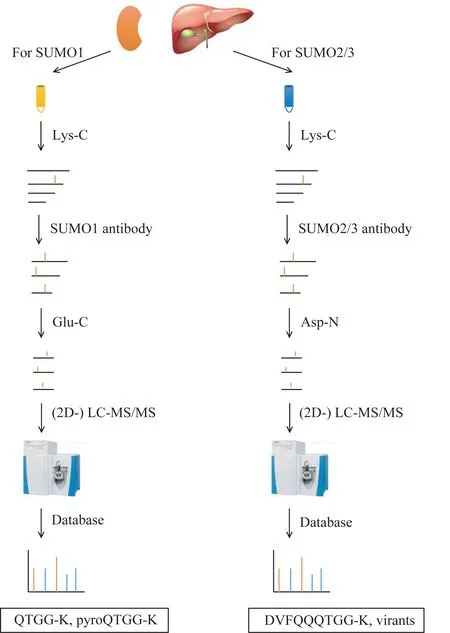
图3 组织样品中鉴定SUMO修饰位点示意图Fig 3 Sketch map of identification of SUMOylation sites in tissue samples
6 总结和展望
当前,随着SUMO 突变模式和富集技术的完善,色谱质谱技术的日益发展以及搜库软件的不断更新,在全局水平鉴定蛋白质的SUMO 化修饰位点的方法已经比较成熟,这些方法也已经广泛应用在功能研究中,为揭示SUMO 的主要功能提供了支持。值得注意的是,当前绝大部分的研究还是基于过表达和点突变策略来鉴定修饰位点,而鉴定内源野生型SUMO 的修饰位点和定量变化则是未来的趋势。另外,在个体化鉴定内源SUMO 化修饰位点的研究中,减少细胞用量、简化操作流程、增加鉴定成功率和阳性率将是未来努力的方向。

