肝脏受控衰减参数在结直肠息肉发生与复发中的价值*
张峻 王超 程莉莎
结直肠息肉需行结肠镜进行早期诊断及治疗,但准备过程烦琐、穿孔风险等诸多因素限制了结肠镜检查作为大规模筛查的首要手段[1-2]。近年国内外研究表明非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)与结直肠息肉的风险增加有关,是结直肠息肉的独立风险因素[3];肝功能剪切波量化超声诊断仪(FibroScan)是一种新型肝脏脂肪含量及硬度无创检测的设备,其通过瞬时弹性成像模型可检测受控衰减参数(controlled attenuation parameter,CAP) 及 肝 脏 硬 度(liver stiffness measurement,LSM),CAP可良好反映肝脏脂肪变性程度,国内外已将其作为非酒精性脂肪性肝病的重要诊断手段[4-7]。迄今为止国内外尚无CAP与结直肠息肉发生及复发风险关系的研究,因此本研究拟通过FibroScan实时、定量、无创地测量肝脏脂肪变定量及肝脏硬度,探索其与结直肠息肉发生及复发风险的相关性。
1 资料与方法
1.1 一般资料
选取2019年7月-2020年9月复旦大学附属中山医院厦门医院消化科病房经结肠镜确诊的结直肠息肉患者、同期行结肠镜检查的无息肉成年患者(排便异常及腹部不适要求体检结肠镜者)共224例,进行回顾性分析。纳入标准:(1)大于18周岁;(2)同意行结肠镜检查;(3)肠道准备佳;(4)同时接受FibroScan检查。排除标准:(1)大量饮酒(女性每日平均 >20 g酒精,男性每日平均>30 g);(2)同时存在病毒性肝炎、自身免疫性肝病、血色病、Wilson病、α1-抗胰蛋白酶缺乏等其他肝脏疾病;(3)肝脏恶性肿瘤;(4)肠道准备不充分影响观察或肠镜检查未至回盲部;(5)炎症性肠病、家族性息肉病、肠道肿瘤等肠道疾病。
1.2 FibroScan肝脏受控衰减参数和肝脏硬度检测
使用Echosens公司生产的肝功能剪切波量化超声诊断仪(FibroScan PRO超声诊断仪)M探头或XL探头。所有受试者均由两名具有FibroScan操作资质的医师进行检测,检测方法严格遵循FibroScan操作手册进行,在正确部位经10次有效测量所得受试者CAP及LSM中位值。根据指南进行CAP分级,肝脏脂肪变程度可分为四期(stage,S),S1、S2、S3、S4 分别对应 CAP<238 dB/m(脂肪变<11%),CAP 238~258 dB/m( 脂 肪 变 11%~33%),CAP 259~291 dB/m( 脂 肪 变 34%~66%),CAP≥292 dB/m(脂肪变≥67%);肝脏硬度LSM值分为 5 期,LSM<7.3 kPa(Fibrosis, F,F0~F1),LSM 7.3~9.6 kPa(F2),LSM 9.7~12.3 kPa(F2~F3),LSM 12.4~17.4 kPa(F3~F4),LSM≥17.5 kPa(F4)。
1.3 结肠镜检查
所有受试者肠镜前均使用聚乙二醇电解质溶液进行肠道准备,由经验丰富的内镜医生进行结肠镜检查,所有肠镜检查均需进镜至回盲部,并详细对息肉的分布、形态、数量进行描述记录,同时行内镜下活检或切除并送病理检查。
1.4 统计学处理
本研究数据采用IBM SPSS 22.0统计学软件进行分析和处理,符合正态分布的计量资料以(±s)表示,采用t检验,两组样本采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;计数资料以率(%)表示,采用χ2检验,P<0.05(双尾)为差异有统计学意义。使用GraphPad Prism 7软件制作相应的统计图。
2 结果
2.1 入组病例临床基线特征
入组病例分为息肉组(156例)和无息肉组(68例),两组性别、年龄、体质量指数(BMI)、ALT、AST、肝脏硬度分期、吸烟与否、有无高血压、高脂血症、糖尿病因素比较差异无统计学意义(P>0.05),两组脂肪变程度比较差异有统计学意义(P<0.05),见表1。息肉组息肉部位:结肠88例,直肠68例;息肉类型:腺瘤样息肉67例,增生性息肉89例。

表1 入组病例临床基线特征
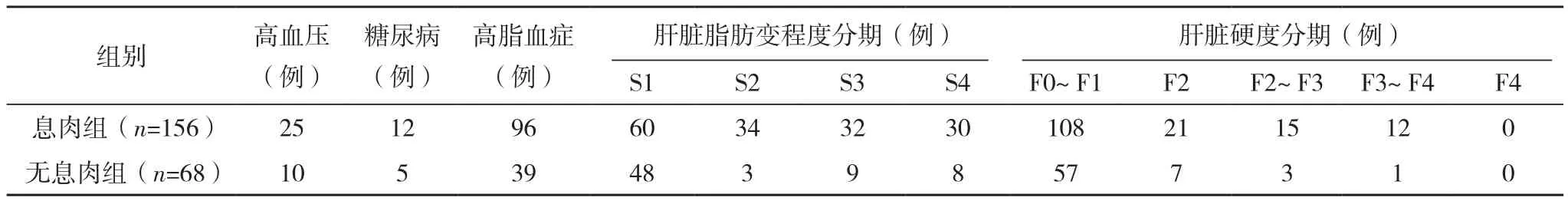
表1 (续)
2.2 两组CAP、LSM比较
与无息肉组相比,息肉组CAP水平明显更高(P<0.05),两组LSM比较差异无统计学意义(P>0.05),见表 2。
表2 两组CAP、LSM比较(±s)
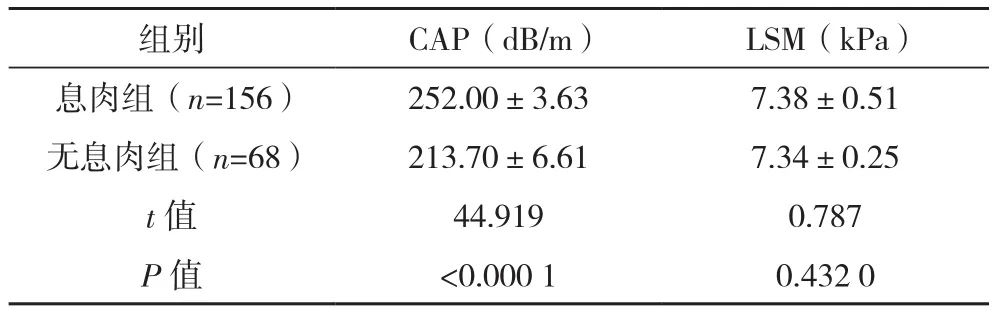
表2 两组CAP、LSM比较(±s)
组别 CAP(dB/m) LSM(kPa)息肉组(n=156) 252.00±3.63 7.38±0.51无息肉组(n=68) 213.70±6.61 7.34±0.25 t值 44.919 0.787 P 值 <0.000 1 0.432 0
2.3 息肉组不同临床特征患者CAP比较
腺瘤性息肉患者CAP较增生性息肉更高,息肉个数>3个患者CAP高于息肉个数≤3个患者(P<0.05);不同息肉部位患者CAP比较差异无统计学意义(P>0.05),见表3。
表3 息肉组不同临床特征患者CAP比较[dB/m,(±s)]
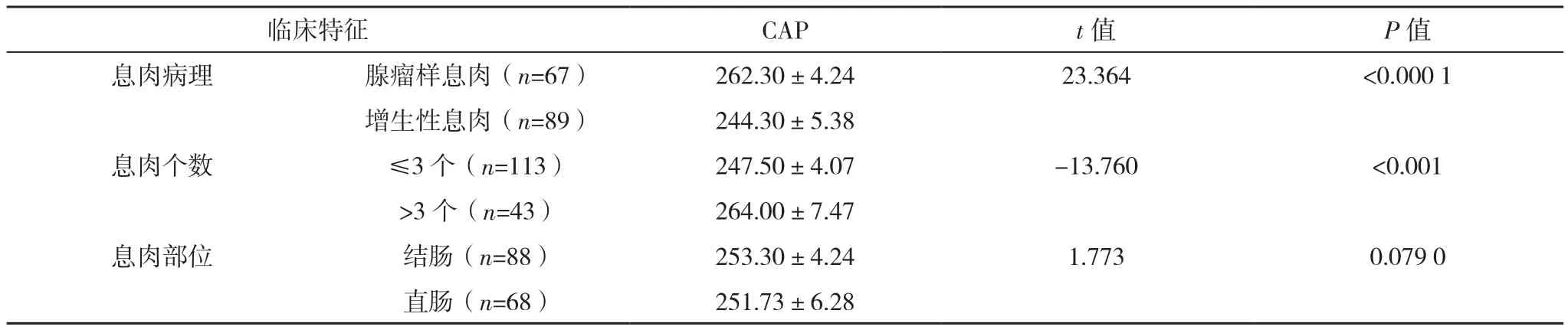
表3 息肉组不同临床特征患者CAP比较[dB/m,(±s)]
临床特征 CAP t值 P值息肉病理 腺瘤样息肉(n=67) 262.30±4.24 23.364 <0.000 1增生性息肉(n=89) 244.30±5.38息肉个数 ≤3个(n=113) 247.50±4.07 -13.760 <0.001>3 个(n=43) 264.00±7.47息肉部位 结肠(n=88) 253.30±4.24 1.773 0.079 0直肠(n=68) 251.73±6.28
2.4 CAP、LSM值对结直肠息肉的预测价值
分别依据脂肪变及纤维化指数建立受试者工作 特 征 曲 线(receiver operating characteristic curve,ROC),CAP的曲线下面积为0.714(95%置信区间:0.635,0.794),最佳截断值为 211.5 dB/m,敏感度为0.788,特异度为0.603,差异有统计学意义(P=0.000),见图1a;LSM的曲线下面积为0.570,差异无统计学意义(P=0.062),见图1b。
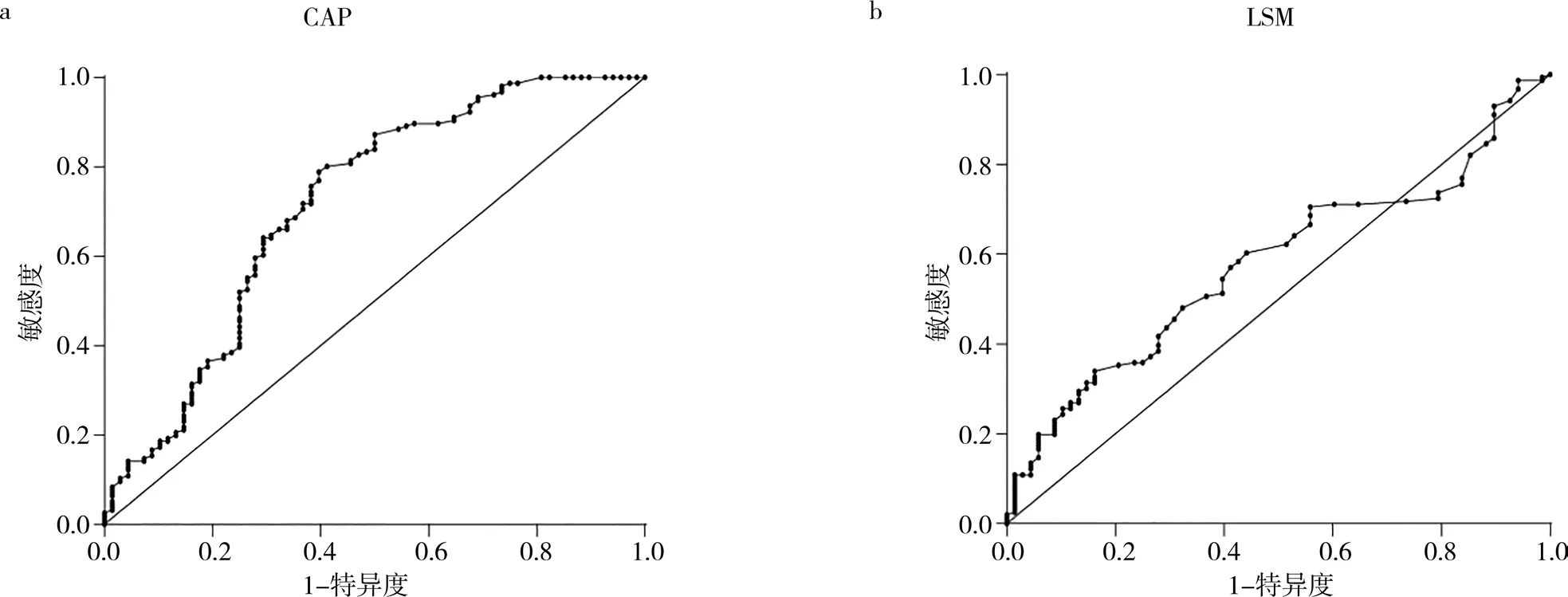
图1 CAP、LSM对结直肠息肉的预测价值
2.5 息肉组复发与未复发者CAP值情况
在156例确诊结直肠息肉的患者中,结直肠息肉切除术后随访1年发现21例复发息肉,息肉复发者基线 CAP 高于未复发者 [(272.00±10.38) dB/m vs (248.90±3.82) dB/m,P=0.03],见图2a。进一步配对比较发现,结直肠息肉切除术后息肉复发时,其 CAP 高 于 基 线 水 平 [(272.00±10.38) dB/m vs(289.00±10.74) dB/m,P=0.048],见图 2b。
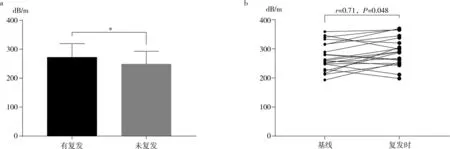
图2 息肉组复发与未复发者CAP值情况
3 讨论
结直肠息肉是指从结直肠黏膜表面突出到肠腔的息肉状病变,其中腺瘤及锯齿状息肉可进展为结直肠癌,早期识别并切除结直肠息肉可以极大程度降低结直肠癌的发生风险[1]。结肠镜检查是发现结直肠息肉最直接最敏感的检查方法,但结肠镜检查前准备过程烦琐、易引起不适体验、高龄人群结肠镜检查存在一定穿孔风险等多因素限制了其作为大规模筛查的首要手段,因此国内推荐个体首次筛查进行高危因素问卷调查和粪隐血试验后再行结肠镜检查[2]。然而目前使用的问卷调查及相关检查仍不完善,需要进一步补充更多可预测结直肠息肉发生的经济、方便且无创伤的检查。
近年来国内外多项研究表明NAFLD增加了结直肠息肉的发生风险,并且NAFLD的慢性炎症状态可能会促进结直肠息肉的发展并进展为结直肠癌。Lee等[8]进行了一项纳入44 220名患者的横断面研究,通过对经结肠镜确诊的结肠息肉患者使用腹部超声检测脂肪肝,结果发现脂肪肝的严重程度与结直肠息肉发生风险呈正相关。Blackett等[4]发现与匹配的对照组相比,经肝脏组织活检证实的NAFLD患者在结肠镜检查中的腺瘤性息肉患病率显著更高,且不受糖尿病、肥胖和高脂血症的发生率的影响,NAFLD是结直肠息肉的独立风险因素。Chen等[9]一项纳入3 686名结肠息肉患者也同样证实NAFLD增加男性结直肠腺瘤及增生性息肉的发病率。2020年一项对结直肠息肉与NAFLD关系的meta分析再次有效证实了NAFLD增加结直肠息肉的发病风险[10]。
肝脏组织活检是NAFLD的金标准,但由于肝穿刺是一种有创性的操作,易出现出血等并发症,且肝活检标本仅占肝脏体积的五万分之一,不能完全反映肝脏全部情况,此外,通过肝活检反复评估疾病进展也是不现实的,故临床较难大规模开展肝脏穿刺活检[11],因此临床中常使用如腹部超声、磁共振成像等手段进行脂肪肝的诊断。腹部超声目前是诊断NAFLD的一线检查方法,通常表现为肝回声结构明亮、超声信号衰减深、血管钝变等征象。然而腹部超声非常依赖于操作医师的技术和经验,同时其对轻度脂肪变性不敏感,通常在肝脏脂肪变性达到30%以上才可检测出,且无法对脂肪浸润进行数值化评估,同时对于NAFLD所致肝脏纤维化评估效能不佳,也无法对肝脏纤维化进行数值化评估。磁共振质子密度脂肪分数和磁共振弹性成像虽然可良好评估NAFLD的脂肪浸润程度及硬化程度,但由于磁共振存在检查费用昂贵、检查时间长等多种缺点同样无法大规模应用于临床筛查[12]。而FibroScan是一种无创、快速、准确检查肝纤维化及肝脂肪定量检测的设备,其通过瞬时弹性成像模型可检测LSM及CAP。Eddowes等[3]通过与肝活检作为金标准比较发现,FibroScan的CAP和LSM在评估NAFLD中具有一定的准确性,曲线下面积范围为0.70至0.89。鉴于NAFLD是结直肠息肉独立危险因素,而FibroScan是一种实时、定量、无创、易广泛开展的项目,那么可否通过LSM和CAP来量化结直肠息肉发生与复发风险呢?
本研究通过横断面及纵向研究队列分析发现,FibroScan CAP高者其结直肠息肉发生率高,ROC曲线下面积为0.714。此外基线CAP水平高者,如脂肪变程度持续升高,其1年内复发风险也高。与无息肉组相比,息肉组CAP水平明显更高(P<0.05),两组肝脏硬度LSM值比较差异无统计学意义(P>0.05),可能和疾病本身相关,如更高的脂肪变程度及炎症浸润,可引起纤维化。因此,FibroScan的开展可能成为结肠镜检查前除高危因素问卷调查和粪隐血试验外的另一筛查工具,并且可以成为复查结肠镜检查时间选择的重要参考因素。但本研究也存在一定的局限性,首先,样本数仍较小,在建立ROC曲线时可能影响其效能;其次,结直肠息肉的复发不一定在1年内显现,由于病例数及随访时间的限制,其复发预测价值有可能被低估。未来研究中,可以通过连续每年监测FibroScan,延长随访时间至5年探索其进一步的价值。最后,本研究未进行药物干预,若降脂治疗改善其脂肪变程度后,结直肠息肉的发生与复发率是否随之减少?这需要未来进一步的探索,从而进一步指导临床治疗。
综上,通过FibroScan,可实时、定量、无创监测脂肪变程度,从而预测结直肠息肉发生及复发风险。

