混合野调强增加调强野比例在乳腺癌保乳术后放疗中的应用研究
李超,胡艳,李晶晶,宋文立,罗海锋
(长江大学附属第一人民医院肿瘤科放疗中心,湖北 荆州 434000)
放射治疗是早期乳腺癌患者行保乳术后较成熟的治疗方式之一,作为手术和化疗的一种辅助治疗方式,放射治疗能提高此类患者的总生存率[1]。由于乳腺所在位置离人体多个重要器官较近,因此,患者的放疗计划设计有一定难度。如果患者对美观要求较高,则乳腺组织内的剂量均一性要高而靶区外的热点区域要少。由于乳腺癌保乳患者寿命期望值较高,因此,在制定放疗计划时,应尽可能减少患者肺部组织及心脏部位接受的剂量以降低不良反应发生率。另外,患者对侧乳腺也应接受尽量少的射线,如对侧乳腺接受射线较多,将增加乳腺二次肿瘤的发生率[2]。Mayo 等[3]研究显示,h-IMRT 与其他计划比较,在乳腺癌保乳患者中的应用有剂量学方面的优势,83%的剂量由3D-CRT 提供。本研究调整IMRT 和 3DCRT 的比例,其中 IMRT 为 80%,3D-CRT 为 20%,通常情况下,IMRT 占比的提高会提高靶区适型度从而提高美观性。本研究探究了该技术在左右乳腺癌患者中的应用,并与其他3 种放疗技术从危及器官参数、靶区适型度、靶区均一性、治疗跳数、计划执行时间等方面进行比较,以探求在乳腺癌混合野放疗中提高IMRT 的比例是否能提高放疗计划质量,从而为乳腺癌保乳术患者选择合适的放疗技术提供理论依据,现报道如下。
1 资料与方法
1.1 临床资料 选取2018 年6 月至2019 年10 月长江大学附属第一人民医院肿瘤放疗中心收治的左右乳腺癌患者各12例,平均年龄(47±8)岁,乳腺大小为普通体积。
1.2 方法
1.2.1 体位固定及模拟定位 所有患者均使用一体化碳纤维板和热塑体模进行体位固定,并行CT扫描,扫描范围从下颌骨下缘到肋弓水平,包含整个肺部组织,层厚为5 mm,将得出的模拟定位CT 图像传至治疗计划系统(Varian Eclipse version 10.0: Varian Medical Systems Palo Alto,CA)。
1.2.2 靶区及危及器官勾画 放射肿瘤医师根据ICRU50,62 对危及器官及靶区进行勾画,包括临床靶区(CTV)、计划靶区(PTV)、左右肺组织、心脏、对侧乳腺。CTV 包括患者患侧乳腺和胸大肌筋膜,在CTV基础上进行外扩得到PTV,其中患者头脚方向外扩1.5 cm,前方在体表内收5 mm,后方及左右方向均外扩1 cm。
1.2.3 放射治疗计划设计 所有放疗计划均由高年资放疗物理师计划设计,每位患者均设计4 套放疗计划。第1 个放疗计划为传统计划,使用30°楔形板的方形切线野;第2 个计划为IMRT/3D-CRT 混合野计划,照射方向均有切线方向,在此计划中,3D-CRT 贡献总剂量为20%;第3 个计划为本肿瘤中心一直使用的IMRT/3D-CRT 计划,其中IMRT 贡献总剂量为20%,照射方向也均为切线方向;第4 个为全调强计划,从患者乳腺切线分别以12°为间隔分别设置3野,总共6野制定计划。4 套计划处方剂量均为50 Gy,每分次2 Gy,整个治疗次数25 次,其中要求95%的PTV 体积接受95%的处方剂量的照射。
放疗计划优化条件:PTV,95%的PTV接受处方剂量照射。危及器官:双肺,V20<25%,同侧肺,V20<30%,V5<40%,V30<20%,对侧肺,V10<10%,心脏,V20<10%,V30<5%,对侧乳腺,V10<10%。
1.3 放疗计划评估 每个放疗计划均记录最终的治疗跳数及执行时间,其中执行时间为换楔形板及技术员进出1 min、跳数除以剂量率600 Mu/min及机架旋转时间之和。
从计划系统的DVH图像中获取靶区及危急器官参数值。靶区:V105,V98,V2,V50。选用V105(即靶区105%处方剂量等剂量线包绕区域体积)参数是因靶区V105%能较好地反应患者后期的皮肤反应率[4]。选用V98,V2,V50参数是根据这几个指标可计算均一性指数(homogeneity index,HI),公式为:HI=(D2-D98)/D50[5]。获得靶区接受处方剂量的体积(VROI,pres),处方剂量包绕的体积(Vbody,pres)及PTV(VROI)体积,靶区的适型度指数(confomal index,CI)计算公式如下:CI=(VROI,pres)2/(VROI×Vbody,pres)[6]。危及器官主要选取以下参数:肺、心脏、对侧乳腺。对于肺组织,记录总肺V5、平均剂量,这2个参数与治疗后的放射性肺炎密切相关[7-8],此外,还分别记录左右肺V20,V30,对于左侧乳腺癌患者,记录其心脏低剂量区V5及V30,平均剂量,有研究[9]表明,当心脏接受30 Gy剂量<40%时,由放射线对心脏损伤而引起的死亡风险较低。对侧乳腺记录其V5及平均剂量。
1.4 统计学方法 采用SPSS 25.0统计软件进行数据分析,计量资料以“”表示,使用单因素方差分析,如果有差异,则进一步进行LSD检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 靶区剂量学比较 肿瘤位于肺部左侧时,PTV高剂量区V107%方面,h-IMRT(1∶4)明显高于其他3 种放疗计划(P<0.05),其他3种放疗计划V107%比较差异无统计学意义;PTV平均剂量方面,6f-IMRT与h-IMRT(1∶4)比较差异无统计学意义,并高于其他两种放疗计划(P<0.05),h-IMRT(4∶1)高于3D-CRT,4 种放疗计划平均剂量均高于处方剂量;适型度指数方面,6f-IMRT 明显高于其他 3 种放疗计划,h-IMRT(1∶4)次之,3D-CRT 最差;4 种放疗计划均一性指数比较差异无统计学意义。肿瘤位于肺部右侧的评估结果与左侧一致,见表1。
表1 靶区剂量参数比较()Table 1 Comparison of dosimetric parameters in planning target volume()

表1 靶区剂量参数比较()Table 1 Comparison of dosimetric parameters in planning target volume()
肿瘤位置左侧(n=12)右侧(n=12)治疗方式3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值PTV平均剂量(Gy)50.3±0.5 52.3±0.4 51.1±0.6 52.0±0.2 26.51 0.00 50.0±0.1 51.8±0.3 50.8±0.2 51.9±0.2 138.30 0.00 V107%(cc)2.2±5.2 78.7±31.1 0.7±1.1 2.3±4.2 3.42 0.04 0.7±1.0 48.8±42.2 2.8±4.5 1.5±1.4 2.50 0.00 CI 0.44±0.11 0.70±0.06 0.64±0.06 0.79±0.04 23.21 0.00 0.42±0.03 0.74±0.04 0.71±0.05 0.85±0.02 196.81 0.00 HI 0.12±0.02 0.11±0.02 0.09±0.02 0.10±0.01 3.12 0.05 0.12±0.01 0.11±0.02 0.10±0.01 0.11±0.02 3.93 0.18
2.2 肺部剂量参数
2.2.1 与肿瘤位于同一侧肺部剂量参数比较 在低剂量区(肺V5)方面,无论肿瘤位于肺部左侧或右侧,6f-IMRT均显著高于其他3 种放疗技术(P<0.05),但在中高剂量区肺V20,V30方面,4种放疗计划比较差异均无统计学意义,见表2。
表2 与肿瘤位于同一侧肺部剂量参数比较(,%)Table 2 Comparison of dosimetric parameters in ipsilateral lung(x±s,%)

表2 与肿瘤位于同一侧肺部剂量参数比较(,%)Table 2 Comparison of dosimetric parameters in ipsilateral lung(x±s,%)
肿瘤位置左侧(n=12)右侧(n=12)治疗方式3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值V30 15.2±5.1 13.5±4.2 14.2±4.6 13.2±4.3 0.22 0.88 15.4±4.4 14.0±4.1 14.3±4.3 13.3±4.1 0.35 0.79 V5 25.4±7.7 23.4±6.8 23.7±6.8 33.3±8.6 5.29 0.01 27.9±5.9 26.2±5.9 26.4±5.8 36.8±5.5 6.04 0.00 V20 17.1±5.4 15.6±4.8 16.4±5.2 18.4±5.6 0.29 0.83 17.5±4.7 16.2±4.5 16.7±4.6 20.3±4.0 1.31 0.29
2.2.2 位于肿瘤对侧肺部剂量参数比较 无论肿瘤位于肺部左侧或右侧,在4 种放疗技术中,只有肺部低剂量区(肺V5)在使用6f-IMRT 时有极少部分肺组织受到照射,而肺中剂量区V20,V30均未累及肺,见表3。
表3 位于肿瘤对侧肺部剂量参数比较(,%)Table 3 Comparison of dosimetric parameters in contralateral lung(x±s,%)

表3 位于肿瘤对侧肺部剂量参数比较(,%)Table 3 Comparison of dosimetric parameters in contralateral lung(x±s,%)
肿瘤位置左侧(n=12)V30 0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.0右侧(n=12)治疗方式3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值V5 0.0±0.0 0.0±0.0 0.0±0.0 0.5±0.3 10.80 0.00 0.0±0.0 0.0±0.0 0.0±0.0 1.0±1.1 6.96 0.00 V20 0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.1 1.00 0.41 0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.0
2.2.3 两侧肺总体受到剂量参数比较 无论肿瘤位于肺部左侧或右侧,低剂量区(肺V5)均在使用6f-IMRT时明显增高(P<0.05)。肺部平均剂量方面,当肿瘤位于肺部左侧时,4种放疗技术比较差异均无统计学意义;肿瘤位于肺部右侧时,3D-CRT 技术平均剂量较其他技术均显著增大(P<0.05),见表4。
2.3 对侧乳腺受到剂量参数比较 对侧乳腺低剂量区(V5)方面,6f-IMRT 均显著高于其他3 种放疗技术;平均剂量方面,无论肿瘤位于肺部左侧或右侧,6f-IMRT组均高于其他3种放疗技术(P<0.05),见表5。
表4 肺总体积参数比较()Table 4 Comparison of dosimetric parameters in whole lung()

表4 肺总体积参数比较()Table 4 Comparison of dosimetric parameters in whole lung()
肿瘤位置左侧(n=12)右侧(n=12)平均剂量(Gy)4.4±1.4 3.5±1.1 4.0±1.3 4.4±1.3 0.71 0.56 12.0±7.8 5.3±1.4 5.4±1.4 6.1±1.1 4.04 0.03治疗方式3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值V5(%)11.3±3.8 10.3±3.3 10.4±3.4 15.3±4.9 6.14 0.03 16.2±3.7 15.2±3.7 15.3±3.8 21.7±3.5 5.61 0.00
表5 对侧乳腺受到剂量参数比较()Table 5 Comparison of dosimetricparameters in contralateral breast()
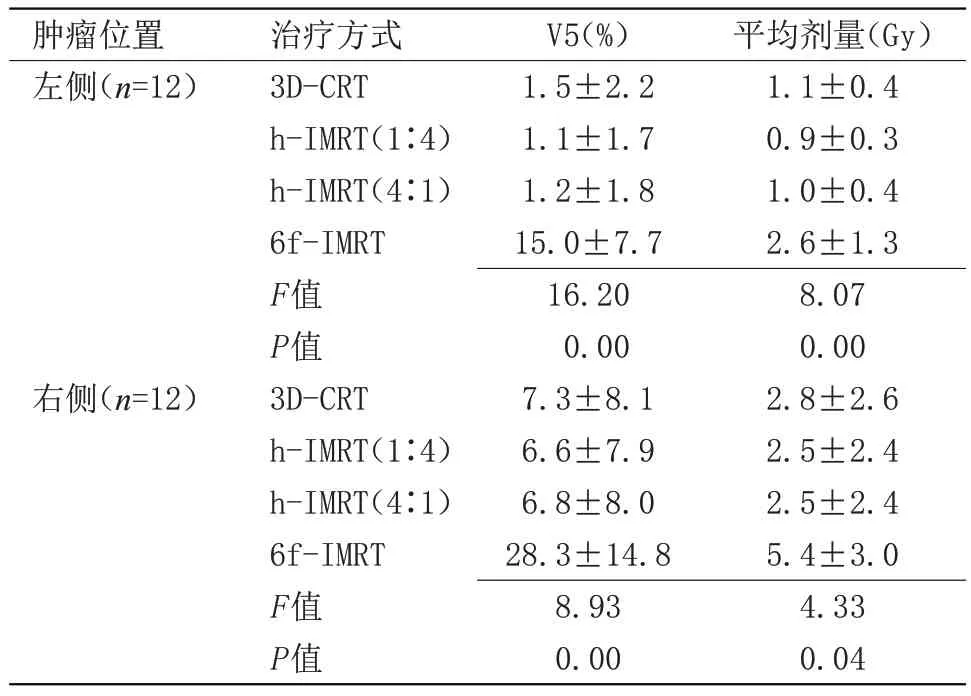
表5 对侧乳腺受到剂量参数比较()Table 5 Comparison of dosimetricparameters in contralateral breast()
1.1±0.4 0.9±0.3 1.0±0.4 2.6±1.3 8.07 0.00 2.8±2.6 2.5±2.4 2.5±2.4 5.4±3.0 4.33 0.04肿瘤位左侧(n=12)右侧(n=12)3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值1.5±2.2 1.1±1.7 1.2±1.8 15.0±7.7 16.20 0.00 7.3±8.1 6.6±7.9 6.8±8.0 28.3±14.8 8.93 0.00
2.4 心脏受到剂量参数比较 当肿瘤位于肺部左侧:在心脏低剂量区方面(V5),6f-IMRT 明显高于其他3 种放疗技术(P<0.05),3D-CRT 次之并高于混合调强两种放疗技术;在心脏中剂量区(V30)方面,h-IMRT(1∶4)低于其他3种放疗技术(P<0.05);平均剂量方面4 种放疗技术比较差异无统计学意义。当肿瘤位于肺部右侧:中剂量区(V30)方面,4种放疗技术均未累及;低剂量区方面,6f-IMRT高于其他3种放疗技术(P<0.05),平均剂量方面6f-IMRT 也最高(P<0.05),其他几种治疗技术在这两种参数方面比较差异均无统计学意义,见表6。
2.5 治疗跳数和执行时间 治疗跳数方面,无论肿瘤位于肺部左侧或右侧,6f-IMRT 均高于其他3 种放疗技术(P<0.05),且其他3种放疗技术比较差异均无统计学意义;执行时间方面,6f-IMRT 和其他3 种放疗方式比较显著增加(P<0.05),两种混合野技术无差别且低于6f-IMRT。执行时间是指患者位置摆好时至治疗跳数完成时的时间,包括机架旋转时间(5.8°/s),出跳数时间(总MU/10),换楔形板时间(换一次按60 s计算),见表7。
表6 心脏剂量参数比较()Table 6 Comparison of dosimetric parameters in heart()

表6 心脏剂量参数比较()Table 6 Comparison of dosimetric parameters in heart()
肿瘤位置 平均剂量(Gy治疗方式V5(%)V30(%)左侧(n=12)右侧(n=12)4.5±2.8 4.1±2.7 4.1±2.8 5.3±3.8 0.21 0.89 1.4±0.3 1.3±0.3 1.3±0.3 2.3±0.8 8.39 0.00 3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值13.5±8.9 11.3±8.7 11.7±8.7 20.8±8.5 6.21 0.03 0.5±0.6 0.2±0.3 0.2±0.3 8.7±5.2 20.26 0.00 4.5±5.1 3.7±4.7 4.7±4.5 4.7±6.9 0.04 0.99 0.0±0.0 0.0±0.0 0.0±0.0 0.0±0.0)
表7 治疗跳数和执行时间()Table 7 Treatment monitor unit and treatment time()
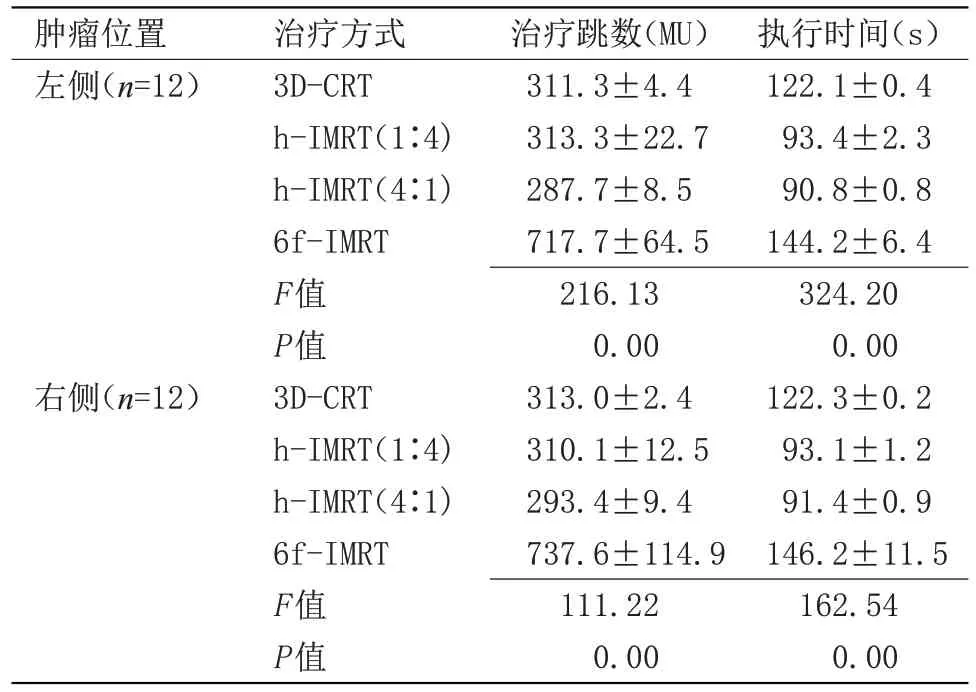
表7 治疗跳数和执行时间()Table 7 Treatment monitor unit and treatment time()
执行时间(s)122.1±0.4 93.4±2.3 90.8±0.8 144.2±6.4 324.20 0.00 122.3±0.2 93.1±1.2 91.4±0.9 146.2±11.5 162.54 0.00肿瘤位置左侧(n=12)右侧(n=12)治疗方式3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值3D-CRT h-IMRT(1∶4)h-IMRT(4∶1)6f-IMRT F值P值治疗跳数(MU)311.3±4.4 313.3±22.7 287.7±8.5 717.7±64.5 216.13 0.00 313.0±2.4 310.1±12.5 293.4±9.4 737.6±114.9 111.22 0.00
3 讨论
乳腺癌保乳术后放疗包括非根治性术后放疗和手术后放疗,患者无需切除整个乳房,因此,能显著提高患者的生活质量[10]。有研究显示,乳腺癌患者保乳术后放疗能达到与根治性手术同样的治疗效果,是早期乳腺癌患者的一种标准治疗手段[11-12]。由于患者生存期望较高,因此,在满足靶区要求的同时降低危急器官剂量,从而降低患者晚期不良反应发生率,不良反应包括放射性肺炎、放射性心脏病、二次肿瘤等。
本研究比较 3D-CRT,h-IMRT(1∶4),h-IMRT(4∶1),6f-IMRT 放疗技术在早期乳腺癌的应用,以了解提高混合野调强IMRT 剂量输出比例是否能提高放疗计划质量,并找到适合左右乳腺癌患者的最佳放疗方式。
传统的3D-CRT技术对设备要求不高,且能满足靶区的剂量要求,但如果此类计划并未根据患者实际情况设计,则适型度不高易导致危急器官接受过高剂量,晚期易发生严重不良反应[13]。因此,Mayo等[3]在传统切线野上加了2个正对的调强切线野,其中3D-CRT剂量为83%,这一改进提高了靶区适型度并降低心脏、同侧肺及靶区周围软组织剂量,与本研究第3个计划—h-IMRT(4∶1)结果一致。本研究的第2个计划通过提高IMRT的比例提高计划质量,发现与h-IMRT(1∶4)比较,其靶区适型度(CI)明显提高(P<0.05),但增加了靶区V107%的体积(P<0.05)。6f-IMRT计划能显著改善靶区适型度,但在危及器官低剂量区控制效果不佳。
乳腺癌放疗中,患者皮肤反应是人们普遍关心的问题,因皮肤反应过大会影响美观。V107%能较好地预测皮肤反应的发生率。Chen等[14]发现在传统分割条件下,V107%>28.6%或V110%>5.13%与急性皮肤反应密切相关,Tortorelli等[15]发现在传统分割条件下,V107%>9 cc与急性的二度到三度皮肤反应密切相关。本研究结果显示,无论肿瘤位于左侧乳腺或右侧乳腺,切线野3D-CRT 和h-IMRT(4∶1)均能满足要求,而6f-IMRT和h-IMRT(1∶4)均不能满足要求,提示如需保护乳腺皮肤组织,应选择对皮肤伤害较小的3D-CRT或h-IMRT技术。
放射性心脏损伤也是乳腺癌保乳术后放疗患者所面临的问题之一,由于患者预期的生存期较长,因此,在制定放疗计划时应考虑心脏剂量,尤其在制定左侧乳腺癌放疗计划时,Darby等[16]的研究中发现,在乳腺癌放疗中,如果心脏暴露在射线下会增加缺血性心脏病发生率。心脏V30是重要指标,如果V30>10%会影响心肌灌注[17]。本研究结果显示,当病灶在右侧,除使用6f-IMRT时V5较大外,其他几种治疗方式心脏接受的剂量可忽略不计,但当病灶在左侧时,使用6f-IMRT时V5较大,在使用h-IMRT(1∶4)时V30较小(P<0.05),但所有的放疗技术均未达到文献中V30>10%这一临界值。因此,就心脏保护方面,这4种放疗技术均可使用。
在乳腺癌保乳术患者中,肺部剂量限值应引起放疗计划者的重视,因放射性肺炎的发生与患者的预后有密切关系。在常规分割的放射治疗中,放射剂量学参数在一定程度上可预测肺炎发生率。研究表明,肺V20和MLD及肺V5与放射性肺炎密切相关[18-20]。本研究结果显示,无论病灶位于肺部左侧或右侧,使用6f-IMRT时低剂量区V5均大于其他几种放疗技术(P<0.05),其他3种放疗技术比较差异无统计学意义;平均剂量方面,当肿瘤位于肺部右侧时,3D-CRT较其他几种放疗方式显著增大(P<0.05),其他几种放疗方式比较差异无统计学意义。当肿瘤位于左侧时,几种放射治疗技术比较均无统计学意义,提示当肿瘤位于右侧时使用3D-CRT 或者6f-IMRT技术时均可能增加患者放射性肺炎发生率,而当肿瘤位于左侧时只有当使用6f-IMRT 技术时可能会增加患者放射性肺炎发生率,影响患者预后。
由于乳腺癌保乳术后患者生存期较长,因此,对于其他部位由于接受散射线而导致二次肿瘤的发生也应引起关注。有研究表明[21],虽然调强放射治疗降低了高剂量区接受射线照射面积,但正常组织接受低剂量照射区域却增多,将增加二次肿瘤发生率,与其他不良反应不同,二次肿瘤发生率无阈值,即使接受低剂量照射也引起重视。本研究结果显示,使用6f-IMRT放疗技术不仅增加了低剂量区且平均剂量也较高,而其他几种放疗技术在这两个参数方面比较差异无统计学意义。因此,如患者年龄较小,应慎重考虑使用6f-IMRT技术。
有研究报道,治疗跳数增加也会增加二次肿瘤发生风险,机器跳数增加2~3倍,会使二次肿瘤发生率由1%提高至1.75%,尤其是在长期生存的患者中更显著[22]。上述放疗方式中,6f-IMRT 治疗方式跳数最多,h-IMRT(4∶1)最少,其他两种治疗方式比较差异无统计学意义。治疗时间是患者及技术员比较关心的指标,通过计算发现6f-IMRT 组最高,其次是有楔形板的3D-CRT 组,两种混合野调强比较差异无统计学意义。因此,如患者身体状态不佳,耐受时间较多,应考虑治疗时间相对较短的两种混合野调强技术。
本研究通过比较3D-CRT,h-IMRT(1∶4),h-IMRT(4∶1),6f-IMRT 4 种放疗技术在左右乳腺癌保乳术后患者中的应用,综合考虑放射性心脏病、放射性肺炎、对侧乳腺二次肿瘤发生率、治疗跳数及执行时间等因素,发现如患者年龄较小,预期寿命较长,应慎重选择6f-IMRT技术;如患者在治疗过程中不能耐受较长时间,应选择h-IMRT(4∶1);如要控制患者皮肤反应,不应选择h-IMRT(1∶4)技术;如要控制患者放射性肺炎及放射性心脏病发生率也不应选择6f-IMRT技术。本研究的不足之处在于样本量较少,只选取左右两侧乳腺各12例,后期应加大样本量进行研究。另外,调强野方式较多,本研究只选取比较有代表性的一种,因此,得出的结论可能会有偏差。
综上所述,在混合野调强中提高调强比例可能并不能提高计划质量,与本研究的其他3 种放疗方式比较,在本放疗中心现有设备条件下,h-IMRT(1∶4)仍是左右乳腺癌患者首选的放疗技术。

