纳米乳液提高氧化白藜芦醇口服生物利用率及透皮吸收效率
李俊,王群,刘果,苗建银,谢琳,曹庸
(1.华南农业大学食品学院,广东省功能食品活性物重点实验室,广东省天然活性物工程技术研究中心,广东广州 510642)(2.华南农业大学园艺学院,广东广州 510642)(3.广州佳洁化妆品有限公司,广东广州 510450)
氧化白藜芦醇(Oxyresveratrol,OXY)是一种具有多种生物活性的天然植物提取物,属于反式羟基取代的二苯乙烯芪类化合物,在中国广泛分布于菠萝蜜、桑科、百合科、片麻岩科等植物的根、叶、茎和果实中[1]。含OXY的代表植物有菠萝蜜(Artocarpus lakoocha)、桑树(Morus albaL.)、紫檀科、藜芦(百合科)、三棱草(莎草科)、菝葜属(菝葜科)等。OXY因含有多个酚羟基,具有较强的抗氧化作用[2],同时还具有其他生物活性,如抑制酪氨酸酶[3]、抗炎消肿[4]、抗肿瘤、抗高血脂[5,6]、中枢神经保护[7]及帕金森症的改善[8]等生物活性,广泛用于营养保健及防止食品褐变领域。氧化白藜芦醇的中等极性导致其水溶性较差,几乎不溶于水,在口服给药或经皮给药方面存在一定的局限性,主要是由于它的中间渗透性、主动外排介导机制,使其进入体内在肝脏代谢作用下迅速从体内排出[9],导致口服生物利用率低,极大地限制了氧化白藜芦醇的临床应用。
生物利用率是指活性物质摄入人体后,经胃液消化后进入内循环或被人体存储的速度和程度。活性物质的特性,胃肠道环境及自身的消化能力都会影响生物活性物质在人体的消化吸收率。很多学者采用脂质体包埋、环糊精包合或纳米乳液等方法提高活性物质溶解度,促进难溶活性物质的渗透作用[10],有效达到作用位点,从而提高难溶物质的生物利用率[11]。氧化白藜芦醇的多种生物活性由于溶解度的限制极大地受到影响,目前,对于氧化白藜芦醇提高生物利用率的研究较少,对其同系物白藜芦醇的研究较多。研究发现,使用α-、β-和γ-环糊精形成的包合物都可一定程度上增加白藜芦醇的水溶性,但在所有天然环糊精中,β-环糊精与白藜芦醇的复合能力最强[12,13]。对氧化白藜芦醇生物利用率的提高有学者采用固体脂质体包埋技术改变其溶解度,从而提高生物利用率[14,15]。纳米乳液被认为是疏水物质的良好载体,被广泛用于脂类物质的肠外给药,例如紫杉醇和氯霉素等抗癌静脉注射药物[16,17]。有学者通过制备白藜芦醇纳米乳液、纳米凝胶系统研究体内外氧化应激损伤的改善作用[18-20]。因此,本实验采用不同的方法制备氧化白藜芦醇纳米乳液改变其溶解性,希望可以提高氧化白藜芦醇的透皮吸收和口服生物利用率,并对其吸收和转运过程进行体外消化模拟和扩散动力学模拟,为氧化白藜芦醇的体内外应用奠定科研基础。
1 材料与方法
1.1 实验材料
氧化白藜芦醇:实验室分离纯化,纯度>95%;中链甘油三酸脂(Medium Chain Triglycerides,MCT)购于美国Stepan公司;卵磷脂购于美国Lecithin公司;高糖培养基(Dulbecco’s Modified Eagle’s Medium High Glucose,DMEM)、胎牛血清、青霉素/链霉素、PBS和HBSS缓冲液购于美国Gibico公司;HPLC用色谱纯甲醇购于天轁化工;香豆素6购于上海碧云天生物技术有限公司;其它实验试剂均为分析纯。
细胞株:Caco-2细胞,购于美国ATCC公司。
实验所用动物皮肤购于沃尔玛超市。
1.2 实验设备
高压均质机、岛津LC-15C高效液相色谱分析仪、Sotax智能药物溶出实验仪,垂直式Franz cell透皮扩散仪,德国Zeiss激光共聚焦显微镜。
1.3 实验方法
1.3.1 氧化白藜芦醇的液相分析检测
将样品用甲醇溶解,超声震荡,溶解完全后,过0.45 μm微孔滤膜,避光冷藏,准备上样。色谱柱为岛津反相C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇和0.1%磷酸水溶液;检测波长328 nm;室温;进样体积20 μL;流速1.0 mL/min。采用梯度洗脱,甲醇在0~12 min浓度保持17%,20~27 min线性升至90%,27~33 min降至17%[21]。
1.3.2 氧化白藜芦醇纳米乳液的制备
氧化白藜芦醇纳米乳液(OXY-E)的制备流程主要分为以下几个步骤:(1)将乳化剂(卵磷脂、吐温等)溶于去离子水中,磁力搅拌或快速搅拌状态下溶解完全,称为水相;(2)将氧化白藜芦醇在加热状态下溶于MCT,冷却至室温备用,称为油相;(3)水相保持5000 r/min快速搅拌,将油相缓慢加入水相,并持续快速搅拌(5000 r/min),油相完全加入后将速度升至20000 r/min,搅拌10 min,每隔1 min暂停10 s,形成氧化白藜芦醇均匀乳液;(4)将高速搅拌后的乳液加入清洗好的高压均质机内,在高于500 Mpa的压力下,高压均质3个循环,得到氧化白藜芦醇纳米乳液,稀释1000倍后进行粒径测试。
1.3.3 氧化白藜芦醇体外溶出实验
实验方法参考文献报道[22]并进行了优化,分别用去离子水配制碱性缓冲剂(6.805 g/L KH2PO4+0.896 g/L NaOH)和1%的吐温80溶液,分别将吸液管和排出管放入1%的吐温80溶液中,将溶出仪提前预热至37 ℃,水浴循环运行20 min。在上样池将1 mL样品加入至渗透膜的空腔中,开始模拟消化实验,于0.5、1、2、4、6、8、12、24 h的时间点分别从排出液接收瓶中取样0.5 mL,同时补充0.5 mL吐温80溶液(1%),实验前2 h的缓冲液是由1%吐温80溶液配制1 N的HCl溶液调节pH至1.2,模拟胃部的酸性环境,2 h之后加入碱性缓冲液调节pH至6.8,模拟由胃到小肠的环境,将取出的样品中加入0.5 mL乙醇,超声、混匀、过膜后采用HPLC检测氧化白藜芦醇的含量。
1.3.4 体外脂解实验
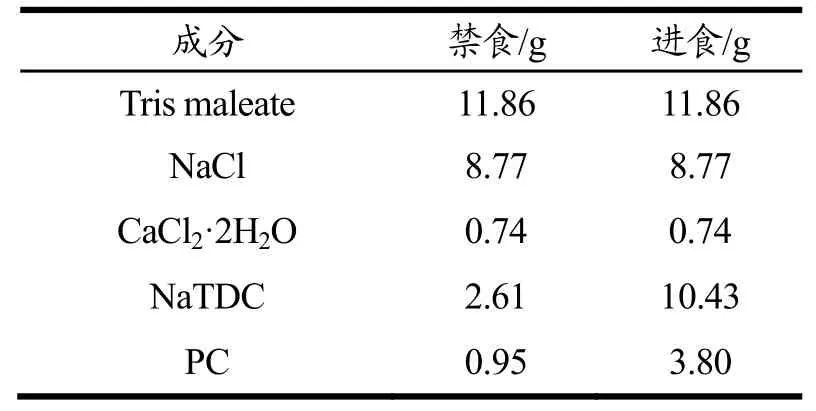
表1 体外模拟消化液的成分表Table 1 The composition of lipolysis buffer in vitro
脂解过程主要是负责三酰甘油(Triacylgycerol,TAG)分解代谢的生化途径,包括长链脂肪酸和甘油主链之间的酯键水解以及游离脂肪酸的释放,此模型为一个动态的体外脂解模型,形象地模拟了体内脂类消化的过程。体外脂解实验(Lipolysis)的方法参照文献[23],具体实验步骤为:将胰蛋白酶于冰箱拿出提前回温至室温,调整油浴至37 ℃保持稳定。将1 g胰蛋白酶溶于5 mL预冷的缓冲溶液中,搅拌15 min后2000 r/min转速离心15 min,取上清,置于冰上,备用。将相当于250 mg油相的样品添加至9 mL的模拟消化液(表1)中在37 ℃油浴中孵育10 min,保持温度恒定,用0.25 M的NaOH调消化液pH为7.5。向样品中加入1 mL的胰蛋白酶立刻开始滴定,保持pH在7.50±0.02波动。连续滴定2 h,记录消耗的NaOH的量,消化完后立刻将样品置于冰上。用低温超高速离心机在4 ℃,以50000 r/min的转速离心40 min,将离心后的中间相移至另一干净的离心管中,冷藏保存。将样品过膜处理,取200 μL中间相样品与400 μL的DMSO振摇混匀后,进行HPLC含量分析,参照文献计算生物利用度和脂肪分解度[10]。
1.3.5 体外模拟小肠上皮细胞Caco-2摄取实验
Caco-2细胞的培养条件为:采用含有10%胎牛血清、1%双抗和1%非必需氨基酸的DMEM高糖培养基,在37 ℃、相对湿度95%、5% CO2条件下的生物培养箱中进行培养。Caco-2模拟小肠上皮细胞转运实验参照文献报道实验方法[24,25],采用生长分化至30代以后的Caco-2细胞株,待细胞分化融合达到80%后,用胰酶消化,用完全培养基调整细胞悬液浓度为按1.5×105cells/mL,接种于12孔板的Transwell小池中,Transwell的上层(AP侧)加细胞液0.5 mL,同时在Transwell的底层(BL侧)加入1.5 mL培养基。隔天更换培养基,每隔一天测定其跨膜电阻值(transepithelial electrical resistance,TEER),观察细胞形态,连续培养21 d后,测定电阻值判断是否符合跨膜转运的条件。
用电阻仪进行跨膜电阻的测定,使用前先将电极在培养基中平衡2 h后再用酒精消毒,室温放置,最后再缓冲液中平衡15 min。将电极两点分别置于上下池中,每孔检测三次,记录电阻值。跨膜电阻符合条件者被纳入细胞转运实验,采用如下公式计算跨膜上皮细胞电阻:
TEER=(测得的电阻值-空白培养皿电阻值)×插入式培养皿的有效膜表面积A
其中:TEER单位Ω×cm2,单层膜表面积A=1.1 cm2。
单细胞模型建好后,按照以下步骤进行物质转运实验:首先用HBSS缓冲液洗两遍,再在37 ℃摇床中孵育15 min。将经过模拟胃液消化后的氧化白藜芦醇样品和纳米乳液样品加于细胞单层膜上,分别考察AP-BL和BL-AP两个方向的药物转运情况。每隔20 min取一次样,共作用2 h,对样品进行前处理后,上HPLC液相分析氧化白藜芦醇的含量。
1.3.6 可视化监测Caco-2细胞摄取
通过激光共聚焦显微镜(Confocal Laser Scanning Microscope,CLSM)可定性观察Caco-2细胞对氧化白藜芦醇纳米乳液的摄取情况,了解作用过程中细胞形态的变化[26],具体实验操作步骤如下:
将细胞悬浮液分别接种于铺有细胞爬片的12孔板中,接种密度为1×105cells/孔。将细胞置于培养箱中培养24 h,待细胞贴壁,弃去培养液,以时间倒序的方式加入香豆素6标记的氧化白藜芦醇纳米乳液(香豆素的浓度在2~4 μg/mL),氧化白藜芦醇上样浓度与Caco-2细胞转运实验相同,分别在0.5、1、2、3、6 h时间段加入荧光标记物,作用时间结束后,弃去培养基,用预冷的PBS反复洗3次,再用4%多聚甲醛固定15 min后,将多聚甲醛弃掉,用10 μg/mL的DAPI(4′,6′-diamidino-2-phenyl-indole)标记细胞核30 min,用预冷的PBS反复洗3次后,将细胞爬片转移到载玻片上,置于CLSM观察。
1.3.7 透皮吸收实验
Transdermal Drug Delivery Systems(TDDS)经皮给药系统,被广泛用于检测配方药物在皮肤的吸收情况[27]。本文采用的仪器为垂直式Franz Cell全自动透皮扩散仪研究氧化白藜芦醇纳米乳液在皮肤表面的渗透吸收并通过激光共聚焦方法可视化监测药物经皮扩散的过程。
Franz cell透皮扩散实验操作参照文献[28],步骤如下:首先,配制含有5%吐温80的PBS缓冲液(pH 7.4)作为接收液加入至Franz cell接收池中至刻度线。然后,将猪肩部位的皮肤去除皮下脂肪,根据接收池的大小用解剖刀分成等大的皮肤小块,于-80 ℃冰箱保存,使用之前在PBS中水浴水温至37 ℃,保持10 min。系统提前升温至37 ℃,接收液持续进行磁力搅拌,将经过PBS处理后的皮肤样品置于给药池底部,保持皮肤表皮面朝上,将皮肤夹在给药池和接收池中间。随后,将样品加于给药池的皮肤表面,在不同时间点于取样口取样200 μL,并补充200 μL的缓冲液,将取到的样品通过高效液相检测含量,取样间隔时间点分别为0、0.5、1、2、4、8、12和24 h。实验完成后,将皮肤组织从透皮扩散仪取下,对其进行米字型剪切后用80%乙醇沸水浴萃取30 min后,取萃取液进行HPLC检测,用以分析皮肤组织内部滞留样品含量[29]。
物质渗透后皮肤组织上的滞留量:

其中:A是有效的渗透扩散面积;V是萃取液的总体积;C是活性物质在萃取液中的质量含量。
物质累积皮肤渗透量:
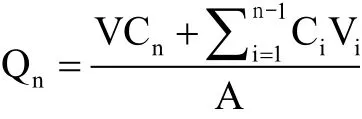
其中:A是有效的渗透扩散面积;V是总的透过皮肤的溶液;Cn是在第n个时间点接收池中物质的质量浓度;Ci是第i个样品的质量浓度,Vi是第i个样品的体积。
1.3.8 透皮吸收可视化监测
为了观察氧化白藜芦醇纳米乳液在皮肤表面的渗透、吸收情况,采用激光共聚焦方法监测透皮吸收过程,具体实验流程:按照Franz cell透皮扩散操作步骤,将氧化白藜芦醇纳米乳液用尼罗红染色后,给药池中加样后,在1、6、12 h分别中断扩散,取下动物皮肤组织,用缓冲液将皮肤表面轻轻冲洗干净,用OCT(Optimal Cutting Temperature Compound)包埋后置于-20 ℃冰箱固定,备用。用冷冻切片机沿皮肤的横断面连续切3~5片8 μm厚的薄片,铺于带静电的载玻片上,将DAPI染色液滴于皮肤组织上染色20 min,置于激光共聚焦显微镜下观察。
1.4 统计学方法
实验数据采用Excel 2007、Origin 8.6、GraphPad Prism 5、和PASW Statistics 18软件进行处理和统计分析。实验结果数据以均值±标准差(mean±SD)的方式表达,数据图的结果用误差棒(Error Bar)表示标准差。数据采用单因素方差分析,不同字母表示显著性差异(p<0.05),数值表示为均值±标准方差(n=3)。
2 结果与讨论
2.1 氧化白藜芦醇纳米乳液粒径分布
纳米乳液作为非平衡体系,不能自发形成,需要通过外界的能量输入(物理的机械作用力或化合物的电荷作用),通常使用高速剪切搅拌、高压均质或超声波等方法产生强烈的破坏力,混合并破坏油相和水相体系,进而导致较大的液滴被分解成较小的液滴形成纳米乳液[30],通过本实验方法制备的氧化白藜芦醇纳米乳液用蒸馏水稀释后通过马尔文激光粒度仪测定乳液的粒径分布。纳米乳液粒径分布分散系数(Polydispersity,PDI),PDI是评价纳米乳液分散性的指标,其数值越小,说明分散性越好,PDI<0.5的粒子分散性良好。粒子质量(Sample Quality)是由计算机系统的数字相关器根据测定溶液中悬浮颗粒的扩散速度、颗粒大小变化导致散射光强波动信号转化的相关函数计算分析的结果,可以得出乳液中离子的扩散系数和粒径的大小分布情况。
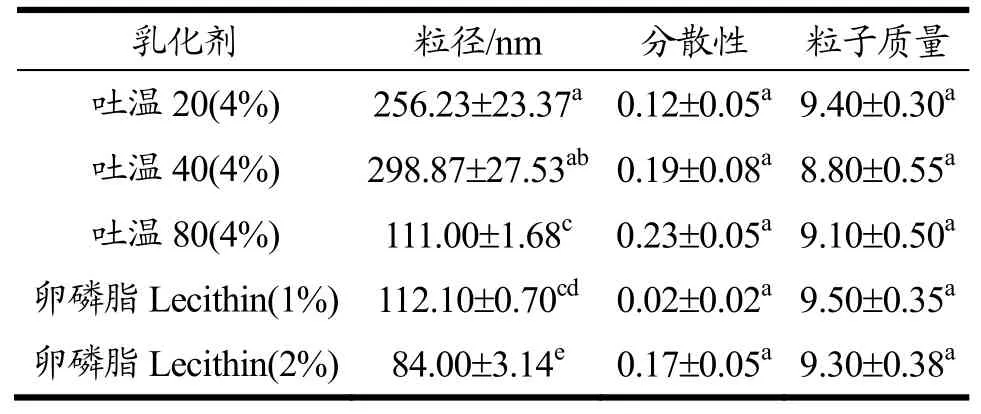
表2 纳米乳液的粒径分布Table 2 The particle size of nano-emulsion
表2结果显示吐温80作为乳化剂制备的纳米乳液粒径(111 nm)显著低于吐温20(256.23 nm)和吐温40(298.87 nm)的,选用2%卵磷脂为乳化剂的乳液粒径比吐温系列的显著变小(p<0.05),由表2中PDI和粒子质量数据表明,采用卵磷脂制备的纳米乳液粒径均匀,分散性良好(PDI<0.5),粒子质量良好,2%卵磷脂制备的氧化白藜芦醇纳米乳液的粒径最小,达到84 nm,因此选择氧化白藜芦醇纳米乳液的乳化体系为2%卵磷脂,纳米乳液氧化白藜芦醇含量经HPLC检测结果为10.15 mg/mL。
2.2 氧化白藜芦醇体外溶出及释药拟合
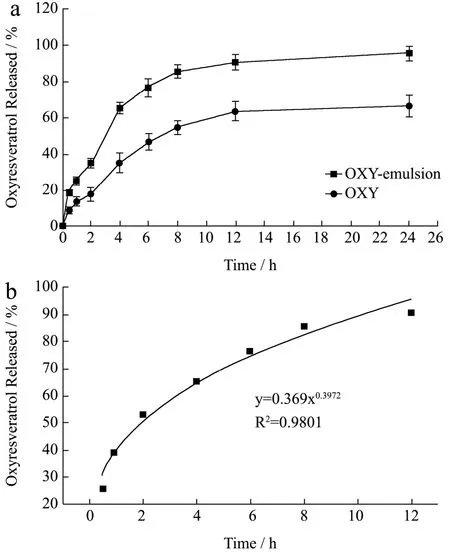
图1 OXY体外药物溶出及释药拟合曲线Fig.1 Dissolution profiles and drug release fitting curve of OXY
活性物质经口服进入人体后,包埋的活性成分要首先通过胃肠道吸收进入血液再进一步分布到体内的靶向器官或组织,从而产生相应的生理生化反应,起到治疗疾病的作用。氧化白藜芦醇纳米乳液口服给药的体外消化实验分为胃液消化和肠液消化两个阶段。本实验采用Sotax USP-4药物溶出仪,相同浓度的氧化白藜芦醇悬浮液和纳米乳液各1 mL分别置于药物溶出仪的给药池中,在连续的两个pH环境下,模拟和分析氧化白藜芦醇纳米乳液在胃肠内的释放。初始的2 h,缓冲液pH为1.2模拟胃部的消化环境,2 h以后调整pH至6.8,模拟小肠内的消化吸收。氧化白藜芦醇在不同时间点的释放量如图1a所示,在2 h OXY纳米乳液和悬浮液在胃液中的释放量分别为35.07%和17.63%,OXY在纳米乳液中的释放量是悬浮液中的2倍。2 h后随着pH的升高,OXY在小肠的释放显著升高(p<0.01),4 h时OXY在纳米乳液的释放量达到65.32%,12 h后释放速度趋于平缓,24 h OXY纳米乳液和悬浮液在肠液中的释放量分别为95.25%和68.34%,纳米乳液显著地提高了氧化白藜芦醇在胃和肠的药物释放量(p<0.05)。
分别采用一级释药模型、Korsemeyer-Peppas模型和零级释药模型对氧化白藜芦醇纳米乳液在不同时间点的溶出数据进行拟合,结果表明Korsemeyer-Peppas的拟合效果最好,R2=0.9801,药物释放计算公式:

其中:n为扩散指数,n=0.3972表示本实验条件下氧化白藜芦醇纳米乳液的药物释放主要受到Fickian扩散的影响[31]。
李晓芳等[32]制备的黄豆苷元固体分散体可以显著提高难溶性药物的溶出速率,比原料药本身提升了6倍,其体外释药动力学符合Korsemeyer-Peppas模型。
2.3 氧化白藜芦醇体外脂解实验

图2 氧化白藜芦醇及其纳米乳液体外脂解实验结果的对比Fig.2 Comparison of in vitro lipolysis result of OXY, OXY loaded MCT and OXY nano-emulsion
将氧化白藜芦醇纳米乳液(OXY-E),氧化白藜芦醇油相(OXY-MCT)和氧化白藜芦醇悬浮液(OXY)分别在进食和禁食状态下进行脂解实验,样品处理后经液相检测计算得到氧化白藜芦醇的生物利用率进食状态下分别为61.22%,52.83%和23.47%,禁食状态下为56.12%,45.59%和22.45%(图2a),结果显示氧化白藜芦醇纳米乳液比化合物本身的生物利用率提升了3倍,升高的原因主要是由于MCT的快速消化能力及乳液对氧化白藜芦醇溶解度的提高。另外从OXY-E和OXY-MCT的溶脂程度可以看出,在禁食状态下脂解的程度分别为86.12%和68.59%,而在进食状态下二者都有升高,脂解程度分别为98.22%和72.83%,OXY-E的脂解程度显著高于OXY直接溶于MCT中(p<0.05)。
因此表明氧化白藜芦醇纳米乳液具有更彻底的脂质消化和更持久的脂解速率,这可能是由于纳米乳液在脂肪酶催化脂肪水解后形成了更小的粒径,增大了其比表面积[15],使消化更彻底。结果表明所有样品在进食状态下的生物利用率和脂解程度显著高于禁食状态的,意味着在OXY纳米乳液口服使用时应和膳食一起服用,以保证较高的生物利用率[23],因此通过制备氧化白藜芦醇纳米乳液可以有效地提高氧化白藜芦醇的生物利用率。纳米乳液在溶解亲油性活性物质方面非常有效,纳米乳液给药系统的粒径非常小,在口服、肠外、眼部和局部途径给药药物递送方面可提高一些亲脂性食品或药物成分的生物利用率。有研究报道纳米乳液O/W型纳米乳液可以提高维生素类疏水食品活性成分在肠道的释放量,从而提高其生物利用率[33]。
2.4 氧化白藜芦醇纳米乳液Caco-2细胞转运结果
在进行Caco-2细胞单层模型转运实验之前,首先要确定氧化白藜芦醇及其乳液的消化液作用于Caco-2细胞的安全剂量。因此需要进行Caco-2细胞的安全毒理测试,本文采用MTT法对不同浓度氧化白藜芦醇及其乳液处理的细胞的存活率进行检测。
由图3a MTT方法测定的Caco-2细胞的存活率可以看出,浓度在2.5~20 μg/mL范围内的氧化白藜芦醇及其乳液的消化液作用后Caco-2细胞的存活率均在90%以上,且空载的乳液作用后Caco-2细胞的存活率也在90%以上,表明此范围物质及其乳液的空载壁材对Caco-2细胞是安全无毒的。
对于口服药物来说,小肠是吸收的主要场所,因此药物的跨肠道表皮细胞渗透是产生药效的决定性环节。药物通过被动转运、载体媒介转运、膜动转运和细胞旁路通道转运4种机制经过胃肠道上皮细胞被转运。药物的转运是一个极为复杂的过程,一般通过一种或多种转运形式,了解药物在体内吸收的机制、速度和程度,尤其对于口服生物利用度较低的药物,研究影响其吸收的因素,对于改善物的吸收性质,提高药物的临床疗效具有重要的意义。因此本实验对氧化白藜芦醇在小肠壁两侧的吸收和转运进行研究,了解纳米乳液对于吸收转运速度的影响,明确其转运方式。纳米乳液提高生物利用率主要与活性物质的运载量、乳液稳定性、可控释放和小肠吸收转运效率有关。Lu等[10]将水溶性极差的姜黄素,制备成以有机凝胶为油相的纳米体系,极大地提升了体外脂解的速度,并通过Caco-2模拟小肠上皮细胞模拟研究了姜黄素纳米乳液的主要吸收机制,通过小鼠药代动力学实验表明姜黄素纳米乳液的口服生物利用率提升了9倍。

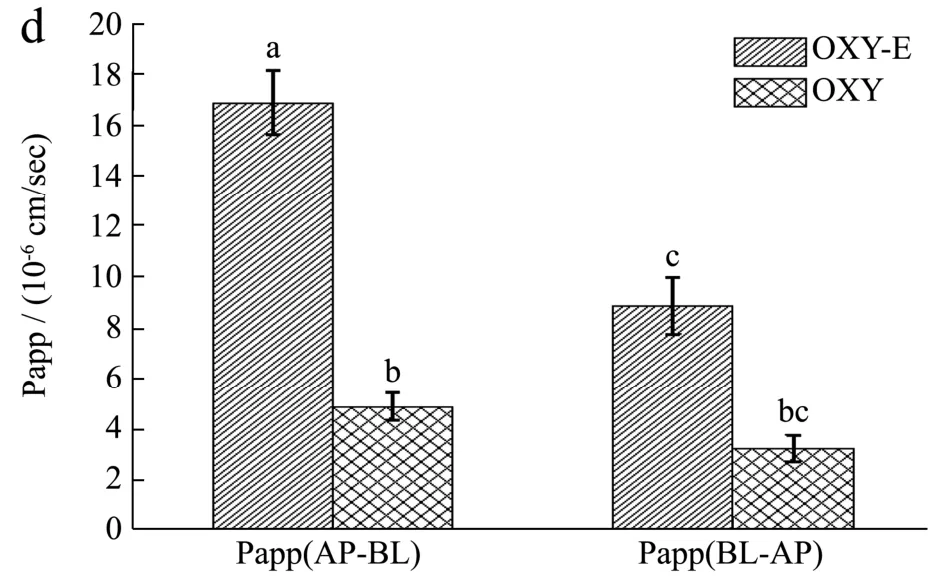
图3 Caco-2单细胞转运实验结果Fig.3 Results of Caco-2 transport experiment
由图3b中可以看出,氧化白藜芦醇样品从AP侧加样,加样量为0.5 mL,乳液样品透过量为2.69 μg,占上样量的31.98%,氧化白藜芦醇透过量1.62 μg,占上样量的17.5%,可以看出从AP至BL侧方向,乳液渗透速率大于氧化白藜芦醇物质本身;另外氧化白藜芦醇从BL侧加样(图3c),加样量为1.5 mL,乳液的透过量1.42 μg,占上样量的5.62%,氧化白藜芦醇透过量0.52 μg,占上样量的1.86%,总的来说AP侧向BL侧的渗透速率大于BL向AP方向的,OXY-E样品的透过量明显高于OXY样品,因此,由实验数据表明,氧化白藜芦醇的纳米乳液可以显著提升其在小肠上皮细胞内的吸收转运量(p<0.05),转运量提升2~4倍。
对于Caco-2单层细胞模拟小肠吸收模型,渗透速率低于10-7cm/sec为慢速渗透,介于10-7cm/sec和10-6cm/sec为中速,大于10-6cm/sec为快速吸收,表观渗透因子ER小于1/2则转运模式为主动外排机制,ER介于1/2和2之间为被动渗透机制,ER大于2为主动吸收机制。由图3d氧化白藜芦醇及其乳液作用于Caco-2单细胞层2 h后,OXY样品的渗透速率分别为Papp(AP-BL)值4.95×10-6cm/sec和Papp(BL-AP)值3.30×10-6cm/sec,则其表观渗透因子ER=Rpapp(AP-BL)/(BL-AP)=1.49,OXY为中等速度,推测为被动渗透,对于OXY-E消化后的样品的渗透速率Papp(AP-BL)值1.69×10-5cm/sec和Papp(BL-AP)值8.94×10-6cm/sec,表观渗透系数ER=Rpapp(AP-BL)/(BL-AP)=1.89,OXY-E的渗透速度上升至快速,同样为被动渗透。实验结果表明,OXY-E乳液样品的渗透速度明显高于氧化白藜芦醇样品自身的,极大地提高了OXY在小肠上皮细胞的转运速率和吸收效果(p<0.01)。胡婷婷等[34]利用Caco-2细胞模型研究8-异丙胺亚甲基橙皮素(IPHP)在小肠吸收转运的机制,分别对其作用浓度、跨膜转运速度和转运方式进行研究,结果表明,IPHP在Caco-2细胞模型上的转运方式主要是被动扩散,且其转运不受P-gp外排蛋白的影响。
2.5 氧化白藜芦醇纳米乳液Caco-2细胞摄取

图4 氧化白藜芦醇对Caco-2细胞的摄取Fig.4 Uptake of OXY-E in Caco-2 cells
通过氧化白藜芦醇作用于Caco-2单细胞模型的实验表明氧化白藜芦醇纳米乳液在2 h内可以极大地提高其在小肠上皮细胞的吸收和转运速度,为了进一步观察氧化白藜芦醇纳米乳液与Caco-2细胞作用过程中进入细胞的速度和对细胞形态变化的影响,将氧化白藜芦醇纳米乳液用香豆素6染色后进行体外模拟脂解消化再作用于Caco-2细胞,细胞核用DAPI染色,在氧化白藜芦醇纳米乳液作用不同时间段观察物质进入Caco-2细胞的量和细胞的状态。
由图4b可以看出氧化白藜芦醇作用0.5 h后有微弱的绿色荧光出现,表明物质开始进入细胞核,随着时间的增长绿色荧光逐渐增强,消化后乳液透过速度较快,大概2 h荧光达到最强,图4a结果显示,0.5 h进入Caco-2细胞中乳液的荧光强度占细胞核总荧光强度的比值为14.38%,1 h和2 h占比显著增强(p<0.01),分别为23.79%和38.36%。2 h时进入细胞内OXY-E的荧光占比最高,3 h和6 h的荧光强度占比与2 h无显著差异,与细胞的激光共聚焦图的荧光强度结果一致,表明2 h时,OXY-E在Caco-2细胞的吸收达到最高,且细胞形态保持良好,通过本实验可以观察物质进入细胞的速度与氧化白藜芦醇纳米乳液细胞转运时间的选择符合,实验结果表明,氧化白藜芦醇纳米乳液作用Caco-2细胞2 h后,吸收达到最强。
2.6 氧化白藜芦醇纳米乳液对透皮吸收的作用
由于黑色素细胞集中在表皮的最底层,药物透过皮肤表皮屏障到达真皮的交界处才可有效发挥作用。为了使药物具有更好的皮肤渗透性,很多研究者对促透体系进行研究,并通过经皮给药体系(Franz cell透皮扩散仪)研究活性物质的透皮吸收性能[27]。
氧化白藜芦醇纳米乳液和氧化白藜芦醇悬浮液分别作用于Franz cell的皮肤组织上,在0.5、1.0、2.0、3.0、6.0、9.0和12.0 h分别取样检测氧化白藜芦醇的透过量,图5a显示纳米乳液可显著提高氧化白藜芦醇的皮肤透过量,1 h氧化白藜芦醇透过量极低,纳米乳液和悬浮液的透过量分别为13.28和2.08 μg/cm2skin,6 h时透过量显著增加,纳米乳液和悬浮液的透过量分别为51.76和5.73 μg/cm2skin,12 h时皮肤组织在溶液的浸泡下开始溶胀,透过量比6 h显著增加,纳米乳液和悬浮液的透过量分别为86.85和9.49 μg/cm2skin,实验结果表明纳米乳液可以显著提高氧化白藜芦醇的透皮吸收效率。
分别采用一级释药模型、Higuchi模型、Korsemeyer-Peppas模型和零级释药模型对氧化白藜芦醇纳米乳液在不同时间点的皮肤透过量数据进行拟合,结果表明Higuchi模型的拟合效果最好,如图5b所示,R2=0.9934,表明药物的转运是由Fickian扩散驱动的,Higuchi模型是根据Fick定律对时间的算术平方根推算的,在分析药物经皮贴片、局部软膏和类似系统活性物质的药物运转方面非常适用,实验结果表明Higuchi模型适用于描述氧化白藜芦醇纳米乳液的局部释放过程[35,36]。

图5 氧化白藜芦醇纳米乳液皮肤透皮吸收过程Fig.5 Skin transdermal absorption process of OXY
由图5c中可以看出,蓝色荧光为猪皮的皮肤组织的横断面,经荧光染色的氧化白藜芦醇纳米乳液作用于皮肤后,1 h开始进行皮肤表皮上层,根据前面实验结果在6 h时开始透过皮肤表皮层进入体液循环,从6 h的皮肤组织可以看出氧化白藜芦醇乳液已经开始有部分到达表皮和真皮的交界处,12 h后红色荧光物质充满整个表皮层,说明物质在表皮层和真皮层已经开始积累和透过,且由图中可以看出12 h是皮肤组织开始变得有些松散,不够紧致,12 h后的皮肤组织已经开始变形。通过体外透皮吸收研究表明纳米乳液可显著提高氧化白藜芦醇的药物转运量,使活性物有效达到表皮基底层,发挥作用。
由氧化白藜芦醇纳米乳液透皮吸收及可视化实验可以看出,纳米乳液可以增强氧化白藜芦醇往皮肤深层的扩散,因此有助于氧化白藜芦醇天然化妆品配方设计。氧化白藜芦醇纳米乳液如纳米级液滴、粘度低、透明度高的特性非常适合化妆品配方体系[30]。同时由于对氧化白藜芦醇的包埋,增强了它的理化稳定性,因此纳米乳液的制备使氧化白藜芦醇在药剂配方、食品原料和化妆品原料的给药体系有更广阔的应用前景[37]。
3 结论
本文采用MCT和卵磷脂制备氧化白藜芦醇纳米乳液,并对其口服生物利用率及透皮吸收性能进行研究,得到以下结论:
3.1 纳米乳液显著地提高了氧化白藜芦醇在胃和肠的药物释放量,氧化白藜芦醇纳米乳液的药物释放符合Korsemeyer-Peppas释药动力学模型,过程主要受到Fickian扩散的影响。
3.2 氧化白藜芦醇纳米乳液显著地提高了氧化白藜芦醇的口服生物利用率,在模拟消化液中的生物利用率比化合物本身提升了3倍,且在进食状态下的生物利用率和脂解程度显著高于禁食状态的。
3.3 氧化白藜芦醇的纳米乳液显著提升其在小肠上皮细胞内的吸收转运量,纳米乳液使氧化白藜芦醇在小肠上皮细胞的扩散速度由中速上升至快速,扩散形式为被动渗透。氧化白藜芦醇纳米乳液对Caco-2的细胞摄取实验结果表明,作用Caco-2细胞2 h后,吸收达到最强,且细胞形态保持良好。
3.4 纳米乳液可以显著提高氧化白藜芦醇的透皮吸收效率,透皮吸收过程符合Higuchi释药模型,药物转运由Fickian扩散驱动,适用于描述氧化白藜芦醇纳米乳液的局部释放过程。
3.5 本文通过制备纳米乳液显著地提高了氧化白藜芦醇的口服生物利用率及经皮吸收效率,有效地发挥氧化白藜芦醇活的生物活性。

