陈皮酚类化合物调控AHR和NF-κB通路抗苯并芘诱导的肺上皮细胞损伤
高超,刘杰,胡峰霞
(1.南方医科大学第三附属医院药剂科,广东广州 510000)
(2.深圳大学医学部,广东深圳 518000)(3.东营市人民医院科教科,山东东营 257000)
哮喘是一种常见的慢性疾病,在世界范围内,其发病率在过去几十年中持续升高,对社会的经济造成很大的负担。研究显示,环境因素对哮喘的发病率具有很大的影响,其中大气污染是造成儿童及成人哮喘、鼻炎和支气管炎的重要原因[1]。苯并芘(Bap)是一种常见的环境污染物,化石燃料和香烟的燃烧、烧烤食物等都会产生大量的苯并芘[2],长期暴露于具有较高浓度的苯并芘的空气中会引起哮喘、鼻炎和支气管炎等呼吸道疾病,进而导致肺功能下降[3,4]。
中国传统医学在中、西方医疗保健中均发挥了重要作用,多项科学证据支持使用中药治疗哮喘的有效性。如美国食品和药物管理局所研究的抗哮喘草药干预包括灵芝、苦参和甘草三种中草药的提取物,现已进入临床试验阶段[5];而食物过敏草药配方-2(FAHF-2)已获得FDA研究新药(IND)批准并进入临床试验阶段[6]。
对于天然产物的深入研究是发现新药物的重要方式。陈皮(Pericarpium citri reticulatae)为芸香科植物橘(Citrus reticulateBlanco)及其栽培变种的干燥成熟果皮。陈皮味辛、苦,性温,入脾、肺经,具有“理气健脾,燥湿化痰”的功效,主要用于治疗消化系统和呼吸系统疾病,为食管、胃十二指肠等消化道病症最常用的药物,可治疗脘腹胀满、嗳气泛酸、恶心呕吐、便秘或腹泻等[7]。近年国内外研究人员在橘皮(orange peel)中发现了一些橘类特有的生物类黄酮成分,同时不断改进了黄酮提取的工艺[8],这些橘类黄酮具有抗氧化、抗炎、抗肿瘤等功能[9-11]。但陈皮中的酚类生物成分的抗炎的作用却鲜有报道。因此,本文将对陈皮的酚类生物成分进行分离鉴定,并对其抗Bap诱导的肺上皮细胞炎性损伤活性进行评价。
1 材料与方法
1.1 材料与仪器
陈皮购于二天堂大药房(广州市,石牌区),由暨南大学药学院陈教授鉴定。文中使用的检测试剂盒、RIPA缓冲液和RNase购于上海碧云天生物科技有限公司。抗体均购自Cell Signaling Technology(CST,USA),其它化学品均购于Sigma或Adamas。
1.2 实验方法
1.2.1 陈皮有效成分的提取、细胞培养及细胞活性检测
通过超声提取法对陈皮(620 g)酚类活性成分进行提取,并通过旋转蒸发仪对提取药液进行浓缩,获得陈皮提取物(37 g),于水/二氯甲烷体系萃取。将二氯甲烷组分(8.25 g)硅胶柱层析,用乙酸乙酯-甲醇梯度体系(100:1、10:1、1:1、0:100)洗脱,得到4个组分。将Fr.1(1.24 g)置于硅胶柱上,用二氯甲烷/甲醇梯度溶剂体系(100:5、20:1、1:1、0:100)洗脱,得到5个亚组分。组分1(0.31 g)采用半制备型高效液相色谱法(甲醇-水,40:60;流速:1 mL/min),得到化合物-1(tR 5.2 min)、化合物-2(tR 7.8 min)和化合物-3(tR 11.3 min)。组分2(0.61 g)采用半制备型高效液相色谱法(甲醇-水,30:70;流速:1 mL/min),得到化合物-4(tR 12.2 min),化合物-5(tR 15.5 min)和化合物-6(tR 19.4 min)。通过1H-NMR、13C-NMR和ESI-MS分析,鉴定其结构。
A549细胞培养于10% FBS、100 U/mL青霉素、100 μg/mL链霉素、2 mM L-谷氨酰胺等配置的DMEM培养基中(37 ℃,5% CO2)。
CCK8法测定陈皮酚类化合物对A549细胞的保护作用:将A549细胞(5×103细胞/孔)接种到含有200 μL培养基的96孔培养板中,过夜。细胞经Bap(1.0 μM)处理1.0 h,再经10 μg/mL陈皮酚类化合物孵育12 h,与对照组进行比较,用CCK8试剂盒检测细胞活力。
1.2.2 活性氧(ROS)和促炎细胞因子检测
根据检测试剂盒使用要求,对ROS及相关促炎细胞因子进行检测。将细胞5×105细胞/孔接种在6孔板中,孵育过夜后,Bap(1.0 μM)处理1.0 h,然后用aspidin BB和陈皮提取物(10 μg/mL)培养12 h。测量ROS和炎性细胞因子含量。
1.2.3 线粒体跨膜电位(ΔΨm)及细胞凋亡检测
将细胞5×105细胞/孔接种在6孔板中,孵育24 h,然后Bap(1.0 μM)处理1.0 h,然后用aspidin BB、陈皮提取物(10 μg/mL)培养12 h,收集细胞,冷PBS洗涤,37 ℃下用1 μg/mL JC-1孵育30 min。去除上清液,使用流式细胞仪检测。
将细胞5×105细胞/孔接种在6孔板中,孵育24 h,然后Bap(1.0 μM)处理1.0 h,然后用aspidin BB、陈皮提取物(10 μg/mL)培养12 h,收集细胞Annexin V-FITC/PI孵育,流式细胞仪检测分析细胞状态。
1.2.4 Western blotting实验
细胞(2×106/皿)接种于10.0 cm培养皿中培养过夜。Bap(1.0 μM)处理1.0 h,然后用aspidin BB和陈皮提取物(10 μg/mL)培养12 h,收集细胞,采集总蛋白,用Bradford蛋白测定法测定蛋白质含量。参考文献进行Western blotting蛋白分析[12]。利用Image J软件对蛋白密度进行分析。
1.3 数据处理
用Graphpad Prism 5(San Diego,USA)进行数据分析。通过Student'st-检验进行对照和治疗之间的统计学比较。所有实验至少进行3次。数据表示为平均值±标准差(¯x±sd)。p<0.05被认为具有统计学意义。
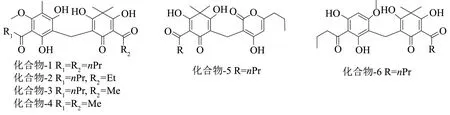
图1 化合物-1~6结构式Fig.1 Structures of compound-1~6
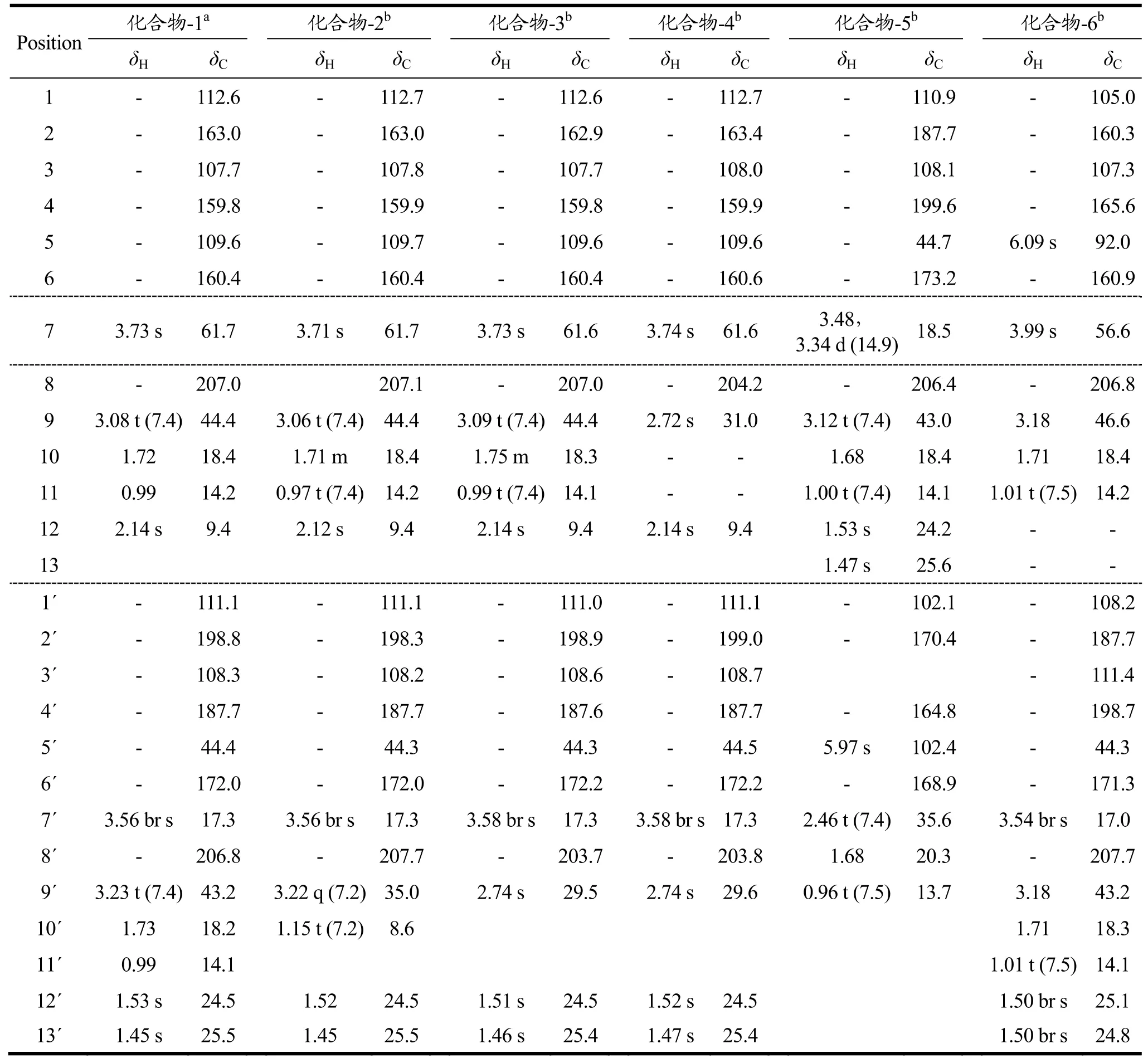
表1 化合物1~6 1H、13C NMR数据[δ/(×10-6),J/Hz]Table 1 Compound 1~6 1H, 13C NMR data [δ/(×10-6),J/Hz]
2 结果与分析
2.1 陈皮酚类化合物的分离及鉴定
本实验中我们共分离获得6个陈皮酚类化合物,分别是化合物-1~aspidin BB[13],化合物-2~aspidin PB[14],化合物-3~aspidin AB[15],化合物-4~aspidin AA[16],化合物-5~phloropyron BB[17]及化合物-6~desaspidin BB,此6个酚类化合物均为首次从陈皮中分离获得(图1)。化合物1H、13C NMR数据总结于表1中。
2.2 陈皮酚类化合物物抗炎活性检测
为避免陈皮酚类化合物对细胞的毒性损伤,我们用不同浓度的陈皮酚类化合物(0.005~5.0 mg/mL)处理A549细胞24 h,并通过CCK8测定细胞活力。结果表明,低于1.40 mg/mL,陈皮酚类化合物对细胞活力无影响(结果未展示)。
在本实验中,对照组细胞存活率设为100%;与对照组相比,Bap组细胞存活率降低17.7%(p<0.05),而陈皮酚类化合物发挥了较好的保护作用。与Bap组相比,经10 μg/mL的陈皮酚类化合物处理12 h后,A549细胞存活率分别提高了13.90%,3.90%,7.65%,8.12%,7.92%及4.31%(图2a)。我们推测,陈皮酚类化合物可减轻Bap引起的损伤。基于化合物-1具有最佳抗Bap诱导的损伤活性,接下来我们将以化合物-1为代表,继续进行深入的研究。

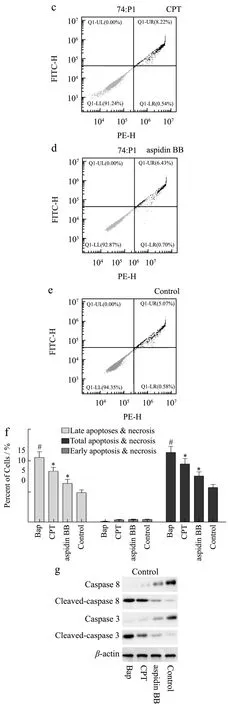
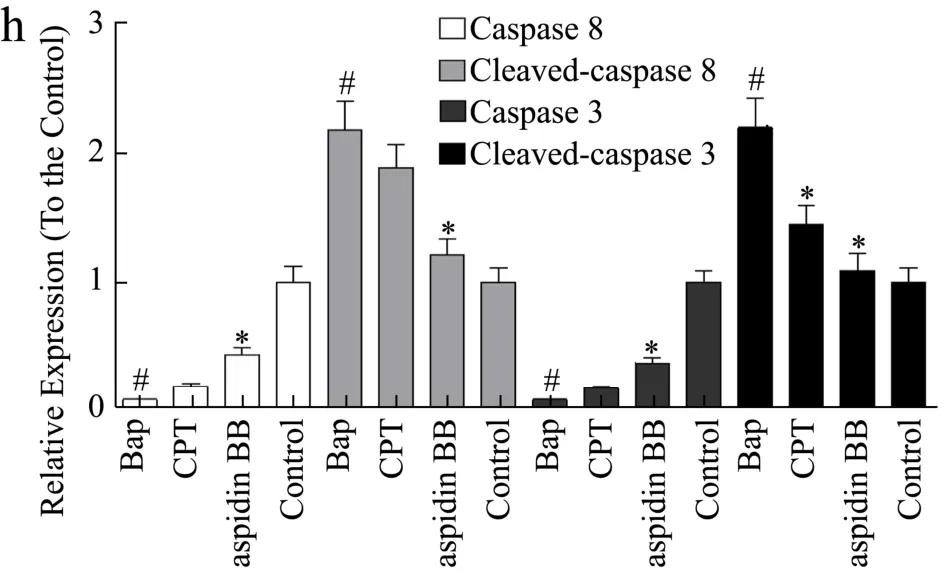
图2 Aspidin BB减少Bap诱导的A549细胞凋亡Fig.2 Aspidin BB reduces Bap-induced apoptosis in A549 cells
细胞凋亡是一种程序性细胞死亡形式,在细胞凋亡过程中细胞形态会发生显著的变化,如细胞收缩、核碎裂和染色质凝聚等;本实验中,与对照组相比,Bap组细胞凋亡率为5.62%。而与Bap组相比,陈皮提取物组及化合物-1(aspidin BB)治疗组细胞凋亡率分别降低1.78%和3.74%(图2b~f);caspase蛋白是细胞凋亡过程中重要的终末剪切酶,cleaved-caspase则为caspase蛋白的活化形式,在细胞凋亡过程中起到重要作用。因此,本实验中检测了陈皮酚类化合物对Bap诱导的caspase蛋白激活抑制活性。实验结果显示,Bap诱导的caspase-3,8蛋白激活被aspidin BB抑制(图2g、h)。可见,细胞凋亡实验为陈皮提取物及aspidin BB减弱Bap诱导的A549细胞损伤提供了直观的证据。
2.3 aspidin BB抗Bap诱导的氧化应激活性评价
自由基产生过剩或抗氧化能力下降会导致细胞DNA损伤及细胞凋亡[18]。在炎症发展过程中,减少ROS的生成是减轻炎性损伤的一种潜在策略。将对照组的ROS含量设为1,结果如图3a所示。与对照组相比,Bap组的ROS含量升高2.73倍(p<0.05)。而Bap诱导的ROS含量升高被aspidin BB、陈皮提取物明显抑制。aspidin BB、陈皮提取物处理后,ROS含量分别降低20.23%(p<0.05)和45.61%(p<0.05)。
线粒体依赖性途径在细胞氧化应激过程中起着重要作用[18]。为了研究aspidin BB、陈皮提取物抗Bap诱导的A549细胞氧化损伤的机制,我们检测了细胞ΔΨm的变化情况。如图3b所示,Bap处理使ΔΨm显著下降[3.39%(对照组)下降到15.30%(p<0.05)]。经aspidin BB处理后,ΔΨm下降被显著抑制。综上所述,aspidin BB降低了细胞内ROS的积累,抑制了A549细胞的ΔΨm下降。进一步证实,aspidin BB可通过清除ROS,保护A549细胞免受氧化应激损伤。

图3 Aspidin BB抑制Bap诱导的ROS生成及ΔΨm降低Fig.3 Aspidin BB inhibits Bap-induced ROS production and decreases ΔΨm
线粒体功能紊乱会导致细胞色素c(Cyt c)从线粒体释放到胞质中,进而导致细胞抗氧化能力降低。本实验结果显示,Bap刺激导致细胞质Cyt c显著升高,线粒体Cyt c降低(图3)。然而,aspidin BB扭转了Bap诱导的细胞质和线粒体Cyt c含量的变化。
2.4 aspidin BB对Bap诱导的细胞炎症因子分泌的影响
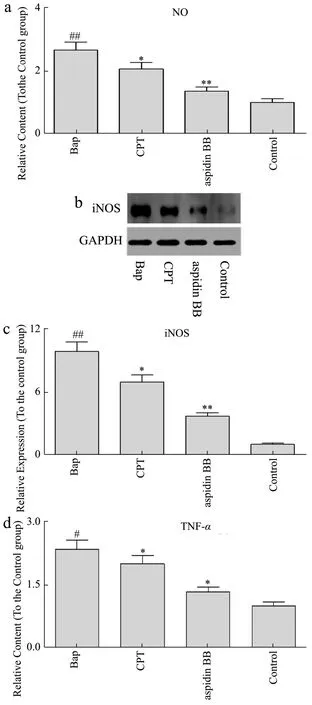

图4 Aspidin BB抑制Bap诱导的炎性因子分泌及iNOS表达Fig.4 Aspidin BB inhibits Bap-induced inflammatory factor secretion and iNOS expression
炎症介质如炎性细胞因子、基质金属蛋白酶(MMPS)、TNF-α和NO的表达可反映炎症的变化情况。研究显示Bap诱导的细胞损伤可能是由NO的过度产生引起的。过量的NO可以通过破坏线粒体电子传递链的功能来诱导细胞损伤[19]。为了研究aspidin BB在Bap诱导的A549细胞中是否具有抗炎能力,我们检测了培养基中的NO含量。
如图4a所示,与对照组相比,Bap刺激显著诱导了NO释放(1.66倍,p<0.05)。而陈皮提取物治疗组,NO含量显著降低。陈皮提取物及aspidin BB处理后,NO含量分别下降22.91%(p<0.05)和49.22%(p<0.05)。一氧化氮合酶(iNOS)可催化产生一氧化氮,而细胞可通过上调iNOS表达而产生NO。为了进一步探讨陈皮提取物对NO的下调机制,我们进一步研究了细胞中iNOS的表达情况。如图4c所示,Bap刺激显著增加了iNOS的表达。然而,陈皮提取物及及aspidin BB处理降低了iNOS的表达,这表明陈皮提取物及aspidin BB可以通过抑制iNOS的表达来降低NO的产生。
炎症还表现为炎症细胞因子的表达增加,如IL-1β和TNF-α可刺激iNOS和NO的产生。IL-1β、TNF-α和IL-6与自身免疫性疾病有广泛的关系。此外,过量的细胞因子和iNOS介导的NO产生与炎症的发生有着密切的关系。因此,我们进一步检测了培养基中TNF-α、IL-6和IL-1β的含量。
如图4d~f所示,与对照组相比,Bap使TNF-α、IL-6和IL-1β含量分别增加了133%、57.9%和74.2%。而与Bap组相比,陈皮提取物及aspidin BB显著降低了TNF-α、IL-6和IL-1β含量。aspidin BB作用后使TNF-α、IL-6和IL-1β含量降低了(42.94%,p<0.05)、(26.79%,p<0.05)和(37.86%,p<0.05)。以上实验结果表明,陈皮提取物抑制了Bap诱导的NO产生,下调了iNOS的表达。因此我们推测,陈皮提取物可通过抑制iNOS介导的NO产生,以及TNF-α、IL-6和IL-1β等炎症因子的产生来发挥抗炎作用。
2.5 aspidin BB对NF-κB信号通路的影响
NF-κB信号通路在许多慢性炎症性疾病中被激活,也被称为促炎介质(如TNF-α和IL-1β)的转录因子,控制多种参与炎症的相关基因的表达。研究显示巨噬细胞可通过NF-κB信号通路上调iNOS表达,从而产生NO[20]。如图5a、b所示,与Bap组相比,陈皮提取物及aspidin BB显著抑制了Bap诱导的p-IκBα、p-IKKα及p-p65表达。aspidin BB处理使Bap诱导的p-IκBα蛋白的表达降低了51.91%(p<0.05)。此外,aspidin BB处理也显著抑制Bap诱导的p-IKKα及p-p65的表达(p<0.05)。
2.6 aspidin BB抑制Bap诱导的芳基烃受体活化
研究表明,AHR信号通路在调节过敏性哮喘和炎症性疾病中起着重要作用[21]。为了确定aspidin BB及陈皮提取物是否抑制Bap诱导的AHR活化。我们检测了AHR及其下游主要蛋白cyp1a1的表达。结果显示,Bap刺激使AHR及CYP1A1的表达显著增加。而aspidin BB及陈皮提取物显著抑制了Bap诱发的AHR信号激活(图5c、d)。


图5 陈皮提取物抑制调控NF-κB、AHR信号通路相关蛋白表达Fig.5 Pericarpium citri reticulatae extract inhibits the expression of proteins associated with NF-κB and AHR signaling pathways
3 结论
本研究发现环境污染物Bap暴露会诱发肺上皮细胞氧化应激及炎性因子分泌,激活NF-κB和AHR信号通路,进而诱发炎症反应。我们分离的陈皮提取物及酚类化合物具有极好的抗Bap诱导的氧化损伤及炎性损伤的活性。实验结果显示,aspidin BB和陈皮提取物抑制了Bap诱导的iNOS表达及炎性细胞因子IL-1β、IL-6和TNF-α等的分泌。进一步研究发现,aspidin BB和陈皮提取物的抗炎活性可能是基于调节NF-κB和AHR途径,进而调节炎性细胞因子的表达、增强细胞的抗炎及抗氧化能力。

