微创冷冻消融术对中晚期非小细胞肺癌患者肿瘤标志物、免疫功能及预后的影响*
张春宁,李超明,李明尧,林华明
广东省茂名市人民医院肿瘤科,茂名 525000
肺癌是常见的恶性肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占全部肺癌病例80%以上,且发病率呈逐年增加趋势[1]。NSCLC的主要治疗方式为手术治疗,但部分处于中晚期的患者在确诊时已丧失手术机会,常需要放化疗,旨在杀死残余的肿瘤细胞,延长患者生存时间及提高生存质量[2]。尽管如此,受困于药物不良反应和耐药性,中晚期肺癌患者病情进展迅速,疗效并不理想[3]。微创冷冻消融治疗是通过氩氦刀,在肿瘤局部释放超低温,以达到杀死肿瘤细胞的治疗方法[4]。微创冷冻消融术在原发性肝癌[5]、软组织肉瘤[6]、滑膜肉瘤[7]及胃癌肝转移[8]患者的治疗中均有临床应用。本研究旨在探讨微创冷冻消融术对中晚期NSCLC患者肿瘤标志物、免疫功能及预后的影响。
1 资料与方法
1.1 研究对象选择及分组
纳入2017年1月至2018年1月在茂名市人民医院肿瘤科确诊为中晚期NSCLC的患者。纳入标准:①经肺部CT、临床表现、肺癌标志物及病理检查确诊为NSCLC的患者;②不能接受手术切除治疗,且TNM分期(第七版)为Ⅲb或Ⅳ期的患者;③心、肝、肾功能可耐受冷冻消融治疗;④经Karnofsky评分,结果≥70分。排除标准:①患者存在意识障碍、痴呆、精神障碍;②伴有严重内科疾患及感染。患者分为联合治疗组和单纯化疗组,其中联合治疗组共45例,接受微创冷冻消融术+化疗,单纯化疗组共56例,仅接受化疗。本研究征得茂名市人民医院伦理委员会批准实施。
1.2 治疗方案
联合治疗组行微创冷冻消融术+化疗。微创冷冻消融术方法:患者消毒铺巾后,行CT扫描确定肿瘤的大小和体积,设计好进针入路,术前先让患者舌下含服2片可待因,再经2%利多卡因局麻后,确定角度、深度及方向后穿刺进针,到达靶点后,启动超低温冷冻系统,随后速降温度至-150℃~-130℃,维持15 min,待冰球覆盖肿瘤大小后,氦气复温至15℃,重复上述循环,拔出氩氦刀,加压包扎,对于肿瘤偏大,一次微创冷冻消融冰球无法全部覆盖的肿瘤,给予多针微创冷冻消融。监测有无并发症及生命体征。单纯化疗组仅给予药物治疗,其中鳞癌化疗方案为紫杉醇+顺铂,腺癌化疗方案为培美曲塞+顺铂。微创冷冻消融术后靶向药物的使用均根据表皮生长因子受体(epidermal growth factor receptor,EGFR)突变情况决定,EGFR突变型采用吉非替尼分子靶向药物治疗,EGFR野生型不给予吉非替尼分子靶向药物。
1.3 观察指标
①血清学指标:在接受微创冷冻消融术治疗前1天和治疗后1个月,分别采集两组患者外周血5 mL,保存于-20℃冰箱待测,采用ELISA法测定癌胚抗原(CEA)、鳞状细胞癌抗原(SCCA)和细胞角蛋白19片段(Cyfra21-1)浓度。②免疫功能指标包括T淋巴细胞及调节性T淋巴细胞检测。外周血T淋巴细胞检测:在待测的外周静脉血中,加入20 μL CD4、CD8、CD3抗体(美国BD生物公司),加入细胞裂解液裂解10 min,离心5 min,弃上清,再行流式细胞仪检测;调节性T淋巴细胞(regulatory T cell,Treg)检测:取100 μL静脉血,加入CD4-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)单抗、CD25-FITC单抗,细胞裂解液裂解后,取上清,再行流式细胞仪检测。③肿瘤反应评价:评价标准采用实体瘤疗效评价标准[9],疗效包括4类,即完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。总有效率=(CR+PR)例数/总例数×100%。④整体生存情况:治疗后2年内,随访两组患者的病情变化情况,计算中位总生存期和总生存率。
1.4 随访方法
采用门诊和电话随访相结合的方式,每3~6个月随访1次,中位随访期15个月,随访截止时间2020年6月,随访内容包括患者生存情况。共失访3例。
1.5 统计学方法
符合正态分布的计量资料采用(平均数±标准差)表示,两组间均数的比较采用t检验;不符合正态分布的计量资料,采用中位数表示,组间比较采用秩和检验;计数资料组间比较,采用卡方检验。统计学软件采用SPSS 19.0版,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般情况比较
两组患者性别、年龄、病理类型、TNM分期、肿瘤位置及肿瘤大小比较,差异均无统计学意义(均P>0.05)。联合治疗组EGFR突变有22例(48.9%),单纯化疗组有28例(50%),对于EGFR突变者给予吉非替尼治疗,见表1。
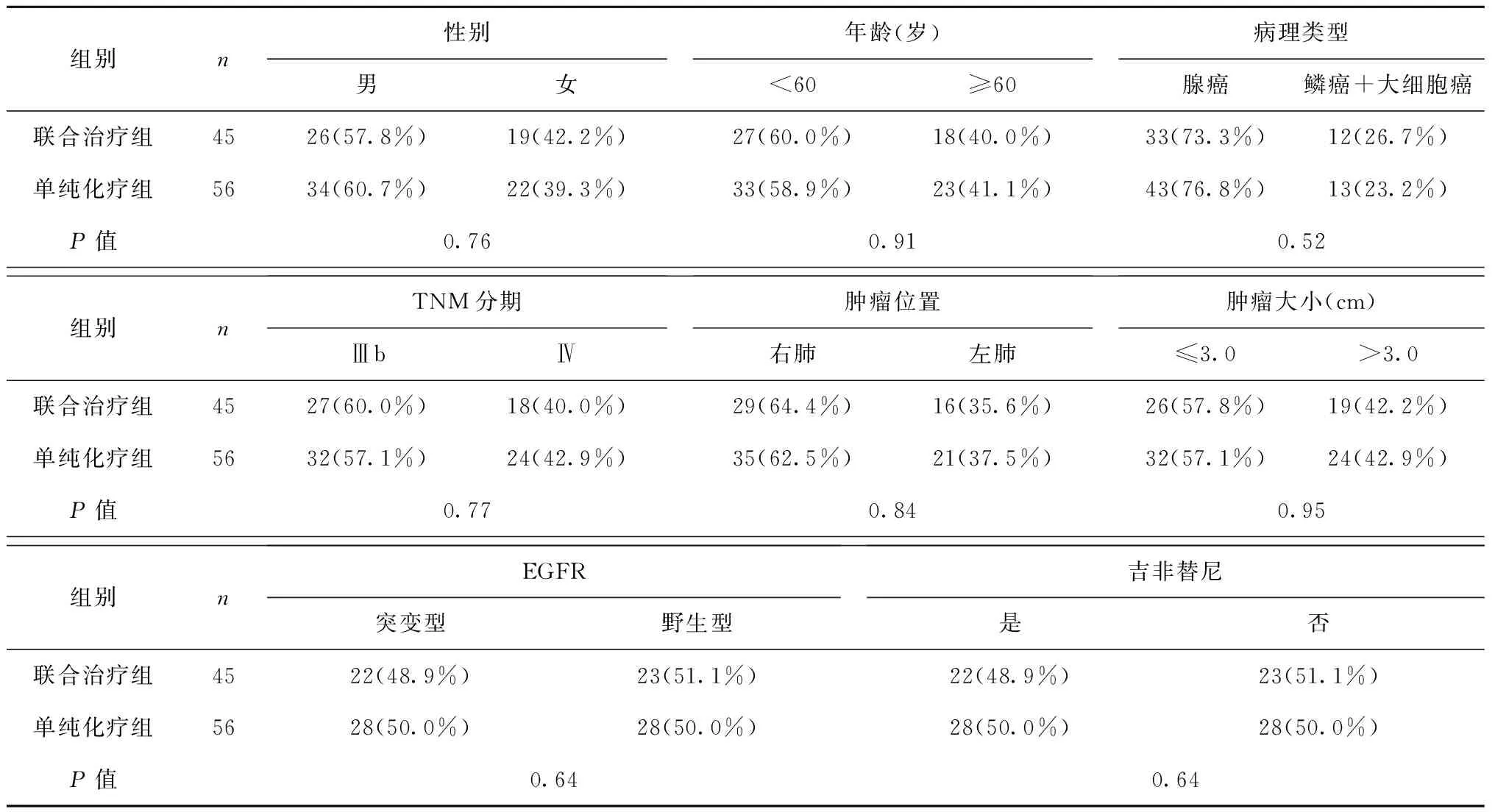
表1 联合治疗组与单纯化疗组患者一般情况比较Table 1 Comparison of general conditions of patients in combined treatment group and chemotherapy alone group
2.2 两组疗效的比较
微创冷冻消融术后,肿瘤形成冰球,随访肿瘤体积变小,坏死并形成空腔,见图1。微创冷冻消融术后1月,联合治疗组CR 0例、PR 20例、SD 4例、PD 21例,总有效率为44.4%(20/45);单纯化疗组CR 0例、PR 10例、SD 6例、PD 40例,总有效率为17.9%(10/56),联合治疗组总有效率高于单纯化疗组,差异有统计学意义(P<0.05)。

A:胸部CT显示右上叶一个1.5 cm大小结节;B:CT引导下冷冻探针形成冰球覆盖肿瘤;C:CT扫描示肿瘤消退,空腔形成图1 NSCLC患者接受微创冷冻治疗术前后CT图Fig.1 CT images of NSCLC patients before and after minimally invasive cryoablation therapy
2.3 治疗前后两组患者血清肿瘤标志物比较
联合治疗组和单纯化疗组患者在治疗前血清肿瘤标志物CEA、SCCA和Cyfra21-1浓度间差异无统计学意义(均P>0.05),经微创冷冻消融术治疗1月后,联合治疗组血清肿瘤标志物CEA、SCCA和Cyfra21-1浓度低于单纯化疗组,差异有统计学意义(均P<0.05),见表2。
2.4 两组患者治疗前后机体免疫功能的比较
两组患者在治疗前外周血中CD3+(%)、CD3+CD4+(%)、CD3+CD8+(%)、CD4+/CD8+比较差异无统计学意义(均P>0.05),微创冷冻消融术治疗1月后,联合治疗组血清中CD3+(%)、CD3+CD4+(%)、CD3+CD8+(%)、CD4+/CD8+均高于单纯化疗组(均P<0.05),见表3。
2.5 两组患者治疗前后机体Treg细胞水平比较
治疗前,联合治疗组和单纯化疗组外周血中CD4+CD25+(%)和CD4+CD25+/CD4+比较差异无统计学意义(均P>0.05),经微创冷冻消融术治疗1月后,联合治疗组CD4+CD25+(%)和CD4+CD25+/CD4+均低于单纯化疗组(P<0.05),见表4。
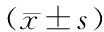
表2 联合治疗组与单纯化疗组患者治疗前后血清肿瘤标志物的比较Table 2 Comparison of serum tumor markers between combined therapy group and chemotherapy alone group before and after treatment
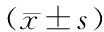
表3 联合治疗组与单纯化疗组患者治疗前后外周血T淋巴细胞水平的比较Table 3 Comparison of peripheral blood T lymphocyte levels between combined therapy group and chemotherapy alone group before and after
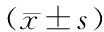
表4 联合治疗组与单纯化疗组患者治疗前后外周血Treg细胞水平比较Table 4 Comparison of Treg cell levels in peripheral blood of patients in combined therapy group and chemotherapy alone group before and after treatment
2.6 联合治疗组与单纯化疗组中位生存时间和总生存率比较
生存曲线分析示,联合治疗组与单纯化疗组的中位生存时间分别为12.9个月和7.5个月,1年生存率分别为53.6%和35.4%,两组间差异有统计学意义(Log-Rank=10.68,P<0.01),见图2。

图2 联合治疗组与单纯化疗组患者生存曲线比较Fig.2 Comparison of survival curve between combined treatment group and chemotherapy alone group
3 讨论
肺癌是致死率排第1位的恶性肿瘤,早期肺癌经手术切除后可达到根治的目的[9],令人遗憾的是大部分肺癌患者诊断时就处于中晚期,失去手术治疗机会而导致5年生存率不足15%,严重影响患者预后[10]。中晚期无法手术治疗的肺癌患者治疗方法为放化疗联合分子靶向治疗。尽管如此,由于放化疗的耐药性和多种并发症,患者预后仍不理想。近年来,冷冻疗法逐步用于治疗肺部恶性病变,例如经皮冷冻手术是治疗晚期肺癌的选择之一[11]。目前认为缺乏手术指征的晚期患者和可能出现致命并发症而不能手术的肺癌患者均可采用冷冻疗法,氦气刀冷冻消融术是冷冻治疗的一种,是局部肿瘤微创治疗手段,其主要通过细胞和血管损伤对肿瘤组织产生破坏效应[12]。氩氦刀应用于肿瘤治疗已有报道,李静等[6]报道氩氦刀冷冻消融术可用于软组织肉瘤的治疗,且患者耐受较好,不良反应较少。张永远等[7]报道CT引导下氩氦刀冷冻消融可用于滑膜肉瘤的治疗,且临床缓解效果较好,安全性佳。常旭等[8]报道氩氦刀冷冻消融在对胃癌肝转移肿瘤局部控制率、总生存率及无进展生存指标上均有较好的效果。
血清肿瘤标志物常用于诊断恶性肿瘤,并有助于病情判断。CEA、SCCA及Cyfra21-1均是肺癌的肿瘤标志物,CEA浓度随肿瘤进展而升高,但特异性较低。SCCA是鳞状细胞癌相关抗原,在鳞状细胞癌患者血清中大量存在。而Cyfra21-1全称为角蛋白19的可溶性片段,其起源于上皮细胞源性肿瘤,并分泌进入血循环中[13]。本研究发现联合治疗组患者在冷冻消融术后1月血清肿瘤标志物CEA、SCCA和Cyfra21-1浓度均低于单纯化疗组,显示经冷冻消融术治疗的患者肿瘤释放至血清中的肿瘤标志物浓度显著降低,其可能原因为氦气刀所产生的冷冻效应导致肿瘤组织发生不可逆性坏死,大量肿瘤细胞被消灭,产生减瘤效应,机体肿瘤负荷降低,从而导致血清中肿瘤标志物水平显著降低。
本研究发现联合治疗组在冷冻消融术治疗后1月血清中免疫功能相关指标CD3+(%)、CD3+CD4+(%)、CD3+CD8+(%)、CD4+/CD8+均显著高于单纯化疗组,提示经过冷冻消融术后患者体内的细胞免疫功能较单纯化疗组提高。大量研究显示T淋巴细胞是肿瘤免疫的重要组成部分,其中CD3+T淋巴细胞在肿瘤细胞免疫清除中起关键作用,CD4+T淋巴细胞是主要的辅助性T细胞,其除了发挥对肿瘤细胞的直接杀伤作用外,尚存在免疫记忆功能,可发挥机体对肿瘤细胞的再次免疫,CD8+T淋巴细胞为细胞毒性T淋巴细胞,其对肿瘤免疫应答具有负向调节作用。在T淋巴细胞亚群中,CD4+和CD8+T淋巴细胞常用于自身免疫功能的评估,可调节肿瘤免疫状态[14]。CD4+CD25+T细胞在自身免疫耐受及免疫逃逸中扮演着重要作用[15]。Treg细胞则可下调免疫共刺激及粘附分子的表达,对抑制性细胞因子具有促进作用,抑制自身免疫反应[16]。与肿瘤细胞活跃程度密切相关的则是Treg细胞,其数量与肿瘤细胞增殖成正比,并可用于肿瘤预后判断[17]。本研究发现,经冷冻消融治疗后的患者CD4+CD25+(%)水平及CD4+CD25+/CD4+均比治疗前低,且治疗后联合治疗组低于单纯化疗组,表明冷冻消融术对肿瘤细胞增殖速度具有一定的延缓作用,并可促进清除肿瘤细胞。
本研究发现接受冷冻消融术患者的临床疗效优于接受单纯化疗的患者,主要表现在联合治疗组总有效率高于单纯化疗组(44.4%vs. 17.9%,P<0.05)。诚然,单纯化疗组总有效率在17.9%,低于文献报道[18]的30%,其原因可能与本研究所纳入的患者TNM分期均为Ⅲb及Ⅳ期,没有纳入早中期患者有关,而其他文献所纳入的TNM早中期患者较多,这可归因于一定的选择偏倚。同时联合治疗组与单纯化疗组的中位生存时间分别为12.9个月和7.5个月,1年生存率分别为53.6%和35.4%。文献报道[18]在一项大样本研究中,对840例NSCLC患者(Ⅱa~Ⅳ期)进行冷冻治疗后,NSCLC患者肿瘤体积缩小后空腔形成,其中完全缓解和部分缓解患者分别为86例(14.4%)和588例(70%),该研究认为接受微创冷冻治疗的患者生存率高于化疗或化疗联合放射治疗患者,且平均总生存期为23个月。在本研究中也可发现接受微创冷冻治疗的患者在肿瘤结节部位形成冰球,并且完全覆盖肿瘤部位,在随访过程中肿瘤体积变小而逐步消退,肿瘤部位空腔形成。
微创冷冻消融术治疗晚期癌症的机制主要体现在以下几个方面:首先,氩氦刀瞬间降温引起的冷冻效应会引起肿瘤组织坏死,从而降低机体肿瘤负荷[19],本研究中发现血清肿瘤标志物CEA、SCCA和Cyfra21-1浓度显著降低也证实上述机制;其次,微创冷冻治疗可促进机体对肿瘤的免疫应答能力[20]。本研究中发现冷冻消融术后患者细胞免疫功能较单纯化疗组显著增强。
总之,微创冷冻消融术治疗中晚期NSCLC较单纯化疗能显著降低患者血清肿瘤标志物水平,提高T细胞的免疫功能,具有较好的治疗效果。

