成纤维细胞生长因子23与心房颤动的相关性
田东华,蒋希萌,李萌博
成纤维细胞生长因子-23(circulating fibroblast growth factor 23,FGF-23)是激素类成纤维细胞生长因子家族的一员,主要在骨细胞或成骨细胞中表达,通过肾脏清除。其主要生理作用为抑制肾小管对磷的重吸收,降低肾脏I-羟化酶活性,抑制1,25(OH)2-D3的合成,减少饮食中磷的吸收,从而维持机体的血磷水平。慢性肾功能不全(CKD)患者中,FGF-23水平显著升高,并与其预后密切相关[1,2]。近年来的研究还表明,FGF-23与CKD患者心房颤动(AF)、心力衰竭(HF)、冠状动脉疾病(CAD)、左室肥厚(LVH)及心血管死亡的发生发展密切相关[3],但尚不清楚这种相关性是否独立于CKD及其他合并疾病而存在。因而,本研究通过检测肾功能正常人群中FGF-23水平,来评估FGF-23水平与NAF的关系。
1 对象与方法
1.1 对象 连续入选2012-01至2015-12到我院体检中心行健康体检的1524例受检者。所有受检者入选时需完善1次12导联心电图及1次动态心电图(Holter)检查,相应图像由两位独立的心内科医师审核评估。研究对象的排除标准包括:(1)所有既往或入选时诊断为AF、心房扑动、房性心动过速、二度或三度房室传导阻滞,或既往置入永久性心脏起搏器或置入式心脏复律除颤器(ICD)的患者;(2)合并风湿性心脏病或CKD[估计的eGFR<60 ml/(min·1.73 m2)]的患者;(3)甲状腺功能亢进或减低患者。最终1152例受检者入选本研究。
1.2 方法
1.2.1 临床资料收集 记录所有受检者人口统计学资料、病史、心血管危险因素、24 h-Holter指标及用药史。高血压定义为患者静息血压超过140/90 mmHg或服用降压药物。
1.2.2 血液检查 (1)常规生化检测,包括血肌酐(SCr)、尿素氮(BUN)、白蛋白(Alb)、碱性磷酸酶(ALP)、总胆固醇(TG)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-c)、低密度脂蛋白胆固醇(LDL-c)、空腹血糖、钙、磷,由本院生化室采用Bayer ADVIA 1650自动生化仪检测。肾小球滤过率(eGFR)经简化的肾脏病膳食改良(MDRD)公式计算。(2)高敏C反应蛋白(hs-CRP)采用散射速率比浊法,由Beckman Array 360 System测定。(3)甲状旁腺素(PTH)、25羟维生素D3的测量均采用同位素化学发光法测定(上海罗氏公司)。(4)酶联免疫法测定血清全段FGF23水平,采用日本Kainos试剂盒(Kainos实验室,日本东京),按说明书操作,并根据FGF-23水平四分位数将全部研究对象分为4组。
1.2.3 心脏超声心动图检查 采用美国GE-V2V13型彩色多普勒超声仪,由专职超声医师做检测,检测指标:左房大小(LA,以左房前后径表示),左室舒张末期内径(LvEDd)、左室后壁厚度(LVPWT)、室间隔厚度(LVST)、左室射血分数(LVEF)。以上数据均测量3个心动周期,取平均值。按Deverux校正公式计算左室质量(LVM)和LVMI。LVMI(g/m2)=LVM/体表面积(BSA)。LVM(g)=0.8积(0.04×[(IVST+LVPWT+LVEDd)3-LVEDd3]+0.6,BSA(m2)=0.0061P身高(cm)+0.0128P体质量(kg)-0.1529。并将女性LVMI>85.3 g/m2或男性>107.8 g/m2定义为左室肥厚(LVH)[4]。
1.2.4 随访 所有患者入选后每年随访1次,随访内容包括询问病史、查阅就诊记录及病历资料、复查1次心电图及1次Holter检查,记录患者新出现的AF(new-onset AF,NAF)。

2 结 果
本研究最终入选1152例患者,平均年龄56.6岁,男509例(44.2%)。血清FGF-23水平分布范围为3.0~178.7 pg/ml,其中98.7%的研究对象FGF-23水平<100 pg/ml,FGF-23水平中位值及四分位值为37.5 pg/ml(30.3~46.3 pg/ml),根据FGF-23水平将研究对象分为4组。如表1所示,FGF-23水平较高组男性比例、体质量指数(body mass index,BMI)、高血压、糖尿病、冠状动脉疾病、LVH所占比例均较高;eGFR水平较低,而血磷、PTH水平偏高(P均<0.05)。而各组研究对象之间,年龄、BMI、左房大小、hs-CRP、NT-pro BNP、25羟维生素D3、血钙水平差异无统计学意义。
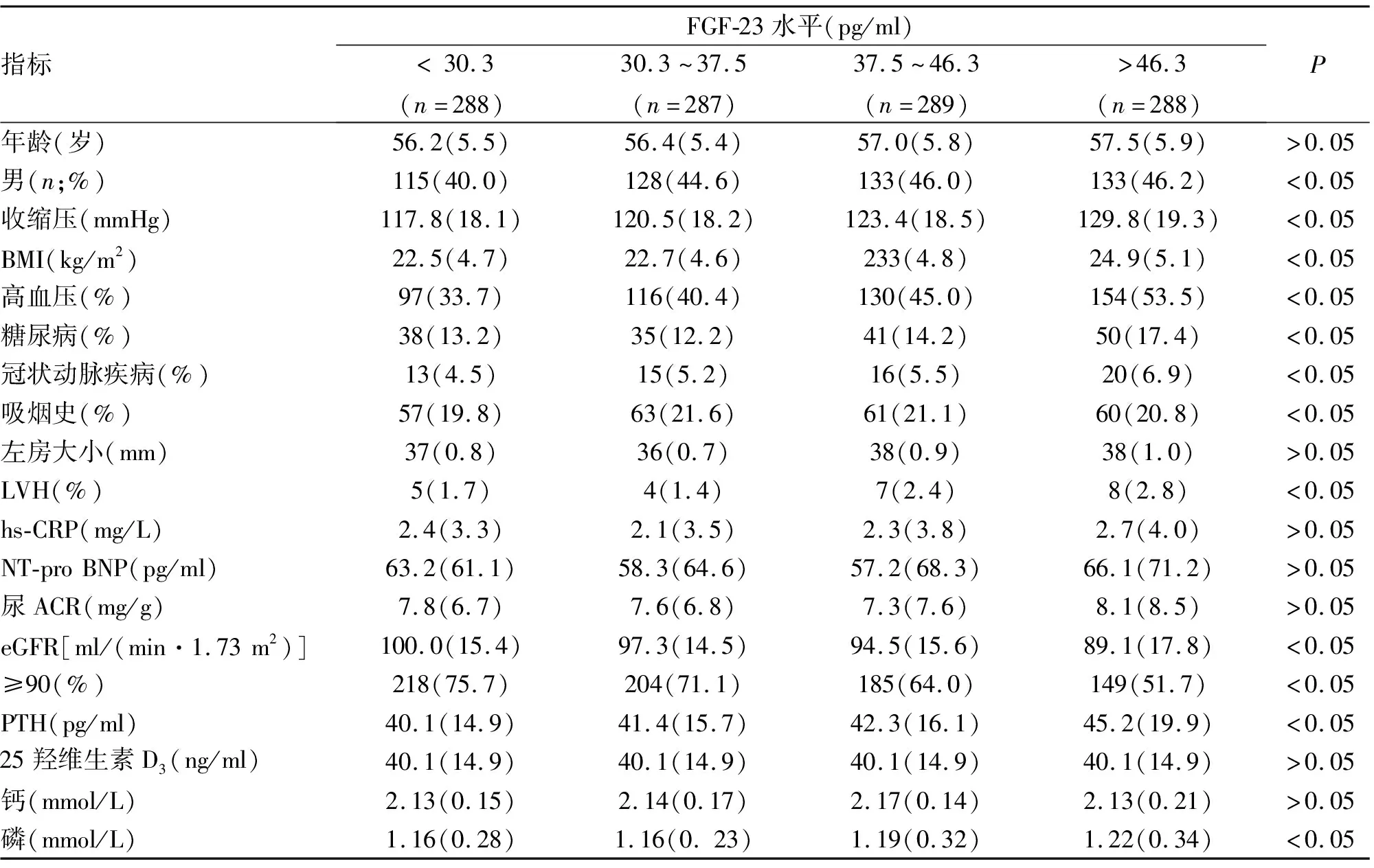
表1 无慢性肾疾病人群不同FGF-23水平组研究对象基线资料比较
本研究中,1152例研究对象3年后随访,共35例出现NAF(3.0%)。不同FGF-23水平组NAF发生率及多因素回归分析结果如表2所示,高FGF-23水平组研究对象中NAF发生率明显高于低水平组(P<0.05)。在校正患者人口统计学、合并疾病、矿物质代谢指标及超声参数后,以FGF-23水平最低组作为对照,FGF-23水平最高组研究对象发生NAF的风险为1.61(1.03,2.53),差异有统计学意义(P<0.05)。
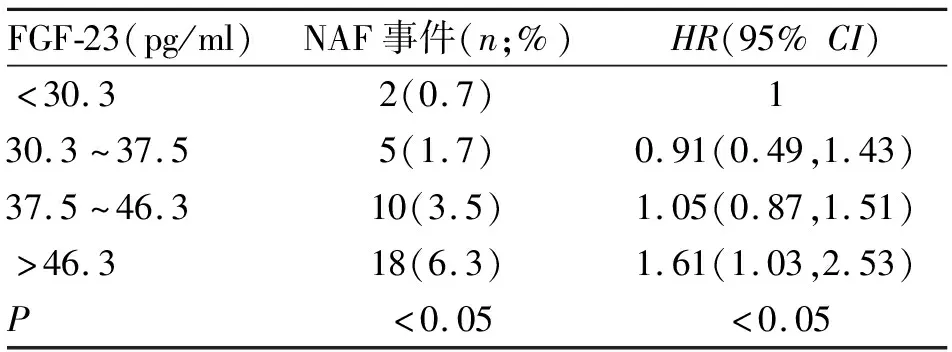
表2 无慢性肾疾病人群FGF-23水平与NAF发生的关系
3 讨 论
FGF-23主要由骨原细胞和成骨细胞产生和分泌,是体内重要的内分泌激素,在调节机体血磷稳定方面发挥重要作用,同时还参与骨的矿化和分化等。CKD患者体内FGF-23水平随肾功能减退而显著高于正常水平,并与心血管疾病的发生发展密切相关[5,6]。本研究则证实肾功能正常患者中,循环FGF-23水平可以预测NAF的发生,且这种相关性独立于患者的人口统计学资料、合并疾病及矿物质代谢指标。
既往多项研究评估了FGF-23与NAF的关系,但结论尚未达成一致。Miyamura等[7]发现,FGF-23水平与NAF关系呈U形曲线,高水平或低水平FGF-23均导致AF发生率增高。但Alonso等[8]对ARIC研究的分析未发现这种相关性。这可能与不同研究设计、入选患者、随访时间、分析方法不同有关,本研究则首次入选了无心血管基础病及CKD的表观健康人群,证实了高水平FGF-23在健康人群中可预测NAF。
目前,FGF-23导致NAF增加的具体机制尚不明确,推测可能与如下机制有关:首先,血清FGF-23水平升高与心脏负性重构相关,包括左室质量增加、左室肥厚[9,10]及左室舒张功能受损,进而导致左房充盈压升高、左房扩大,并与心房纤维化相关[11,12],从而导致房性心律失常的发生。其次,高水平FGF-23可通过增加过氧化物水平,抑制一氧化氮(NO)生物活性而导致内皮功能障碍,并与血管钙化有关,从而导致AF发生[13]。此外,FGF-23还可以抑制1,25(OH)2D3(活性维生素D)的产生,而体内活性维生素D可降低血压、改善包括心肌纤维化和舒张功能障碍在内的心脏负性重构[14],因此,高水平FGF-23可通过降低维生素D水平而影响心脏重构,对AF的发生产生影响[15]。
本研究证实了健康人群中高水平FGF-23与NAF相关,但本研究为观察性研究,这种相关性仍有可能受到未知混杂因素的影响。FGF-23作为机体磷代谢复杂途径中的一个标志物,受到许多其他因素的影响,因而FGF-23究竟是AF发生的危险因素,还是其他危险因素的调节机制,目前仍无法回答,需要进一步研究予以评估和证实[16]。此外,本研究通过临床随访、查阅病历资料、心电图和Holter检查来证实患者是否发生NAF,确诊的NAF事件较少,可能与遗漏部分NAF事件有关,因而可能影响分析结果,未来的研究中可能需要更加有效的方式来记录和诊断NAF事件。
综上所述,本研究结果证实,作为调节机体矿物质代谢的重要因子,健康人群中FGF-23水平升高可预测NAF的发生,提示其可作为预测NAF发生的标志物,用于临床和科研中。未来,阐述FGF-23与NAF相关的直接和间接机制是很有必要的,从而为AF和其他心血管事件的预防、诊断和治疗提供新思路。

