12个单核苷酸多态性位点与儿童急性淋巴细胞白血病易感性的关系
莫一啸,王桢,王盼,沈树红,2
1.温州医科大学附属第二医院育英儿童医院 儿童血液科,浙江 温州 325027;2.上海交通大学医学院附属上海儿童医学中心 血液肿瘤科,上海 200127
白血病是儿童恶性肿瘤疾病中最高发的疾病,发病率近4/10万,其中急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)约占白血病患儿的70%[1-3]。近年来以危险度分层为指导的规范化治疗不断完善与改进,使得儿童ALL成为最可治愈的癌症[4]。在我国,据SCMC-ALL-2005临床研究报道,儿童ALL 5年生存率达80%[5]。尽管如此,ALL对每一个患儿及其家庭的影响和压力仍巨大。最根本的解决办法是防止ALL的发生,而预测ALL的发生是预防的基础。近年来,随着高通量基因分型技术的发展,为患儿生殖系细胞的遗传变异即遗传多态性的检测提供了平台。结合全基因组关联分析(genome-wide association study,GWAS)更全面地揭示了人群间白血病易感性、预后与治疗药物毒性反应程度差异的原因[6-7]。
关于遗传多态性与ALL易感性的关系,一方面通过对肿瘤发病相关的候选基因多态性位点角度,如ABCB1、MTHFR、FAS、FASL、CASP8、TERT、FOXO3、MMP等基因[8-15]。但这种通过候选基因的方法,通常只聚焦于特定基因,而不能全面系统公正地评价单核苷酸多态性(single nucleotide polymorphisms,SNPs)位点多态性与疾病的关系。在GWAS研究中,通过对大量的SNPs位点进行分型,并设置非常高的有意义标准,从而能筛选出可靠的儿童ALL易感性位点。在此基础上,2009年有研究进行了两个针对所有ALL类型的全基因组关联分析,共发现21个儿童ALL易感性位点[16-17]。而SNPs具有人群特异性,在上述21个GWAS报道的儿童ALL易感性位点中,仅位于ARID5B基因的rs10821936、rs10994982,位于IKZF1的rs4132601及位于CEBPE基因的rs2239633在中国人群中进行过验证[18-19],而其余位点均未见中国人群的报道。本课题组根据上述基于欧美人群的2个GWAS报道的儿童ALL易感性位点,结合实验条件选取了13个候选位点,期望用我国人群验证这些SNP位点是否提示中国人群ALL的发病。
1 对象和方法
1.1 对象 以2008年至2017年温州医科大学附属第二医院育英儿童医院收治的ALL患儿191例为病例组。以191例健康志愿者为对照组。本研究经温州医科大学附属第二医院育英儿童医院伦理委员会批准(审批号:LCKY2019-05)。
1.2 方法
1.2.1 DNA提取:ALL患儿缓解期骨髓涂片及对照组志愿者口腔拭子分别采用QIAamp DNA Mini Kit(德国Qiagen公司,cat.no.51306)和北京天根公司口腔拭子基因组DNA提取试剂盒(cat.no.DP322)抽提基因组DNA。
1.2.2 SNPs分型检测:基因分型方法参照美国Fluidigm公司提供的“Genotyping with Juno”说明书进行实验,简要实验步骤如下:采用美国 Fluidigm公司定制的待测SNP位点靶向扩增引物,用Fluidigm公司定制的微流体动态芯片在JunoTM分析系统仪器上采用Juno96.96格式下进行SNP位点基因型检测。收集到的数据在Fluidigm SNP Genotyping Analysis software v4.2上进行分析。
1.3 统计学处理方法 采用SPSS24.0 软件统计分析。计数资料用率表示;对对照组进行Hardy-Weinbreg平衡检检,以P>0.05为样本处于Hardy-Weinbreg平衡状态;病例组及对照组基因型分布和等位基因频率的差异比较采用χ2检验。基因多态性与ALL的关系采用logistic回归分析计算OR 及95%CI。P<0.05为差异有统计学意义。
2 结果
2.1 Hardy-Weinberg遗传平衡检验 对对照组标本13个位点(见表1)进行Hardy-Weinberg平衡检验,rs10849033的P值<0.001,表明存在偏离,故将该位点剔除。其余位点均P>0.05,表明不存在显著偏离(见表2)。
2.2 13个SNPs位点与儿童ALL的关系 病例组及对照组的基因型分布,等位基因频率及与儿童ALL易感性的关系见表3。病例组与对照组基因型分布存在差异的位点有位于ARID5B基因的rs10821936(P=0.001),位于IKZF1 基因的rs11978267(P <0.001)和rs4132601(P=0.001),位于KRTH5B基因的rs2089222(P=0.047),位于ZNF230 基因的rs2191566(P=0.003)。通过χ2检验风险等位基因在病例组与对照组的分布差异,病例组位于ARID5B基因的rs10821936位点风险等位基因C频率明显高于病例组(P<0.001),rs10994982位点风险等位基因A频率高于病例组(P=0.016)。位于IKZF1基因的rs11978267风险等位G频率及rs4232601风险等位基因G频率病例组均高于对照组(P=0.001,0.003)。病例组位于ZNF230基因的rs2191566位点风险等位基因C频率明显高于对照组(P=0.002)。
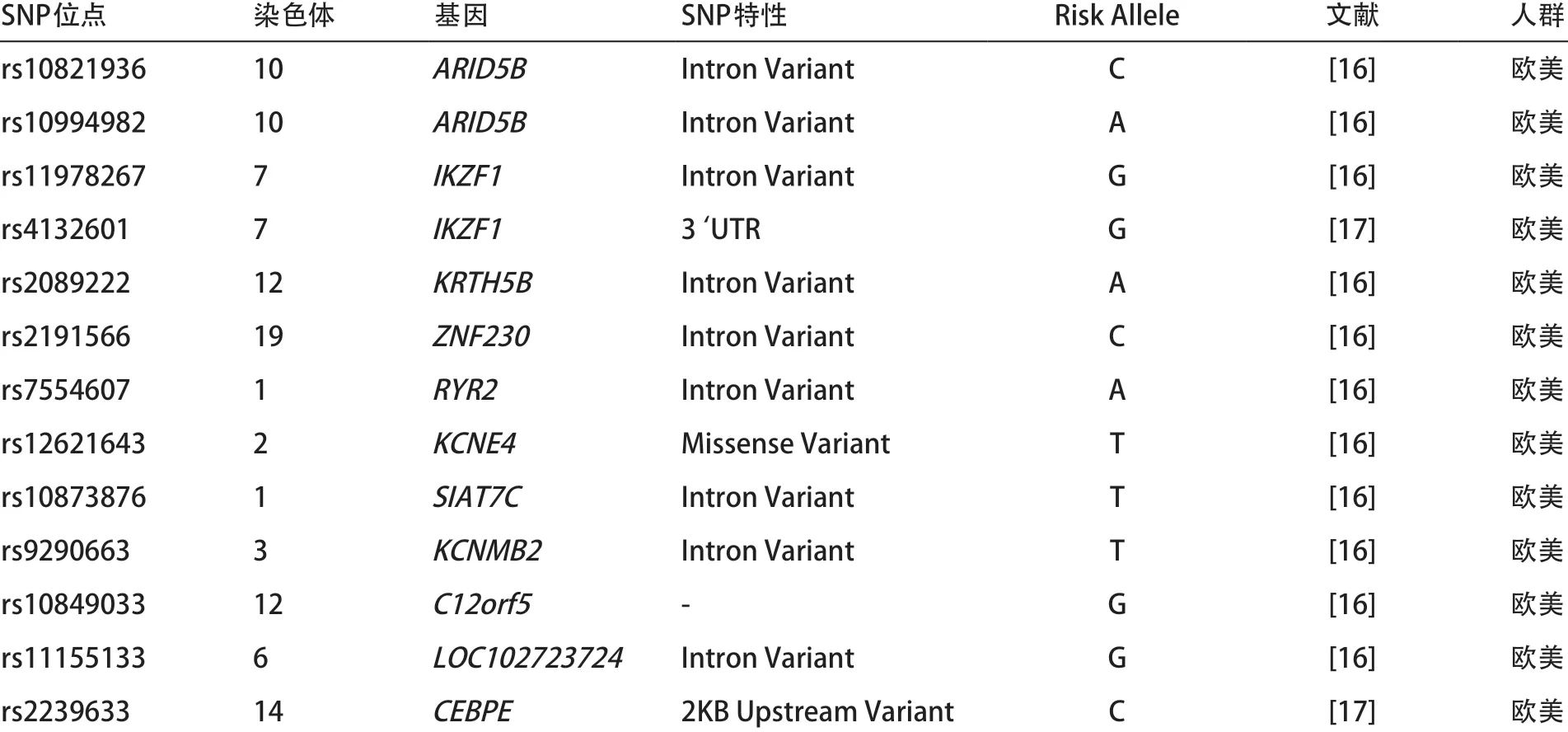
表1 候选SNPs位点信息
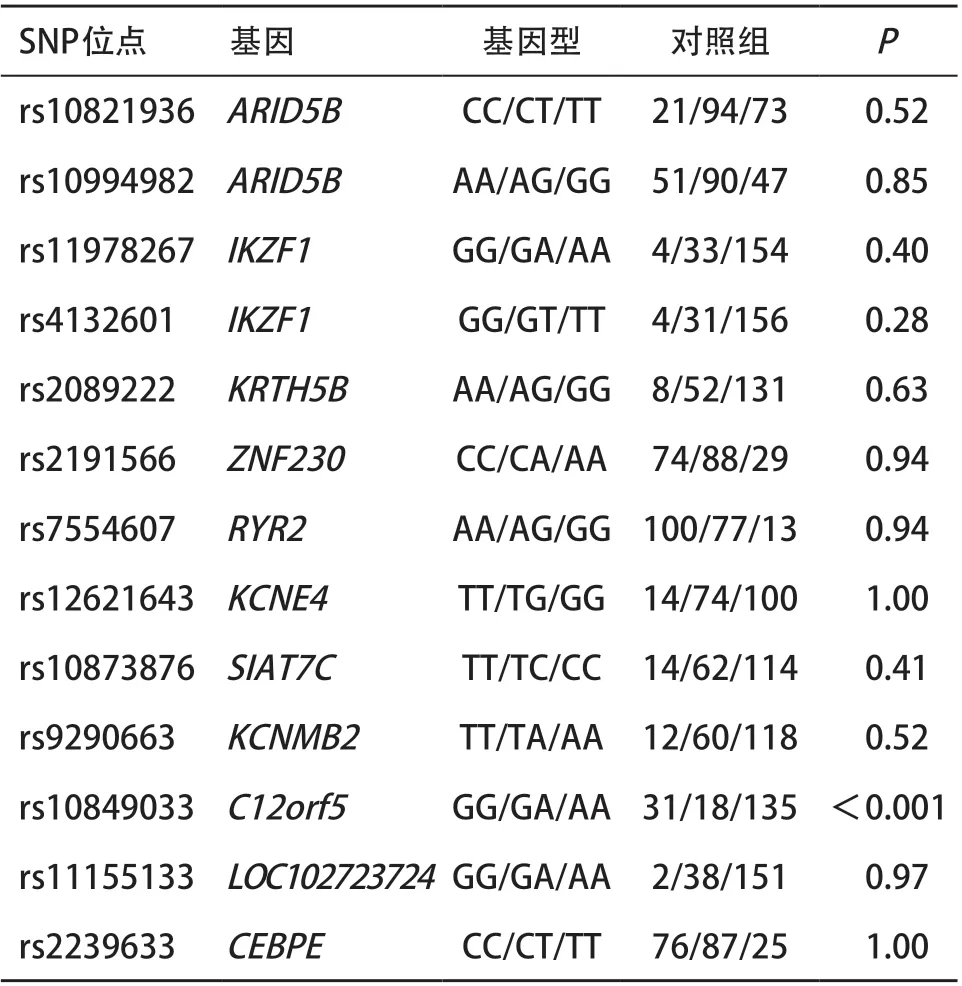
表2 对照组Hardy-Weinbreg平衡检检
通过logistic回归分析各基因型与儿童ALL易感性的关系,结果显示:位于ARID5B 基因的rs10821936位点CC基因型发生ALL的风险是TT基因型的3.192倍(95%CI=1.697~6.006),该位点携带风险等位基因C患ALL的风险是T的1.692倍(95%CI= 1.265~2.264)。rs10994982位点AA基因型患ALL的风险是GG基因型的2.022 倍(95%CI=1.131~3.614),该位点携带风险等位基因A患ALL的风险是G的1.425倍(95%CI=1.068~1.901)。位于IKZF1基因的rs11978267位点GA基因型患ALL的风险是AA基因型的2.584倍(95%CI=1.599~4.176),该位点携带风险等位基因G发生ALL的风险是A的1.965倍(95%CI=1.301~2.968)。rs4132601位点GT基因型患ALL的风险是TT基因型的2.417倍(95%CI=1.478~3.952),该位点携带风险等位基因G患ALL的风险是T的1.871倍(95%CI=1.225~2.857)。位于ZNF230基因的rs2191566位点,基因型CA患ALL的风险是AA的2.834倍(95%CI=1.302~6.169),CC基因型患ALL的风险是AA的3.648倍(95%CI=1.688~8.041),携带风险等位基因C的发病风险是A的1.599倍(95%CI= 1.179~2.169)。
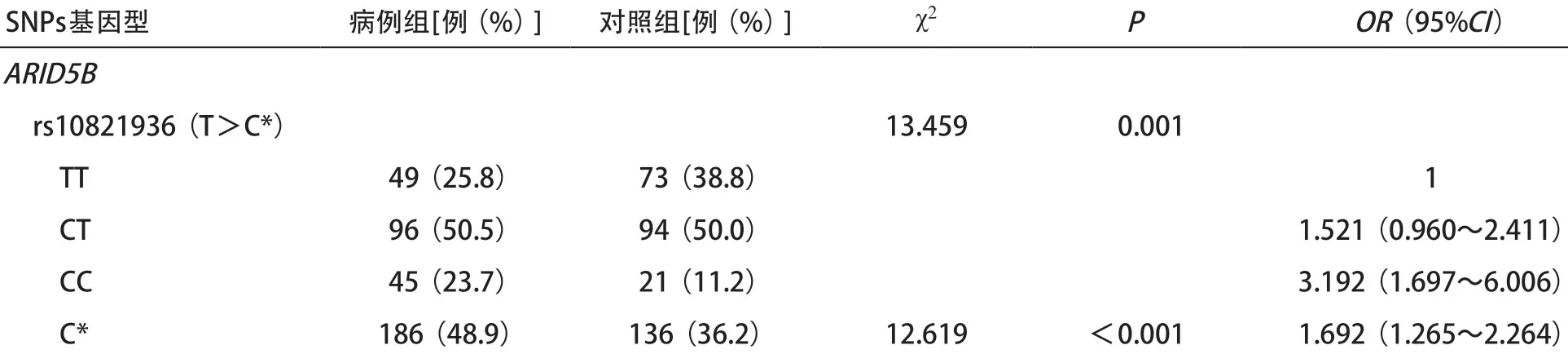
表3 12个SNPs位点与ALL发病风险的关系
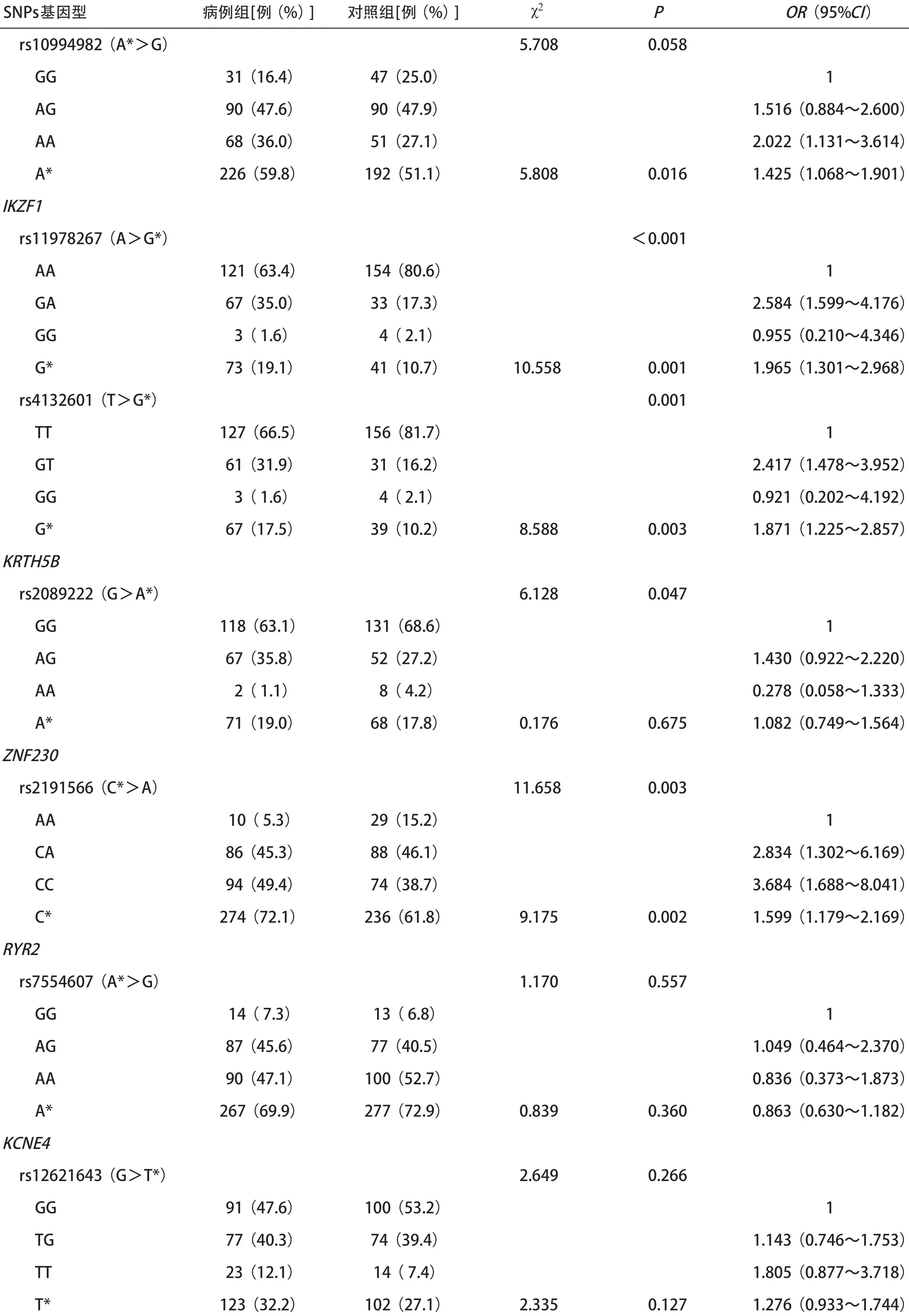
续表3
3 讨论
2009年TREVIÑO等[16]报道的基因组研究,揭示了ARID5B 基因中的SNPs位点rs10821936 及rs10994982与白血病易感性的相关性,且在验证人群中还发现了这2 个位点与超二倍体型急性B系淋巴细胞白血病的发病相关。2013 年有研究对rs10821936在中国儿童ALL与健康人群中进行了验证,证实该位点的风险等位基因T确实与儿童ALL发病相关,且与超二倍体型B-ALL的发病也相关[18]。2019年有研究对rs10994982位点在中国儿童ALL及健康人群中的多态性进行验证,也得到了同样的结论[19]。本研究再次验证了这2个SNPs位点与中国儿童ALL易感性的关系,但因病例资料收集不完善,无法进一步验证上述两位点与超二倍体型B-ALL的关系。
IKZF1 基因变异在白血病发病过程中起重要作用。其体细胞突变会造成转录因子IKAROS编码异常,造成造血细胞获得干细胞特性,超表达黏附分子等,且往往与不良预后有关[20-21]。生殖系遗传变异则往往与白血病易感性相关,TREVIÑO等[16]与PAPAEMMANUIL等[17]的GWAS研究中分别报道了位于IKZF1 基因上的白血病易感性相关SNPs位点rs11978267与rs4132601。此前的研究结果中,未发现rs4132601与中国人群儿童ALL易感性的关系[18]。 本研究发现该位点的基因型分布及风险等位基因G在病例组与对照组中存在差异,且基因型GT患ALL的风险是基因型TT的2.417倍,携带风险等位基因G的患ALL风险是T的1.871。但纯合基因型GG因病例数少不能得到更加肯定的结论,需要进一步扩大样本量为该位点与中国儿童ALL易感性的相关性提供更有说服力的证据。位于IKZF1 的另一个单核苷酸多态性位点rs11978267,此前在欧洲人群、突尼斯人群、也门人群及伊朗人群中被报道为儿童ALL易感性位点[16,22-23]。在本课题中,我们发现rs11978267的基因型分布及风险等位基因G的频率在病例组及对照组中存在差异,且基因型GA相对于基因型AA及携带风险等位基因G相对于A都有较高的患ALL风险,OR>1.9。但风险等位基因G的纯合基因型GG因病例数少,无法得到肯定的结论,需要进一步扩大样本量。
ZNF230基因上的rs2191566被国外多个全基因组关联分析报道与白血病易感性相关[16,24-25],但该位点与中国人群儿童ALL的关系未见报道。本研究中我们得到其在病例组及对照组中基因型分布、风险等位基因C的频率存在差异,且基因型CA、CC的ALL发病风险明显高于AA,因此我们认为该位点是中国人群的儿童ALL易感性位点。位于KRTH5B基因的rs2089222位点,虽然在本次试验中其基因型分布存在差异,但未看到风险等位基因频率存在差异且各基因型未明显增加发病风险,因此不认为该位点为中国儿童ALL易感性位点。
2013 年南京儿童医院的一项570 例ALL患儿与673 例健康儿童人群的病例对照研究对欧美人群易感性相关的ARID5B(rs10821936)、IKZF1(rs4132601)及CEBPE(rs2239633)进行验证,发现与欧洲儿童人群ALL易感性相关的CEBPE 基因的rs2239633位点在中国人群中未发现与ALL相关,在我们的试验中也未发现该位点与白细胞易感性的相关性。南京儿童医院分析其原因可能与中国人群在该位点上的表达连锁不平衡有关,通过LD矩阵图分析rs2239633所处的LD blocks在两个人群中明显不同[18]。
位于LOC102723724 基因的rs11155133位点,SIAT7C 基因的rs10873876 位点,KCNE4 基因的rs12621643位点,RYR2 基因的rs7554607位点及 KCNMB2基因的rs9290663位点在2009年的多协作组大样本量基因组研究中报道为ALL易感性位点,而在本次试验中未发现其与白血病的相关性,这可能与样本量有限及中国人群中这些位点的表达差异有关,需要进一步扩大样本量进行验证[16]。
本试验验证了此前鲜有中国内地人群报道的儿童ALL易感性位点,位于ZNF230基因的rs2191566。同时我们再次验证了已报道的位于基因ARID5B的中国人群ALL易感性位点rs10821936及rs10994982。此外根据实验结果我们认为位于IKZF1 基因的rs4132601及rs11978267为潜在中国人群儿童ALL易感性位点,需要进一步扩大样本量以验证。
综上所述,本研究明确了3 个ALL遗传易感位点,这为白血病的诊断、治疗及预防工作提供了一定的思路。随着基因组研究的不断深入,可遗传变异导致的某些疾病易感性被越来越多的数据所证实。如何利用这些数据来预测其患病的风险是下一个突破的课题。同时很多易感性位点所在基因与疾病治疗药物敏感性也相关,进一步通过药物基因组学的研究能为白血病的诊治提供新思路[26]。

