结直肠癌卵巢转移的临床特征及诊治策略*
李晓芬,邱萌
610041成都,四川大学华西医院 腹部肿瘤科
近年来,随着经济的发展、生活方式的改变、人口老龄化等原因,我国结直肠癌的发病率呈逐年上升趋势[1-2]。根据Chen等[1]2015年对全国72个肿瘤登记中心的数据统计,我国结直肠癌的发病率及死亡率均居恶性肿瘤第5位。与肝、肺转移不同,结直肠癌卵巢转移属少见转移部位,总体发病率约0.8%~7.4%[3],但因其发生机制不清、临床上易漏诊、肿瘤生长迅速、对系统药物治疗反应差,无标准治疗手段等原因,目前仍然是威胁女性结直肠癌患者生存的重要原因之一。本文综述了近20年来国内外对结直肠癌卵巢转移的主要文献报道,以期帮助临床医师更好地认识和诊治结直肠癌卵巢转移。
1 结直肠癌卵巢转移的流行病学和临床特征
1.1 定义及流行病学
1896年,德国病理学家Friedrich Ernst Krukenberg[4]描述了一种特殊类型的卵巢肿瘤,由黏液性肿瘤细胞组成的纤维肉瘤。5年后,Kraus[5]揭示了该种肿瘤的转移性特征,并首次使用“Krukenburg 瘤”这个术语。其后,医学界普遍认为,Krukenburg 瘤特指富含黏液性印戒细胞(>10%)的转移性卵巢癌,其原发灶一般位于消化道,如胃、肠、阑尾等[6-9]。由此可见,卵巢转移瘤并不等同于Krukenburg 瘤,任何肿瘤转移至卵巢所形成的任何病理类型的转移瘤均为卵巢转移瘤,其原发灶可位于胃肠道、胰腺、乳腺、肺等器官,病理类型也不仅仅限于富含印戒细胞的转移性卵巢癌[9]。本文提及的“结直肠癌卵巢转移”指的是原发于结直肠的卵巢转移瘤。
据统计,在女性结直肠癌患者中,卵巢转移的总体发病率约0.8%~7.4%,尸检中发病率为5%~9.7%[3]。瑞典的一项随访13年的前瞻性研究表明(n=4 566),同时性结直肠癌卵巢转移(结直肠癌诊断后3个月内发生卵巢转移者)发生率为0.9%,异时性转移率为0.8%[10]。其中,同时性结肠癌卵巢转移发生率为1.1%,同时性直肠癌卵巢转移率为0.6%[10]。对接受了根治性手术的I~III期结直肠癌患者进行随访发现,异时性结肠癌卵巢转移率为1.1%,而异时性直肠癌卵巢转移率仅为0.1%[10]。
1.2 转移途径
结直肠癌发生卵巢转移的确切机制目前尚不明了,但病理学家们提出了种植转移、血行转移、淋巴道转移和直接蔓延这四种常见的卵巢转移发生途径[3]。大多数卵巢转移患者同时合并腹膜转移,并且约50%腹膜转移患者同时有卵巢转移,因此病理学家们推测结直肠癌发生卵巢转移的常见机制为种植转移。在手术标本中可以发现小血管内瘤栓,卵巢转移常常累及双侧,以及转移灶位于卵巢组织深部,这几点可作为支持血行转移的证据。阻断腹膜后淋巴管后,可观察到肿瘤细胞的“逆流”,这一点说明肿瘤细胞很可能通过淋巴道转移到卵巢。而在直肠乙状结肠癌和盲肠癌中,有时可观察到肿瘤直接蔓延至卵巢[3]。
1.3 诊断
结直肠癌卵巢转移极易被漏诊或误诊。在影像学上,来源于消化道肿瘤的卵巢转移瘤常表现为囊实性,与原发性卵巢上皮源性肿瘤无法区分。据报道,4%~29%的结直肠癌卵巢转移瘤初诊时被当作原发性卵巢肿瘤实施了手术切除[9,11]。结直肠癌卵巢转移的病理学诊断一般需借助免疫组化染色,典型表现为CK7-/CK20+/CDX2+/CA125-,而原发性卵巢癌多表现为CK7+/CK20-/ CDX 2-/PAX8+/CA125+[3]。但需警惕某些罕见的原发性卵巢黏液腺癌,可能与结直肠癌卵巢转移瘤具有相同的免疫表型。
1.4 临床表现
卵巢转移患者早期大多没有特异性症状,后期可能出现尿频、腹部胀痛、消瘦、便血、大便习惯改变、阴道流血等症状[12]。结直肠癌卵巢转移患者如合并胸腹腔积液,切除转移灶后胸腹腔积液自行消失,被称为“假梅格氏综合征”。既往研究表明[7,9-10],结直肠癌患者发生卵巢转移的中位年龄为49~63岁;绝经状态与卵巢转移的关系报道不一,目前尚无定论;与直肠癌相比,结肠癌更易发生卵巢转移;常合并其他部位转移,例如腹膜、肝脏等。Jeung等[13]对比了胃癌与结直肠癌的卵巢转移患者的临床特征,发现与胃癌卵巢转移相比,结直肠癌卵巢转移发病年龄较大(50.4岁vs43.8岁,P=0.002),绝经前患者更少(44.4%vs76.6%,P=0.001),腹水阳性者更少(53.3%vs61.3%,P=0.001),中位生存时间更长(27.3个月vs19.2个月,P=0.015),预后更好。
1.5 发生机制及基因突变特征
除“种子土壤”理论外,卵巢转移在基因层面的发生机制不明,目前只有少数小样本研究从分子水平分析了卵巢转移灶的基因突变特点。Crobach等[14]对26例结直肠癌卵巢转移患者的原发灶及配对卵巢转移灶进行115个肿瘤相关基因测序,发现原发灶与卵巢转移灶的驱动基因突变频率较一致, 如家族性腺瘤性息肉基因APC、TP53、CACNA1B、FAT4等,而伴随基因突变频率相差较大,如KRAS、NRAS、BRAF、FBXW7、PTEN、PIK3CA等,但因样本量小,非全基因组测序等缺点,该结论有一定的局限性。Ganesh等[15]对38例结直肠癌卵巢转移患者的肿瘤组织样本进行二代测序,其中21例有配对的原发灶、卵巢转移灶或其他器官转移灶组织样本,结果并未发现卵巢转移灶与原发灶或其他器官转移灶之间有意义的基因突变差异;但与不伴卵巢转移的结直肠癌样本相比,伴卵巢转移的结直肠癌样本KRAS(65.8%vs46.5%;P=0.0224)、SMAD4(39.5%vs18.5%;P=0.0021)、NTRK1(10.5%vs3.8%;P=0.049)基因突变频率均明显升高。Kaplan-Meier生存分析表明,在结直肠癌卵巢转移患者中,合并SMAD4或KMT2基因突变的患者生存期明显缩短(SMAD4野生型vs突变型:47.5个月vs11.3个月,HR=27.69,P=0.0001;KMT2野生型vs突变型:29个月vs8.2个月,HR=38.69,P=0.0007)。未来需要更大样本量、结合多种组学分析来探明卵巢转移的具体发生机制。
2 结直肠癌卵巢转移的诊治策略
2.1 全身治疗
虽转移性肠癌以系统治疗为主,但文献报道显示结直肠癌卵巢转移灶对全身化疗的敏感性明显低于其他转移器官,有效率不超过20%。Goéré等[16]对23例同时合并卵巢及其他器官转移的结直肠癌患者研究发现,化疗对卵巢转移灶的有效率为0%(0/23),疾病控制率为13%(3/23),而其他转移灶的有效率为35%(8/23),疾病控制率65%(15/23)。2010年,Lee等[17]对33例同时有卵巢转移及其他器官转移的结直肠癌患者(均接受姑息化疗,均可评价疗效)分析发现,卵巢转移灶的有效率为18.2%(6/33),而其他器官转移灶的有效率为33.3%(11/33),两者具有统计学差异(P<0.001)。因此,系统性治疗难以成为肠癌卵巢转移的优选治疗手段,而结直肠癌卵巢转移灶对化疗药物耐药的机制尚不明确,Ganesh等[15]的研究发现卵巢转移灶与其他器官转移灶对化疗反应一致的患者中,SOX9基因突变率约50%,而对化疗反应不一致的患者中,SOX9基因的突变率仅为7.8%。
2.2 手术治疗
2.2.1 卵巢切除手术 相对于其他转移器官,如肝、肺等,卵巢转移灶对化疗原发耐药,仅采用全身化疗显然不能有效控制结直肠癌卵巢转移。有多项回顾性研究[16,17,18-29]提示,卵巢切除术可显著改善结直肠癌卵巢转移患者预后。Lee等[17]的研究发现,在130例结直肠癌卵巢转移患者中,卵巢切除组生存时间明显长于未切除组(20.8个月vs10.9个月,P<0.001),且未行卵巢切除术为独立的预后不良因素(RR:1.954,95%CI:1.220~3.130,P=0.005)。此外,残留病灶的多少/减瘤术的程度可能影响结直肠癌卵巢转移患者的生存。McCormick等[20]对39例结直肠癌卵巢转移患者的一项回顾性研究发现,与接受不佳减瘤术(剩余病灶>1cm)的患者相比,接受最佳减瘤术(剩余病灶≤1cm)的患者总生存时间显著延长(35个月vs7个月,P<0.0001)。其他因素如同时性转移、体力状况、合并卵巢外转移、全身化疗等对接受了卵巢切除术的患者的预后也可能有一定的影响。最近,Li 等[30]发表的回顾性研究也证实与姑息性切除卵巢转移灶或不切除相比,完全性切除卵巢转移灶能显著延长患者生存。表1总结了近20年来关于卵巢切除术对生存影响的研究,虽所有研究均为回顾性且绝大部分为单中心小样本研究,但基本都提示卵巢切除术,尤其是R0切除,可明显改善结直肠癌卵巢转移患者的预后[16,17,19-33],因回顾性研究本身存在选择偏倚,未来需要大样本、多中心前瞻性观察进一步明确手术治疗的价值、最适人群及最佳的手术时机。
2.2.2 预防性卵巢切除术 理论上,预防性卵巢切除术可以清除同时性亚临床卵巢转移灶、避免异时性转移,对于遗传性肠癌综合征(林奇综合征)者可降低原发性卵巢癌的发病风险等,然而是否能改善根治性手术术后生存仍存在疑问,目前的文献证据尚不支持。早在上世纪80年代,就有前瞻性、非随机对照试验表明,与未行预防性卵巢切除术的患者相比,接受预防性卵巢切除术的结直肠癌患者在总生存及无复发生存方面并无优势[34-35]。其后Sielezneff 等[36]及Cai 等[37]的研究也得到了类似的结论:预防性卵巢切除术并不能改善局部晚期结直肠癌患者的5年生存率。Young-Fadok 团队[38]开展了唯一一项前瞻性、随机对照研究,拟在接受根治性手术的40岁以上Dukes B或C期女性结直肠癌患者中,比较是否接受预防性卵巢切除患者的5年无复发生存率,该项研究历时近10年(1986年11月至1996年9月),遗憾未能完成计划入组450例,最终仅入组149例,结果表明,两组5年生存率并无显著差异(P=0.79),在72例不行预防性卵巢切除组中,共有2例患者出现卵巢转移,两组患者5年无病生存率虽然绝对值相差较大,但由于样本量小,未达到统计学差异(80%vs65%,P=0.16)。以上提及研究绝大部分研究对象均为绝经后患者,并非卵巢转移的好发人群,鉴于卵巢转移整体发病率低、缺乏有效患者筛选、手术对绝经前患者可能造成生理甚至心理的不良影响等因素,未来开展预防性卵巢切除手术存在很大的难度以及伦理风险。
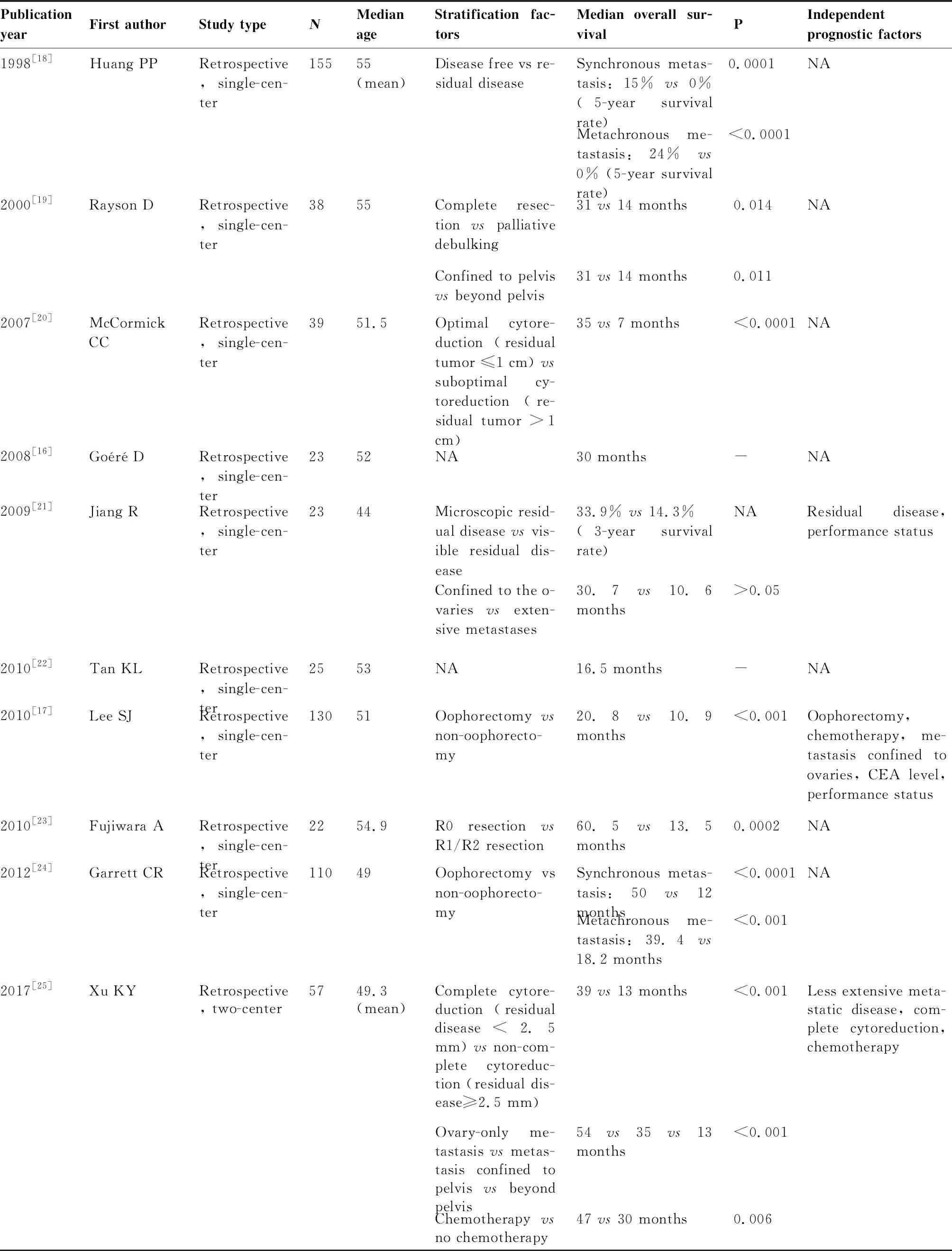
表1 采用卵巢切除术治疗结直肠癌卵巢转移患者的生存研究
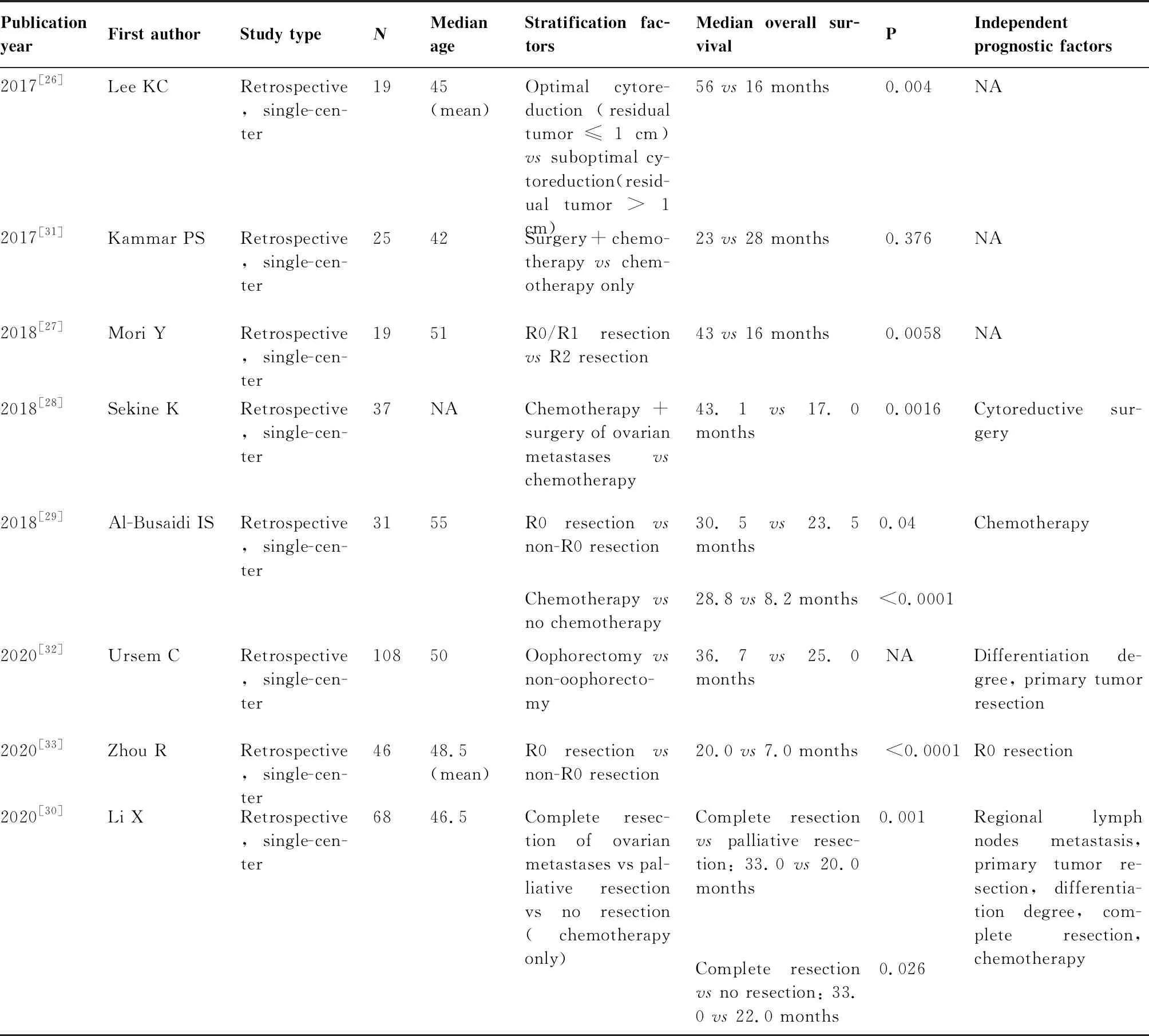
(Table 1 continues on next page)
3 总 结
结直肠癌卵巢转移虽然是少见病,但因其易被漏诊或误诊、无标准治疗手段等原因,预后差,目前仍然是威胁女性结直肠癌患者的重要死亡原因之一。在影像学上,结直肠癌卵巢转移与原发性卵巢癌不易区分,其病理学诊断常常需借助免疫组化,典型表现为CK7-/CK20+/CDX2+/CA125-。多项研究表明,来源于结直肠癌的卵巢转移病灶对全身化疗不敏感,其有效率低于20%;近年来,多项回顾性研究发现,卵巢切除术,尤其是R0切除,可显著改善结直肠癌卵巢转移患者的预后。目前,预防性卵巢切除术在局部晚期结直肠癌患者中不被常规推荐,但在某些特定情况下(如绝经后患者、遗传性结直肠癌患者),与患者充分沟通后实施预防性卵巢切除术可避免异时性卵巢转移及原发性卵巢癌的发生。总的来说,结直肠癌卵巢转移尚缺乏统一的标准治疗方案,在化疗耐药机制、卵巢切除术的价值等方面均急需大样本、多中心研究进一步阐明。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

