通过参数相关性分析对发酵控制策略在植酸酶高密度发酵中的作用探讨
韩庆晔, 公维丽, 史建国, 王丙莲, 刘庆艾, 蔡 雷, 郑 岚,孟庆军, 杨 艳, 杨俊慧, 马耀宏
齐鲁工业大学(山东省科学院) 山东省科学院生物研究所 山东省生物传感器重点实验室,山东 济南 250103
植酸(肌醇六磷酸)是农作物中肌醇和磷酸的主要来源,因单胃动物无法直接利用植酸中的磷酸,造成饲料中需添加无机磷以满足饲养动物对磷元素的需求,而过剩的无机磷会引起环境污染和富营养化等严重的生态问题[1,2]。因此,提高单胃动物对饲料中植酸磷的吸收利用以减少磷元素的排放对资源有效利用和减少环境污染具有重要意义[3]。利用植酸酶(Phytase)作为一种新型饲料添加剂,催化植酸(盐)水解为肌醇及无机磷酸[4],以促进动物对微量元素等营养成分的吸收成为解决上述问题的关键。
植酸酶主要来源于微生物,当前用于工业植酸酶生产的菌株大多为单位表达量已较天然菌株大幅度提高的基因工程菌。但对于高密度生产植酸酶的工艺方法主要通过在摇瓶研究的基础上进行放大。由于工业生产实际中的发酵罐不同于实验室的摇瓶培养,因而常造成摇瓶培养中细胞表达外源蛋白的水平不能准确反映其在发酵罐中的真实情况。为了可全面了解细胞在反应器中的宏观生理代谢特性,实现跨尺度观察与调控,张明等指出微生物发酵实质上是在分子水平上的遗传特性、细胞水平上的代谢调节和工程水平上的传递特性这3个不同水平上发生调控的[5]。张嗣良等为此设计了可用于了解细胞生理代谢特性的全参数检测生物反应器[6],该技术已成功应用于青霉素,红霉素等工业发酵工艺的优化和规模放大,实现了工业发酵生产效率的提高[7]。庄等亦基于此首次建立了可通过在线生理数据计算出实时关键参数的方程式,用来实时监测葡萄糖酸钠(SG)发酵的实时监测方法,使发酵总产量提升超过16%,显著提高了SG生产[8]。目前,大量先进的在线生物过程检测仪表已用于发酵过程中关键代谢特性参数的采集,并通过参数之间的对比与相关性分析进行培养过程工艺的优化调控[9]。
本文立足于工程水平上的调控,基于前期摇瓶研究基础[10],对本实验室自构建的植酸酶工程菌在10 L发酵罐上进行诱导培养,利用多种物理传感器(pH传感器、溶氧(DO)传感器、尾气分析仪)和生物传感器(活细胞在线、甘油传感器、还原糖测定仪、乳酸测定仪)实时检测改变搅拌速度、接种量与补料甘油三种条件下发酵液中pH、DO、尾气中CO2含量(CER)、尾气中O2含量(OUR)、细胞密度与发酵液中甘油含量、还原糖含量、乳酸含量等参数变化,探讨植酸酶高密度发酵下各参数变化对工程菌细胞生长和产酶的具体影响,并进而通过各参数变化间相关性分析讨论三种发酵调控策略在发酵控制中的具体作用,为工业上具体操作的优化提供参考。
1 材料与方法
1.1 材料
1.1.1菌株
毕赤酵母GS115产植酸酶工程菌由本实验室构建,-20 ℃保藏。
1.1.2试剂
酵母粉,蛋白胨,无氨基酵母氮源YNB(含硫酸铵),生物素,丙烯酰胺,N,N,N′,N′-四甲基乙二胺TEMED,十二烷基苯磺酸钠(SDS),过硫酸铵,均购买自生工(上海,中国);葡萄糖,KH2PO4,K2HPO4,甲醇,甘油,钒酸铵,钼酸铵,硝酸,乙酸,乙酸钠,购买自国药(北京,中国);植酸钠(Sigma, 美国)
1.1.3培养基
1.1.3.1种子培养基
YPD培养基(g/L):酵母粉 10.0,蛋白胨 20.0,葡萄糖 10.0。
1.1.3.2扩大培养基
BMGY培养基(g/L):YNB 13.4,KH2PO411.8,K2HPO42.9,酵母粉10.0,蛋白胨 10.0,Biotin 4×10-4,甘油10 mL。
1.1.3.3发酵培养基
BMMY培养基(g/L):YNB 13.4,KH2PO411.8,K2HPO42.9,酵母粉10.0,蛋白胨 10.0,Biotin 4×10-4,甲醇5 mL。
1.2 仪器与设备
Mini-PROTEAN Tetra小型垂直电泳仪(Bio-rad,美国),摇床(知楚,上海),TECAN酶标仪(TECAN,瑞士),SGD全自动还原糖测定仪(山东省科学院,山东),SBA-4D型生物传感分析仪(山东省科学院,山东),甘油传感器(山东省科学院,山东),尾气传感分析仪(山东省科学院,山东),Control Unit EVO 265活细胞在线(FOGALE nanotech,德国),KRh-BIO 3000型发酵罐(科润海,江苏),DZFZ-6D型蒸汽发生器(三星,江苏)
1.3 方法
1.3.1培养方法
1.3.1.1种子活化
挑取菌种接种于100 mL YPD培养基中,于30 ℃,200 r/min过夜培养。
1.3.2.2高密度发酵培养
如表1所示,对相关因素进行设置,将一定量菌体接入10 L发酵罐中进行发酵培养。在发酵过程中控制搅拌速度以适合菌体生长;维持罐内空气流量在10 L/min;pH控制为6.0;罐温设置为30 ℃。通过下表操作,探讨不同转速、不同接种量和补料甘油对酵母细胞生长和诱导表达植酸酶的影响。表1中批次a~批次d在结果与讨论的图示中为便于比较,记作a组~d组;与结论表中批次a~批次d意义相同。
1.3.2.3诱导表达
酵母细胞于扩大培养基中培养一定时间后,按日流加1%(v/v)甲醇。定时取样,探究发酵期间改变转速、接种量及补料甘油对细胞生长与目的蛋白表达情况的影响(表1)。
1.3.2测定方法
1.3.2.1酵母菌株平板培养方法、摇瓶培养方法、酶液透析方法、蛋白及酶活测定方法、SDS-PAGE检测蛋白表达方法、还原糖和乳酸含量测定方法以上各测定方法同文献[10]。
1.3.2.2发酵液中菌体浓度、溶氧、pH、甘油含量、尾气中O2与CO2含量的测定
利用活细胞在线测菌体浓度;利用发酵罐在线控制系统配置的溶氧电极和pH电极检测溶氧和pH;利用山东省科学院生物研究所研发的甘油传感器、尾气传感分析仪检测甘油和尾气中O2与CO2含量。
2 结果与分析
2.1 转速控制在植酸酶工程菌细胞生长发酵中的影响
2.1.1转速对植酸酶工程菌细胞生长的影响
溶氧量( dissolved oxygen content,DO) 是酵母细胞生长过程中最重要的检测指标之一,它直接影响着酵母细胞的生长和代谢。当O2不足时,菌体的生长就会受到抑制,并代谢产生乳酸[11]。而搅拌器转速与溶氧的变化密切相关[12]。
实验结果显示,在发酵前20 h,转速均保持在200 r/min,此时两组细胞密度、溶氧变化无明显差异(图1A、B)。b组逐步提高转速,细胞密度在发酵36 h~50 h增至最高达4.25 pF/cm(图1 A),因菌体代谢伴有极高的耗氧与CO2的释放,致使溶氧降至最低,尾气中O2含量降至最低(图1 D),CO2含量升至最高(图1 E)。细胞密度最高时,受此时溶氧的限制,伴有乳酸短时升高(图1 C)。发酵50 h后随着甲醇流加,细胞密度开始降低,溶氧升高,尾气中O2含量增加,CO2含量降低;发酵60 h后,各参数趋于平稳。而a组细胞密度低于b组(图1 A),由于转速低,搅拌不均质,O2与CO2浓度在发酵过程中无明显变化,乳酸变化亦不明显。因此,保证持续通氧的情况下,相应调整搅拌器转速,有利于提高菌体细胞密度。

图1 在不同搅拌器转速控制条件下活细胞密度、DO、乳酸及尾气中O2与CO2浓度的变化曲线
2.1.2转速对植酸酶工程菌细胞发酵产酶的影响
在菌体表达蛋白的过程中pH变化明显。当pH值稳定在3.5时,蛋白表达出现的时间与pH变化趋于稳定的时间相近(图2 A)。a组菌体24 h培养后经甲醇诱导,于发酵66 h后有明显目的蛋白出现并累积(图2 E),最高酶活为991.05 U/mL(图2 B-a);整体还原糖含量基本稳定(图2 C);相同诱导条件与时间,b组于发酵42 h后表达蛋白(图2 F),时间缩短24 h,且酶活提高44.9%,达到1 436.09 U/mL(图2 B-b)。因此,提高转速利于改善发酵溶氧条件,促使菌体利用甘油进行生长(图2 D),并有利于后期蛋白的表达。

9:细胞培养24 h,开始流加甲醇; 10-29:每隔6 h取样检测
2.2 接种量对植酸酶工程菌细胞生长发酵的影响
2.2.1接种量对植酸酶工程菌细胞生长的影响
实验结果显示,按1%、10%的接种量进行发酵,10%接种量能有效缩短发酵时间。
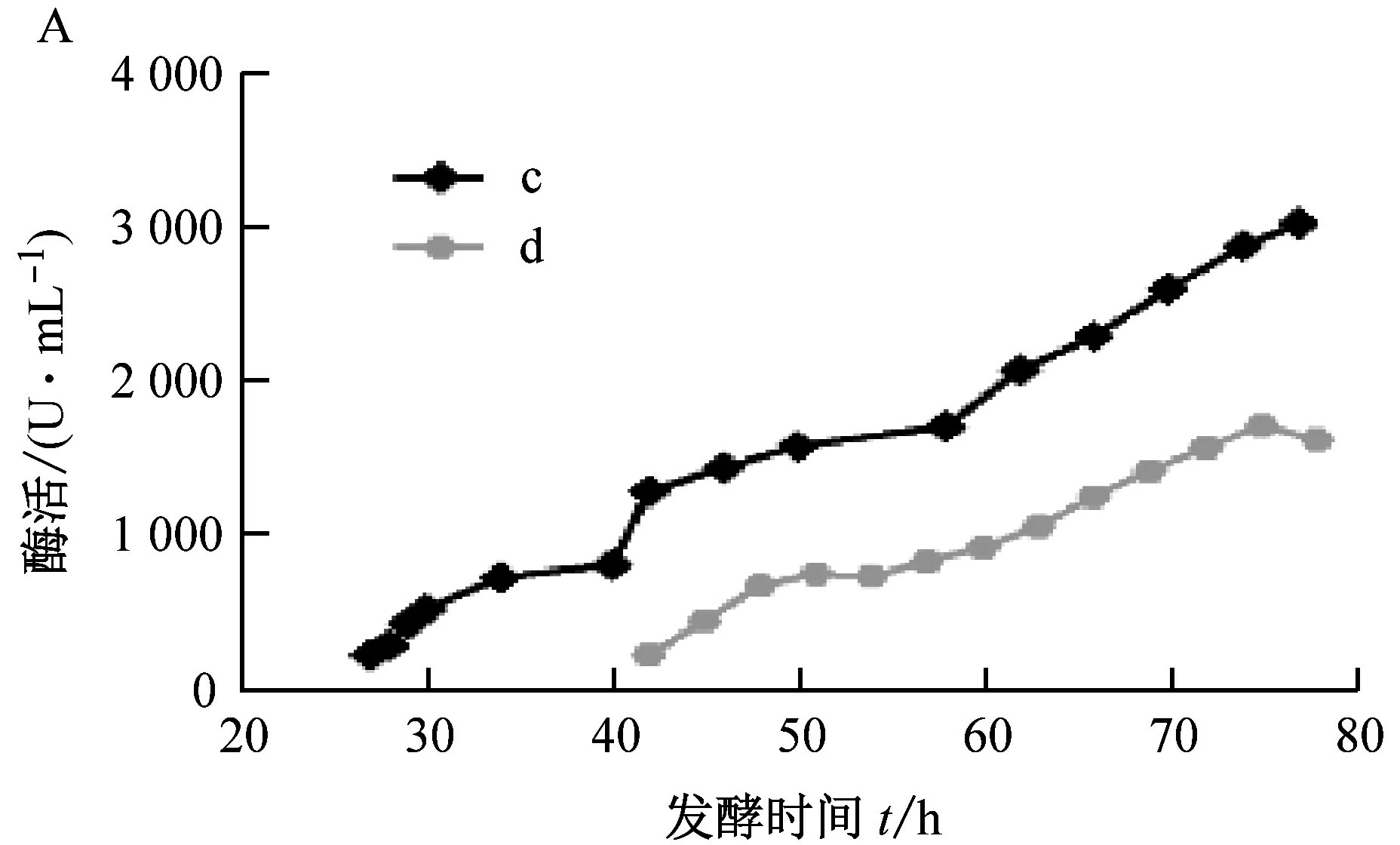
发酵前7 h,由于c组接种量大,细胞对氧的利用高于b组,溶氧先于b组降低;受搅拌影响,细胞密度略低于b组(图3 A)。发酵24 h,细胞生长进入稳定期,溶氧降至最低(图3 B),尾气中O2含量开始降低,CO2含量升高;发酵36 h,此时尾气中O2含量降至最低(图3 D),CO2含量升至最高(图3 E),此阶段伴有乳酸升高(图3 C)。比较b组得出:在通氧充足的条件下,发酵前期升高转速,菌体生长,细胞密度升高使发酵液中溶氧降低,尾气中O2含量降低与CO2含量升高。稳定期流加甲醇,细胞密度趋于平稳,菌体吸收甲醇作为碳源,由于甲醇具有一定的毒害作用,致使细胞密度下降,溶氧升高,尾气中O2含量降低与CO2含量升高;此间降低转速,可使细胞密度适当恢复,出现溶氧降低,尾气中O2含量降低,CO2含量升高的情况。其中溶氧与尾气的检测可直接反应出菌体的生长状况,乳酸可提示菌体进行对数生长。

图3 不同接种量条件下活细胞密度、DO、乳酸及尾气中O2与CO2浓度的变化曲线
2.2.2接种量对植酸酶工程菌发酵产酶的影响
由实验结果得出,10%接种量使植酸酶表达提前;细胞密度升高的同时,使植酸酶得到明显积累。c组发酵末期酶活可达3037.98 U/mL(图4 A),相较b组酶活提高111.5%;pH上,c组提前处于表达蛋白阶段(图4 C),此间还原糖含量基本不变(图4 D);SDS-PAGE检测结果也可表明c组植酸酶表达时间(图4 F)的提前。

11:细胞培养24 h,开始流加甲醇; 12-25:每6 h取样检测
2.3 甘油补料对植酸酶工程菌细胞生长发酵的影响
2.3.1甘油补料对植酸酶工程菌细胞生长的影响
在菌体到达稳定期之前,提升稳定菌体含量对后期目的蛋白的高效表达具有一定影响。通过对前期补料甘油来探讨此时菌体生长情况与对蛋白表达的影响。
按10%接种量,转速逐步增加,待培养至18 h,d组补料1%(v/v)的甘油。结果显示,发酵前18 h,由于细胞整体活度的影响,造成前期溶氧的利用并不完全一致(图5 B);发酵18 h,d组补料甘油;20 h乳酸升至最高(图5 C),由于甘油的添加,造成发酵液黏度上升,乳酸的峰值较c组有所延迟;发酵24 h,d组细胞密度升至最高;发酵31 h,尾气中O2含量明显降低、CO2含量升高(图5 D、E);此后,d组细胞密度开始降低。甘油的添加一方面易造成发酵液黏度升高,使菌体对溶氧的利用受到限制;另一方面可稳定细胞量,延缓细胞因营养不足而导致的过早衰亡,并维持细胞较高的溶氧消耗,提高细胞活度(图5 B)。

图5 不同甘油补料条件下活细胞密度、DO、乳酸及尾气中O2与CO2浓度的变化曲线
2.3.2补料甘油对植酸酶工程菌发酵产酶的影响
由实验结果可知:前期补料甘油,d组酶活在发酵末期可达到2216.33 U/mL(图6 A),相较于c组酶活降低27%;从pH变化时间上看d组有所延后(图6 B-d);从甘油、还原糖含量可看出d组中菌体利用甘油进行生长(图6 C、D),至发酵后期,还原糖含量有所降低(图6 D)。
5:细胞培养24 h,开始流加甲醇; 12:流加甲醇后5 h
从SDS-PAGE检测结果中可以看出:d组自发酵33 h流加甲醇至发酵42 h后植酸酶开始表达,较于c组自发酵24 h流加甲醇至发酵27 h即有植酸酶表达延迟6 h。在甘油与甲醇并存的前提下,菌体优先利用甘油、补充碳源进行生长,推测前期甘油的不完全利用对于后期蛋白表达具有一定的迟滞作用。
3 总结与讨论
通过四次发酵(如表1所示)探得:对植酸酶工程菌以流加甲醇含量为1%,培养温度为30 ℃的情况下,接种量为10%,其发酵迟滞期最短且蛋白表达量最高,末期可达3 037.98 U/mL,此时生长pH为5.0,产酶的pH为3.5。
本文基于罐体培养,结合多种在线传感器,着重分析转速、细胞密度、溶氧和尾气中氧气与二氧化碳含量的关系,结合其他发酵指标,结果得到(如表2,表3所示):(1) 转速影响溶氧和细胞密度,且在发酵前期,转速提高,细胞密度增加,罐内溶氧降低,尾气中O2含量降低,CO2含量升高;菌体平稳后,转速提高,细胞密度下降,罐内溶氧升高,尾气中O2含量升高,CO2含量降低。其中当CO2排放(CER)达到最值时,与细胞密度或菌体量增至最值时的时间相吻合,此时发酵液pH变化趋于平稳,且目的蛋白也开始表达。(2) 溶氧和乳酸开始变化与达到最值且平稳的时间基本吻合;乳酸可作为发酵环境中溶氧是否充足的指标。

表2 不同发酵批次各参数指标变化时间(一)

表3 不同发酵批次各参数指标变化时间(二)
通过四次发酵结果,得出如下关系:转速-细胞密度-溶氧-乳酸相关的发酵罐内外环境氧控制关系;细胞密度-氧气吸收-二氧化碳释放相关的细胞生长氧控制关系;细胞密度-二氧化碳释放-pH变化-蛋白表达的细胞诱导表达的关系。通过罐体培养,以传感器反馈结果,建立起实验室与工业实践的关联,以期为植酸酶工业生产做好前期探索。

