超高效液相色谱-四极杆/静电场轨道阱高分辨质谱鉴定嗜热链球菌发酵乳中脂质构成
章 丽,高 洁,刘松雁,桑亚新,*,王向红,*
(1.河北农业大学食品科技学院,河北 保定 071001;2.石家庄市畜产品和兽药饲料质量检测中心,河北 石家庄 050051)
嗜热链球菌(Streptococcus thermophilus)属于革兰氏阳性菌,具有兼性厌氧的特征,是一种重要的工业用乳酸菌,被广泛用于酸奶、奶酪等发酵乳制品[1];同时,嗜热链球菌还具有重要的益生特性,具有调节肠道内菌群平衡、提高免疫力、提升抗氧化水平、抑制炎症等功能作用[2-3]。嗜热链球菌对发酵产品的营养[4]、物化特性[5]和气味特征[6-7]等品质的形成具有重要意义,已引起广大学者的兴趣并进行了相关深入研究,为嗜热链球菌的应用和产品开发奠定了良好的基础。
脂质作为嗜热链球菌发酵乳中重要营养成分,其组分、分子结构鲜有报道,这主要是因为脂质种类繁多、结构复杂且含量差异大,传统的薄层色谱和气相色谱技术难以完成有效的分离、鉴定[8]。随着脂质组学技术的出现、发展和完善,为乳制品中脂质组分分析鉴定提供了有力的技术支撑和分析手段,脂质组学是一门对生物体系脂质进行全面系统分析的研究学科,利用先进仪器实现对给定基质中脂质进行快速、高通量分析鉴定是其重要研究内容之一[9-10],为乳品中复杂、繁多的脂质组分分析、鉴定提供强有力的技术支撑。
目前,脂质组学技术应用于乳品分析越来越受到重视,为乳品脂质学科发展和完善提供新技术、新思路、新方向。Li Qiangqiang等[11]基于超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(ultra-high performance liquid chromatography-quadrupole/orbitrap high resolution mass spectrometry,UPLC-Q-Orbitrap HRMS)分析了山羊奶、大豆奶和牛奶中脂质组分构成,明确了14 种差异性脂质标记物,探索牛乳掺假甄别新技术。Wang Lina等[12]基于UPLC-Q-Orbitrap HRMS分析了母乳、牛乳和羊乳脂质组分构成,明确了13 类脂质组分和200 种差异性脂质组分,为开发新型婴幼儿乳制品提供了新思路。Li Mohan等[13]采用超高效液相色谱-四极杆-飞行时间质谱确定驴初乳和驴乳13 类脂质中335 种组分构成,明确了60 种差异脂质组分,为驴乳制品开发明确了新方向。但是,对乳品脂质组学的研究主要集中在原料乳脂质品质分析,尚未涉及到发酵乳等深加工乳制品脂质研究。目前,该领域的研究已成为乳品领域重要研究方向。
本研究采用UPLC-Q-Orbitrap HRMS分析嗜热链球菌发酵乳中脂质组分,明确样品中脂质组分分布、分子结构,旨在为嗜热链球菌的应用和新型乳制品开发及乳品脂质组学进一步发展提供参考。
1 材料与方法
1.1 材料与试剂
牛乳 河北三元食品有限公司;嗜热链球菌S2河北一然生物科技有限公司提供;蔗糖 市售。
乙腈、甲醇(均为色谱纯) 美国Fisher公司;甲酸、异丙醇、甲酸铵、氯仿(均为优级纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
Q-Exactive Q-Orbitrap HRMS仪 美国Thermo Fisher Scientific公司;UltiMate 3000 HPLC仪 日本Shimadzu公司;XP 105分析天平 瑞士Mettler公司;Milli-Q Advantage A10超纯水机 美国Millipore公司;SB-5200DT超声波清洗机 宁波新芝生物科技有限公司;TYXH-I旋涡振荡器 上海汗诺仪器有限公司;TGL-16MS台式高速冷冻离心机 上海卢湘仪离心机仪器有限公司;LNG-T98冷冻浓缩离心干燥器 太仓市华美生化仪器厂;Tissuelyser-48多样本组织研磨机 上海净信实业发展有限公司。
1.3 方法
1.3.1 发酵乳制备
牛乳中加入6.0%蔗糖,搅拌均匀,待蔗糖溶化后,在5 Pa压力下进行均质化处理,将处理好的牛乳98 ℃加热15 min,立即转入水浴中冷却至约35 ℃,接种0.03%嗜热链球菌S2,将接种嗜热链球菌的牛乳加入1 000 mL无菌瓶中,42 ℃发酵至pH值达到4.2,再于4 ℃冷藏24 h,制得嗜热乳酸菌发酵乳,-24 ℃贮存,用于分析测定。
1.3.2 脂质提取
称取60 mg嗜热链球菌发酵乳,加入2 个小钢珠,-20 ℃放置2 min预冷,加入研磨机中,60 Hz研磨2 min;加300 μL氯仿,涡旋30 s,超声提取10 min,-20 ℃静置20 min;4 ℃、12 000 r/min离心10 min,取200 μL下层氯仿层装入样品小瓶中;在取完下层溶液的离心管中继续加入300 μL氯仿-甲醇(2∶1,V/V)溶液,旋涡振荡30 s,冰水浴中超声提取10 min;-20 ℃静置20 min后,12 000 r/min、4 ℃离心10 min,取300 μL下层氯仿,放入原来样品瓶中挥干;挥干后脂质样品用200 μL异丙醇-甲醇(1∶1,V/V)复溶(涡旋30 s,超声3 min),转至1.5 mL离心管中,-20 ℃静置2 h;12 000 r/min、4 ℃离心10 min,取150 μL上清液,装入带内衬管的液相进样小瓶中,用于分析测定。
1.3.3 色谱条件
ACQUITY UPLC BEH C18柱(100 mmh 2.1 mm,1.7 μm),柱温45 ℃;流速0.35 mL/min;进样量5 μL。流动相A:乙腈-水(60∶40,V/V),溶液含10 mmol/L甲酸铵和0.1%甲酸;流动相B:乙腈-异丙醇(10∶90,V/V),溶液含10 mmol/L甲酸铵和0.1%甲酸;梯度洗脱条件:0~3.0 min,70% A,30% B;3.0~5.0 min,7 0%~3 8% A,30%~62% B;5.0~15.0 m in,3 8%~8% A,62%~92% B;15.0~16.5 m in,18%~1% A,82%~99% B;16.5~18.0 min,1% A,99% B;18.0~18.1 min,1%~70% A,99%~30% B;18.1~20.0 min,70% A,30% B。
1.3.4 质谱条件
加热电喷雾离子源(heated electrospray ionization,HESI),正离子模式,温度350 ℃,喷雾电压3.5 kV,离子传输管温度320 ℃,鞘气流速40 arb;辅助器流速10 arb;吹扫气流速0 arb。负离子模式,温度350 ℃,喷雾电压3.1 kV,离子传输管温度320 ℃,鞘气流速40 arb;辅助器流速10 arb;吹扫气流速10 arb。Full MS/dd MS2扫描模式:采集范围为m/z120~1 800,正负离子同时采集;一级质谱分辨率为70 000,二级质谱分辨率为17 500。
1.4 数据处理
使用Lipid Search软件,读取Q Exactive LC-MS/MS导出的raw格式原始数据,读取MSn和母离子的精确质量数;根据每个独立样本中的母离子和多级质谱数据,鉴定其中脂质分子结构及其正负离子的加合模式;采用面积归一法计算各类脂质组分含量。
2 结果与分析
2.1 嗜热链球菌发酵乳脂质分布情况
采用UPLC-Q-Orbitrap HRMS对嗜热链球菌发酵乳中脂质组分进行分析,在HESI正离子和负离子模式进行检测,如表1所示,在嗜热链球菌发酵乳中检测到甘油酯、磷脂、鞘脂和糖脂4 类脂质物质,甘油酯包含DG和TG 2种脂质,磷脂包含CL、PA、PC、PE、PG、PI、PS、LPC、LPE 9 种脂质,鞘脂包含Cer、Hex1Cer、Hex2Cer、Hex3Cer、SM 5 种脂质,糖脂包括MGMG和MGDG 2 种脂质,总共18 种脂质成分。

表1 嗜热链球菌发酵乳中脂质成分构成Table 1 Composition of lipids in milk fermented by Streptococcus thermophilus
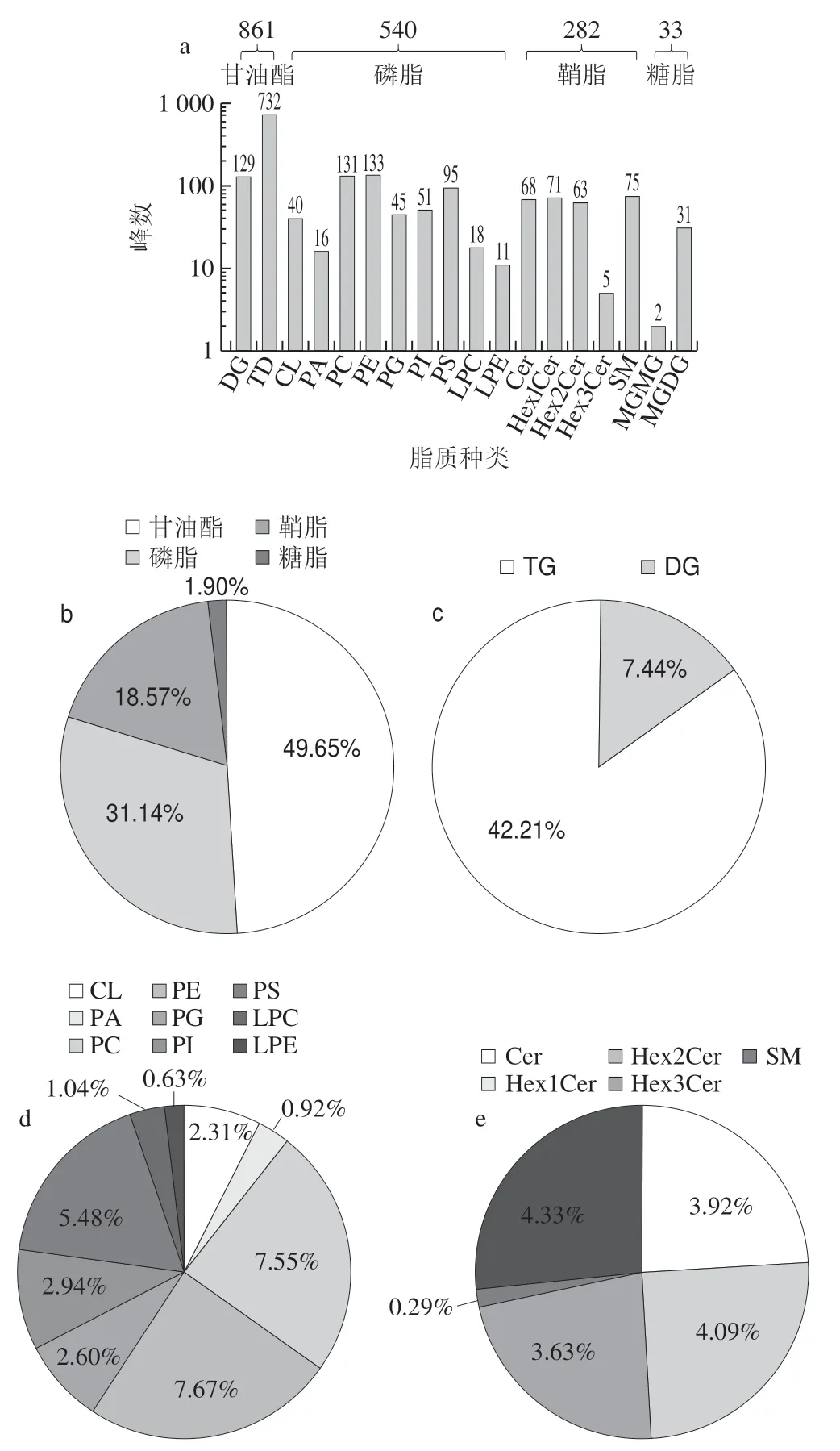

图1 嗜热链球菌发酵乳中脂质分布情况Fig.1 Distribution of peak number of lipids in milk fermented by S.thermophilus
如图1 所示,嗜热链球菌发酵乳中总共检测到1 716 个脂质峰,其中甘油酯、磷脂、鞘脂和糖脂峰数分别为861、540、282和33(图1a),相对含量分别为49.65%、31.14%、18.57%和1.90%(图1b)。甘油酯中DG和TG峰数分别129和732,相对含量分别为7.44%和42.21%(图1c);磷脂中CL、PA、PC、PE、PG、PI、PS、LPC和LPE峰数分别为40、16、131、133、45、51、95、18和11,相对含量分别为2.31%、0.92%、7.55%、7.67%、2.60%、2.94%、5.48%、1.04%和0.63%(图1d);鞘脂中Cer、Hex1Cer、Hex2Cer、Hex3Cer和SM峰数分别为68、71、63、5和75,相对含量分别为3.92%、4.09%、3.63%、0.29%和4.33%(图1e)。糖脂中MGMG和MGDG峰数分别为2和31,相对含量分别为0.12%和1.79%(图1f)。
2.2 正离子模式下嗜热链球菌发酵乳脂质构成
如图2所示,在正离子模式下检测到嗜热链球菌发酵乳中4 类(甘油酯、磷脂、鞘脂和糖脂)、15 种(DG、TG、CL、PC、PE、PG、PI、PS、LPC、LPE、Cer、Hex1Cer、Hex2Cer、SM和MGDG)、1 156 个脂质组分(图2a)。甘油酯、磷脂、鞘脂峰数分别为861、211和81,相对含量分别为95.84%、3.08%和1.08%(图2b),糖脂峰数仅为3,相对含量为痕量。甘油酯中DG和TG峰数分别129和732,相对含量分别为4.59%和91.25%(图2c),TG为主要的脂质组分;磷脂中CL、PC、PE、PG、PI、PS、LPC和LPE峰数分别为1、59、74、17、15、23、13和9,其中PC、PE、PG、PI、PS、LPC相对含量分别为2.35%、0.58%、0.02%、0.03%、0.10%、0.01%,LPE和CL相对含量为痕量(<0.005%)(图2d);鞘脂中Cer、Hex1Cer、Hex2Cer和SM峰数分别为14、8、18和41,相对含量分别为0.05%、0.06%、0.12%和0.84%(图2e)。糖脂是种类和含量最低脂质组分,峰数为3,相对含量为痕量。
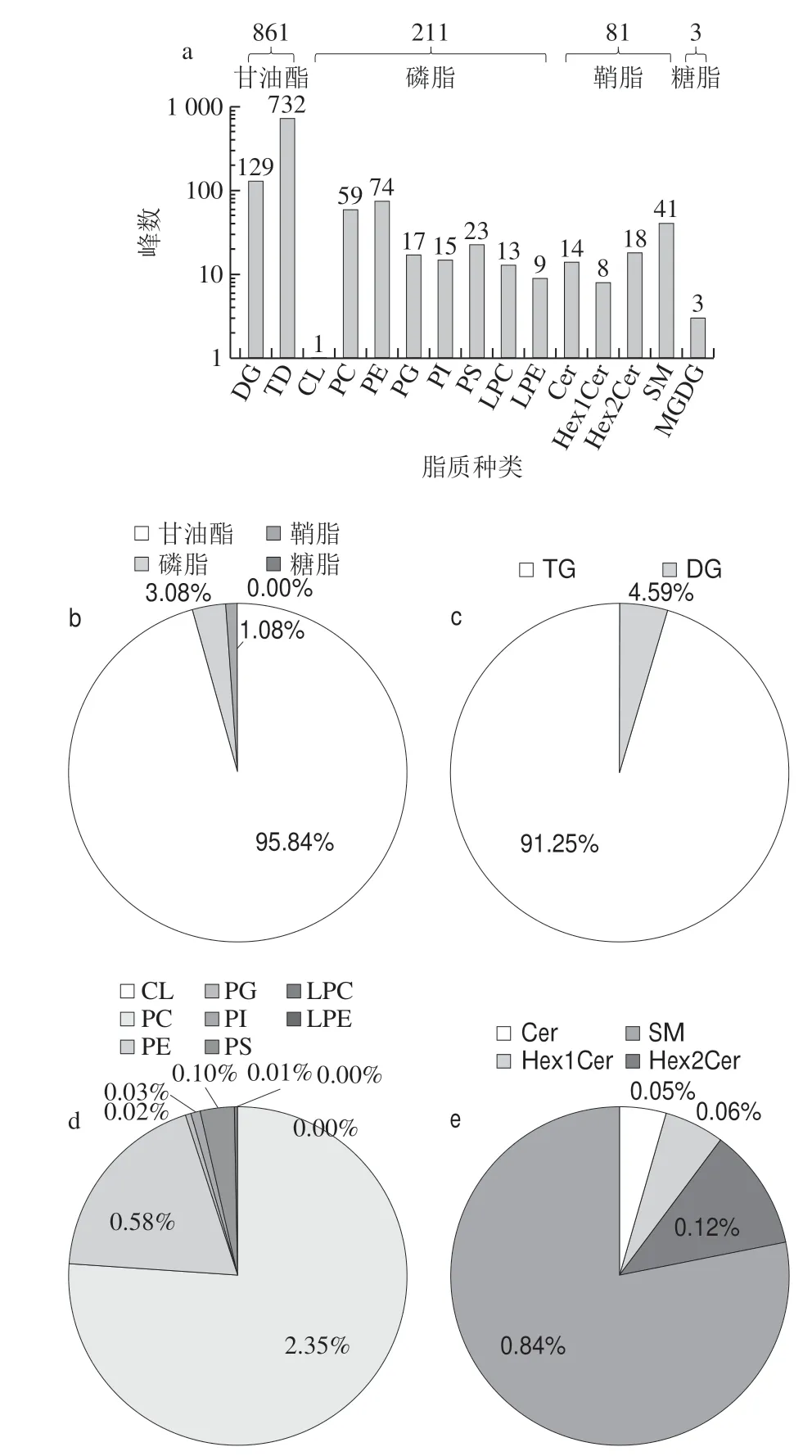
图2 正离子模式下嗜热链球菌发酵乳中脂质分布情况Fig.2 Distribution of lipids in milk fermented by S.thermophilus under positive ion mode
2.3 负离子模式下嗜热链球菌发酵乳脂质构成
如图3所示,在负离子模式下检测到3 类(磷脂、鞘脂和糖脂)、15 种(CL、PA、PC、PE、PG、PI、PS、LPC、LPE、Cer、Hex1Cer、Hex2Cer、Hex3Cer、SM、MGMG和MGDG)、560 个脂质组分。磷脂、鞘脂和糖脂峰数分别为329、201和30,相对含量分别为35.34%、28.15%和36.51%。磷脂中CL、PA、PC、PE、PG、PI、PS、LPC和LPE峰数分别为39、16、72、59、28、36、72、5和2,相对含量分别为3.15%、0.53%、15.16%、6.74%、0.93%、3.24%、5.56%、0.01%和0.02%,其中PC为主要的脂类物质含量较高;鞘脂中Cer、Hex1Cer、Hex2Cer、Hex3Cer和SM峰数分别为54、63、45、5、34,相对含量分别为3.25%、6.84%、4.82%、0.53%和12.70%,其中SM的含量较高。糖脂相对含量为36.51%,MGMG和MGDG峰数分别为2和28,相对含量分别为31.48%和5.03%,MGMG是负离子模式下检测到含量最高的脂质。

图3 负离子模式下嗜热链球菌发酵乳中脂质分布情况Fig.3 Distribution of lipids in milk fermented by S.thermophilus under negative ion mode
由图2、3可知,不同脂质组分在正负离子模式下分布差别较大,甘油酯仅在正离子模式下检测到;磷脂、鞘脂和糖脂在负离子模式下检测到较多,但是不同种类磷脂、鞘脂和糖脂成分在正负离子模式下分布也具有一定差异,磷脂CL、PA、PC、PG、PI、PS在负离子模式下峰数较多,PE、LPC和LPE在正离子模式下峰数较多;鞘脂Cer、HexCer1、HexCer2、HexCer3在负离子模式下峰数较多,SM在正离子模式峰数较多;糖脂主要在负离子模式检测到。可见不同脂质组分在不同离子状态下差别较大,采用正负离子模式可以全面了解嗜热链球菌发酵乳中脂质组分构成。
2.4 嗜热链球菌发酵乳中脂质成分构成
UPLC-Q-Orbitrap HRMS脂质组学分析技术,具有高通量检测的优点,检测到脂质组分种类繁多、结构复杂,但含量较高的脂质对样品营养和功能具有更重要贡献,因此,本研究主要对相对含量大于10%的高脂质组分进行分析,正负离子模式下检测到相对含量高于0.10%的脂质组分构成如表2、3所示。在正离子模式下检测到113 种脂质成分相对含量大于0.10%,占总量的85.24%,其中TD为主,98 种TD成分相对含量大于0.10%;在负离子模式下检测到104 种脂质成分相对含量大于0.10%,占总量的83.50%,PC、SM和MGMG等为主要脂质组分。
2.4.1 嗜热链球菌发酵乳中甘油酯组构成
甘油酯主要是由TD和DG 2 种脂质构成,它们仅在正离子模式下被检测,其中TD是最主要的脂质组分,TD主要是甘油不同位点上的羟基被脂肪酸酯化形成的,由于在甘油不同位点上的脂肪酸的碳数、双键数、双键位置和构象等的差别,使得TD的数目庞大、结构复杂[14]。由表2 可知,T D 组分中有2 1 种成分相对含量大于1%,其中TG(16∶0/6∶0/14∶0)、TG(4∶0/14∶0/16∶1)、TG(10∶0/10∶0/12∶0)、TG(4∶0/10∶0/14∶0)、TG(4∶0/17∶0/18∶0)、TG(6∶0/10∶0/18∶2)、TG(16∶1/14∶1/18∶1)7 种TD含量较高,分别占16.32%、7.79%、6.64%、4.18%、3.16%、2.69%和2.60%。在表1所示的TD脂肪酸中,主要由C4~C18的双链脂肪酸构成,其脂肪酸构成和牛乳中脂肪酸构成一致[15-16],TD主要是牛乳脂肪酸和甘油在乳腺中相关基因和蛋白作用下合成[17]。TD是牛乳中主要脂质组分,是人体的重要能量来源,其结构差别对牛乳脂肪理化特性、乳制品质量以及人体消化吸收率都有重要影响[18-20]。张宏达等[8]采用UPLC-QTOF-MS对牛乳脂质组分进行分析,也发现TG为牛乳中主要脂质组分,但发现,TG(18∶1/18∶2/18∶2)、TG(16∶0/18∶1/18∶2)和TG(16∶0/18∶0/18∶1)为牛乳中主要TD,以C16~C18链长脂肪酸为主,与本研究发酵乳TD中C4~C18脂肪酸构成有一定差异,可能与牛乳来源、品种以及发酵等因素有关。陈凤香等[21]认为,牛乳TD成分中,高、中和低分子质量脂肪酸组分所占的比例为40%、20%和40%,在一定程度上和本研究结果较为一致。DG是甘油中2 个羟基与脂肪酸酯化后得到的脂质,是牛乳中微量成分及体内脂肪代谢的内源中间产物,在检测到的DG中,仅有5 种成分相对含量大于0.10%,其中仅DG(34∶2e)的相对含量为2.79%,是含量较高的DG组分。DG是不同乳制品中广泛存在的脂质组分,在降低餐后脂质水平和促进人体中脂肪氧化具有积极作用,在减肥和肥胖治疗具有广泛应用前景[22-23]。

表2 正离子模式下嗜热链球菌发酵乳脂质组分构成(n=3)Table 2 Composition of lipids in milk fermented by S.thermophilus under positive ion mode (n= 3)

续表2

表3 负离子模式下嗜热链球菌发酵乳脂质组分构成(n=3)Table 3 Composition of lipids in milk fermented by S.thermophilus under negative ion mode (n= 3)
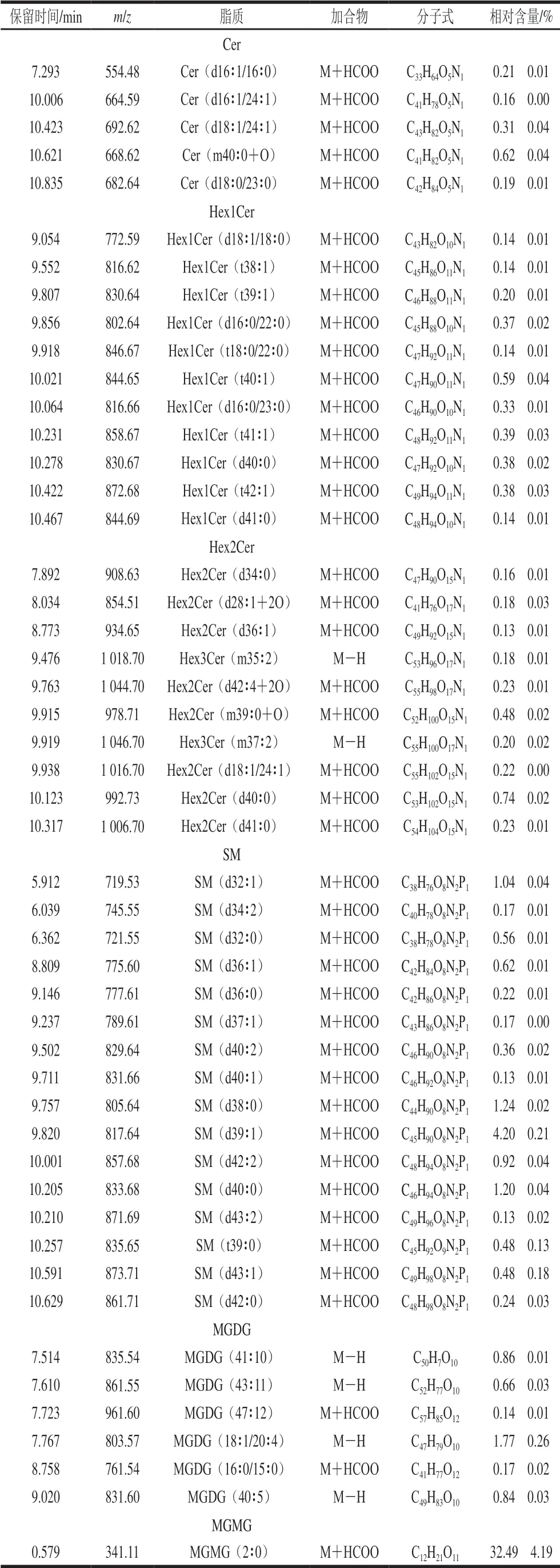
续表3
2.4.2 嗜热链球菌发酵乳中磷脂构成
磷脂为甘油的第3个羟基被磷酸酯化的脂质,是生物膜的重要组成成分,还是膜表面活性物质成分之一,参与细胞膜对蛋白质的识别和信号传导[24]。由表2、3可知,磷脂是能够在正、负离子模式下检测到的脂质,嗜热链球菌发酵乳中磷脂成分为CL、PA、PC、PE、PG、PI、PS、LPC和LPE,是生物体内常见的磷脂成分,其中CL、PA、PC、PE、PG、PI、PS在负离子模式下检测到的数量较高,而LPC和LPE则在正离子模式下检测到的数量较高。在正离子模式下仅有7 种CL和1 种PE的磷脂成分相对含量高于0.10%;而在负离子模式下分别有3 种CL、14 种PC、15 种PE、2 种PG、6 种PI和13 种PS成分相对含量大于0.10%,在这些成分中,CL(70∶2)、PC(16∶0/14∶0)、PC(18∶1/18∶1)、PC(18∶0/16∶0)和PC(18∶0/18∶1)相对含量分别为1.37%、3.60%、2.03%、1.93%和2.61%,是主要的磷脂成分,主要由C14~C18脂肪酸构成。PC(16∶0/14∶0)、PC(18∶0/16∶0)、PC(18∶0/18∶1)3 种PC组分被鉴定为母乳、豆乳和牛乳中差异性脂质组分,用于区别3 种乳品[12],另外,PC(18∶1/18∶1)和PC(18∶0/18∶1)被鉴定为驴初乳和驴乳中差异性脂质组分,用于驴乳产品开发探索[13],可见这几种PC成分可能是乳品中广泛存在的磷脂成分。磷脂被认为是抗结肠癌、胃肠道病原体、阿尔茨海默氏病、抑郁和压力的功能成分,具有两亲性质,使其适合添加到各种食品基质中[25-27]。因此,大量磷脂成分在样品中检出,对于嗜热链球菌发酵乳营养功能挖掘以及加工适应性改善可能有重要帮助。
2.4.3 嗜热链球菌发酵乳中鞘脂构成
鞘脂主要是一类以鞘氨醇为骨架的复杂化合物,鞘脂由脂肪酸、鞘氨醇和磷酸胆碱三部分组成,分为鞘磷脂、鞘糖脂和神经酰胺。存在于天然食物中,主要位于细胞糖膜、脂蛋白和其他富含脂类的组织结构上,对于维持细胞膜结构尤其是细胞膜的微控功能十分重要[28]。由表2、3可知,鞘脂也是一类能够在正、负离子模式下检测到的脂质组分,嗜热链球菌发酵乳中鞘脂为Cer、Hex1Cer、Hex2Cer、Hex3Cer和SM,在正离子模式下,仅2 种SM成分相对含量大于0.10%,在负离子模式下,分别检测到5 种Cer、11 种Hex1Cer、10 种Hex2Cer和16 种SM的甘油磷脂成分相对含量大于0.10%,在这些鞘脂中,除了Cer中脂肪酸碳链为C16~C24,其他的脂肪酸链长多数在C30以上。所检测到的鞘脂中,SM(d38∶0)、SM(d39∶1)、SM(d40∶0)相对含量较高,分别为1.24%、4.20%和1.20%,是主要的鞘脂成分。鞘脂已经在牛乳、驴乳等不同来源乳品中检测到,鞘脂具有抗癌、抑菌和低胆固醇等生物特性[29-30],在乳品开发利用中具有重要营养价值。
2.4.4 嗜热链球菌发酵乳中糖脂构成
糖脂是糖和脂质结合所形成物质总称,在生物体中分布甚广,但含量较少,仅占脂质总量的小部分。样品中糖脂为糖基酰基甘油,其结构与磷脂相类似,主链是甘油,含有脂肪酸,但不含磷及胆碱等化合物。糖类残基是通过糖苷键连接在1,2-甘油二酯的C-3位上构成糖基甘油酯分子[31]。由表2、3可知,糖脂也能被正负离子检测到,但相对含量大于0.10%的糖脂成分仅在负离子模式下被检测到,有6 种MGDG 和1 种MGMG相对含量高于0.10%,MGDG(18∶1/20∶4)、MGMG(2∶0)相对含量较高分别为1.77%和32.49%,其中MGDG是负离子模式下主要的脂质组分。目前,采用脂质组学技术在乳中检测到糖脂成分报道相对较少,研究表明,糖脂在抗肿瘤、抗HIV、抗炎症、抗菌和增强机体免疫等方面具有生物活性[32],本研究糖脂的发现对于全面了解乳及乳制品脂质构成,深入挖掘乳品生物活性具有重要意义。
3 结 论
采用UPLC-Q-Orbitrap HRMS技术具有高通量、高灵敏度、高准确度,可有效对嗜热热链球菌发酵乳中脂质的组分构成和分子结构进行全面分析,在HESI正离子和负离子模式下,共检测到1 716 个脂质组分,包含甘油酯(DG、TG)、磷脂(CL、PA、PC、PE、PG、PI、PS、LPC、LPE)、鞘脂(Cer、Hex1Cer、Hex2Cer、Hex3Cer、SM)和糖脂(MGMG、MGDG)4 类18 种脂质组分。在HESI正离子模式下,甘油酯、磷脂、鞘脂相对含量分别为95.84%、3.08%、1.08%,TG(16∶0/6∶0/14∶0)、TG(4∶0/14∶0/16∶1)、TG(10∶0/10∶0/12∶0)为主要脂质成分为主要脂质物质。在HESI负离子模式下,磷脂、鞘脂和糖脂的相对含量分别为35.34%、28.15%和36.51%,MGMG(2∶0)为主要脂质物质。基于脂质组学对嗜热链球菌发酵酸乳脂质组分构成的研究,对于全面解析嗜热链球菌发酵乳脂质构成、挖掘发酵乳的营养和功能特性具有积极指导意义,也可为嗜热链球菌的利用以及新型乳品的开发提供参考。目前,本研究只对嗜热链球菌发酵乳中脂质组分构成进行分析,尚未对发酵前后发酵乳中脂质组分差异以及脂质代谢相关酶活性变化进行研究,因此,今后需要对此进行深入研究,以期为嗜热链球菌发酵乳脂质品质形成提供理论依据。

