食用植物酵素中酵母菌的分离鉴定及耐受性研究
徐成龙,王珍珍,余瞻,王高坚,冯哲校,史文超,沙如意*,毛建卫,2*
1(浙江科技学院 生物与化学工程学院,浙江省农产品化学与生物加工技术重点实验室,浙江省农业生物资源生化制造协同中心,浙江 杭州, 310023)2(浙江工业职业技术学院,浙江 绍兴, 312000)
食用植物酵素(edible plant Jiaosu)是以一种或多种新鲜蔬菜、水果和谷豆类、海藻类、食药两用本草类等食材为原料,经长时间有益菌发酵而产生的功能性微生物发酵产品,具有丰富的活性成分、益生菌及次生代谢产物等。研究表明该类产品不仅具有抗氧化、抗炎的作用,而且具有增强机体免疫能力及抗癌等多种保健功能[1-4]。
酵母菌是一类以芽殖为主的单细胞真核微生物,在自然界分布广泛,主要生活在偏糖和偏酸环境中,广泛应用于发酵工业中。在葡萄酒工业中酿酒酵母的最适pH值通常在3.0~3.6[5],在酵素发酵过程中其发酵液具有高糖低pH的特点。所以酵母菌耐受性的强弱直接影响到了产品的周期和风味[6]。从自然发酵的酵素产品中分离出酵母菌,研究其在高糖和低pH条件下的耐受性对于研究酵素的发酵机理、功能成分、产品生产、饮料及发酵产品的开发、生产、质量控制等方面具有重要意义。
本研究从茶叶酵素,乌饭树叶酵素,铁皮石斛花酵素,紫苏酵素和火龙果酵素原液中分离出7株酵母菌,通过形态学鉴定、生理生化实验及 26S rDNA 序列分析等,对筛选菌株进行菌种鉴定,通过耐高糖实验和耐低 pH 实验,对分离出菌株的耐受性进行考察,旨在为植物酵素的发酵过程研究、工业化生产提供菌种方面基础数据。
1 材料与方法
1.1 材料与仪器
发酵一年半的茶叶酵素、乌饭树叶酵素、铁皮石斛花酵素、火龙果酵素和紫苏酵素原液,由浙江省农产品化学与生物加工技术重点实验室提供。
酵母浸粉、蛋白胨、葡萄糖、溴钾酚紫、海藻糖、甘露糖、果糖、棉子糖、可溶性淀粉、半乳糖、鼠李糖、蔗糖、葡萄糖、乳糖、麦芽糖,上海阿拉丁生化科技股份有限公司;固蓝B、KH2PO4、MgSO4·7H2O、CaCl2·2H2O、NaCl,国药集团化学试剂有限公司(上海,中国);氮源基础培养基和碳源基础培养基,美国BD公司。
MB-150CL恒温恒湿培养箱,青岛明博环保科技有限公司;SW-CJ超净工作台,无锡易纯净化设备有限公司;TS-2102C小型立式恒温摇床,上海天呈实验仪器制造有限公司;SMART光学显微镜,重庆奥特光学仪器有限公司;Allegra X-12R冷冻离心机,美国贝克曼库尔特有限公司;Spectra Max 190酶标仪,美国Molecular Devices公司。
1.2 培养基的配制
YEPD培养基:酵母浸出粉1 g,蛋白胨2 g,葡萄糖2 g,纯水100 mL,pH 6.0,121 ℃高压蒸汽灭菌15 min。
糖发酵培养基:蛋白胨1 g,水100 mL,16 g/L溴甲酚紫乙醇溶液0.2 mL,pH 7.6,20 g 碳源(海藻糖、甘露糖、果糖、棉子糖、可溶性淀粉、半乳糖、鼠李糖、蔗糖、葡萄糖、乳糖、麦芽糖),121 ℃高压蒸汽灭菌15 min。
无维生素培养基:葡萄糖2 g,(NH4)2SO40.5 g,KH2PO40.1 g,MgSO4·7H2O 0.05 g,CaCl2·2H2O 0.01 g,NaCl 0.01 g,加水至100 mL,121 ℃高压蒸汽灭菌15 min[7]。
300、450、600、750、900 g/L高糖培养基的配制:酵母浸粉1 g,蛋白胨2 g,分别加入葡萄糖30、45、60、75、90 g,水定容至100 mL,pH 5.0,121 ℃高压蒸汽灭菌15 min。
低pH培养基:酵母浸出粉1 g,蛋白胨2 g,葡萄糖2 g,水100 mL,分别调pH至1.5、2.0、2.5、3.0、3.5后,121 ℃高压蒸汽灭菌15 min。
1.3 实验方法
1.3.1 菌种的分离纯化
吸取茶叶酵素、乌饭树叶酵素、火龙果酵素、紫苏酵素、铁皮石斛花酵素原液,用梯度稀释法稀释后涂布于YEPD培养基上进行培养,用划线分离法将酵母菌分离纯化至单菌落,直至在显微镜下观察到纯菌株为止,将纯化好的菌株于斜面低温冷藏保存。
1.3.2 形态培养特征观察
将单菌落接种到YEPD固体、液体培养基中于28 ℃培养48 h,观察菌落大小、颜色,菌落凹凸程度,菌落的质地,记录菌体所在位置,有无菌醭、沉淀、浑浊,并于光学显微镜1 000倍油镜下观察其菌体形态、形状、繁殖方式并且测量其菌体大小。
1.3.3 生理生化特征鉴定
酵母菌生理生化特征鉴定:依据《酵母菌的特征及鉴定手册》和《微生物学实验手册》设计,主要包括:糖发酵鉴定[8]、碳源同化实验[9]、氮源同化实验[10]、无维生素培养基上的生长实验、耐高渗透压的测试、产生类淀粉化合物测定、单宁分解利用实验[11]、脲酶实验[12]、重氮基蓝B实验[13]等。
1.3.4 分子生物学鉴定
1.3.4.1 26S rDNA 序列测定
在上海生工生物工程技术服务有限公司完成。
1.3.4.2 同源性分析与系统发育树的构建
根据测序结果,从https://blast.ncbi.nlm.nih.gov/[14]中选择DNA数据库进行同源序列搜索(basic local alignment search tool),匹配得到与供试菌菌株的序列相似的已知菌株的序列。根据同源序列搜索结果,使用bio-edit软件将供试菌序列和已知菌株序列进行多序列对位排列,并采用MEGA 7.0软件中Neighbour-Joining方法[15]构建系统发育树。
1.3.5 耐受性试验
1.3.5.1 高糖耐受性试验
将菌种在液体YEPD培养基中活化12~16 h,制成106CFU/mL的菌悬液,按3%的接种量,分别接种于起始葡萄糖质量浓度为300、450、600、750、900 g/L的YEPD液体培养基中,pH 5.0,于28 ℃,150 r/min 条件下培养5 d,每12 h取1次样,将样品于10 000 r/min 4 ℃离心10 min,弃上清液,用无菌水重悬沉淀旋涡混匀后测定OD600,每个浓度重复 3 次。
1.3.5.2 低pH耐受性试验
将菌种在液体YEPD培养基中活化12~16 h,制成106CFU/mL的菌悬液,按3%接种量接种于pH值为3.5、3.0、2.5、2.0、1.5的YEPD 液体培养基中[16]。于28 ℃,150 r/min培养5 d,每12 h取1次样,将样品于10 000 r/min 4 ℃离心10 min,弃上清液,用无菌水重悬沉淀旋涡混匀后测定OD600,每个浓度重复3次。
1.3.5.3 数据分析
对于得到的OD600使用Microsoft Office Excel 2010处理,结果表示为Mean±SD形式。
2 结果与分析
2.1 分离纯化、形态及培养特征观察
从高糖、低 pH 的发酵液中,筛选具有典型酵母菌特征的菌落,通过形态学观察和显微镜检,从茶叶酵素中分离到2株菌Y1、Y2,从铁皮石斛花酵素中分离到1株菌Y3,从乌饭树叶中分离到2株菌Y4、Y5,从紫苏酵素中分离到1株菌Y6,从火龙果酵素中分离出1株菌Y7。7 株供试菌在固体、液体培养基上的菌落形态见表1,显微镜检图片如图1所示。初步表明该菌株符合酵母菌细胞形态特征。

表1 七株供试菌的菌落形态特征Table 1 Morphological characteristics of 7 yeast strains
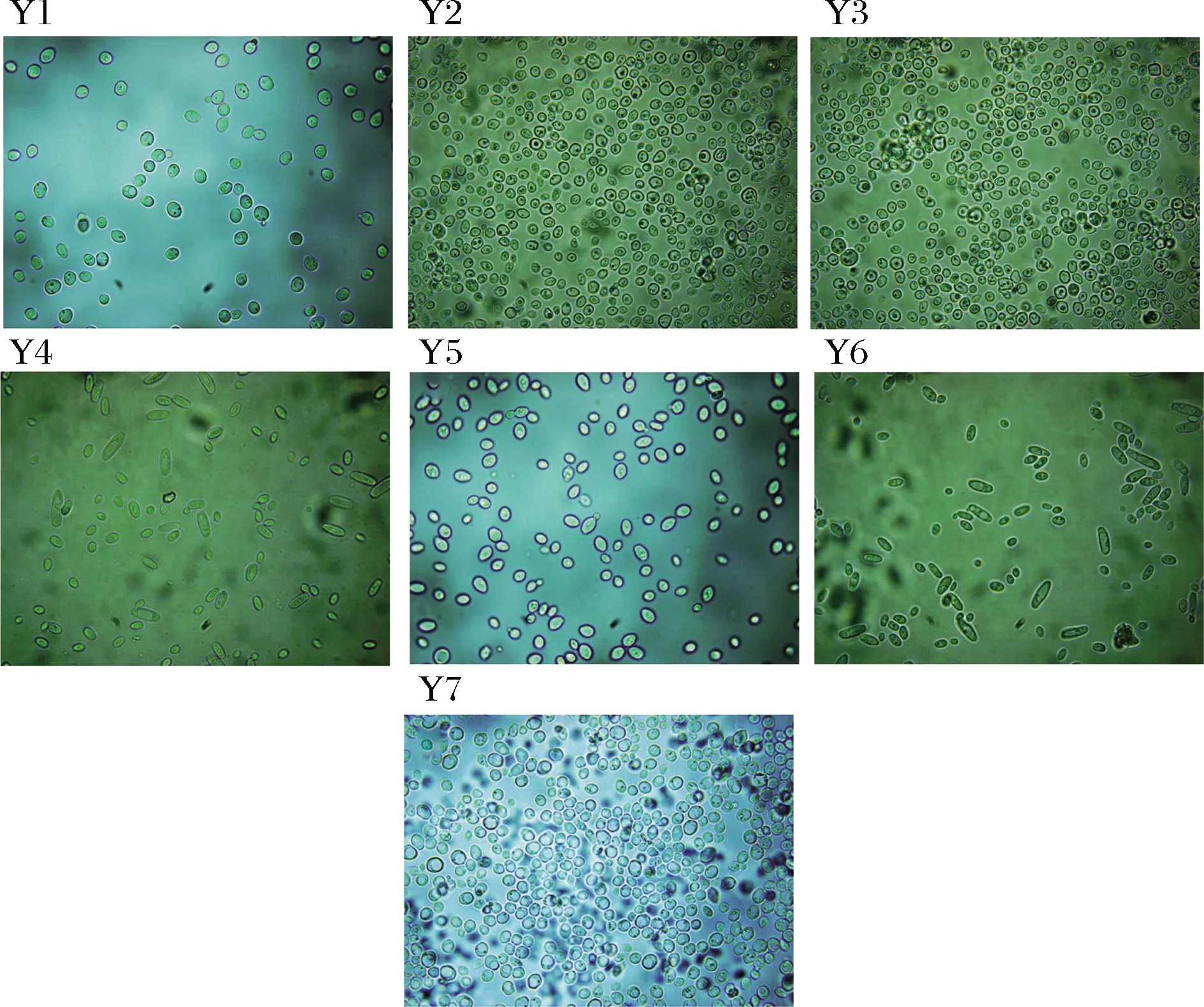
图1 七株供试菌1 000倍显微镜检图Fig.1 Microscope photos of 7 tested strains(1 000×)
2.2 菌株鉴定结果
2.2.1 菌株的生理生化特征
7株菌的生理生化特征见表2。综合上述生理生化实验结果,根据《酵母菌的特征鉴定手册》和《真菌鉴定手册》,初步判断Y1、Y2、Y3、Y5属于接合酵母属,Y4、Y6属于酵母属,Y7属于毕赤酵母属。

表2 七株供试菌生理生化特征Table 2 Physiological and biochemical characteristics of 7 tested strains
2.2.2 分子生物学鉴定
利用NL-1(5′-GCATATCAATAAGCGGAGGAAA AG-3′)和NL-4(5′-GGTCCGTGTTTCAAGACGG-3′)一对引物扩增7株供试菌26S rDNA近5′端的D1/D2 区域,得到约590~1 420 bp片段,供试菌的26S rDNA D1/D2区电泳结果见图2。
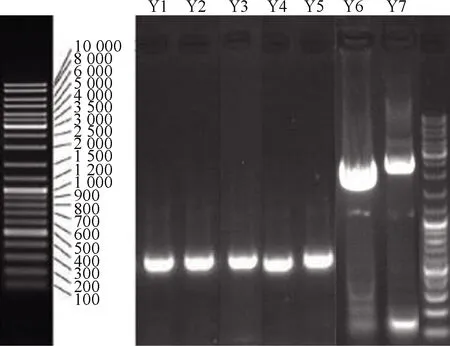
图2 七株供试菌的26S rDNA D1/D2区电泳结果Fig.2 Target gene electrophoresis of 7 tested strains
7株菌序列结果在GenBank数据库进行比对,结果显示Y1、Y2、Y3与鲁氏接合酵母的同源相似性均高于99%,Y4、Y6与酿酒酵母的同源相似性均高于99%,Y5与二孢接合酵母的同源相似性高于99%,Y7与异常威克汉姆酵母的同源相似性高于99%。同源菌株基因用MEGA7软件处理得到系统进化树,如图3所示。
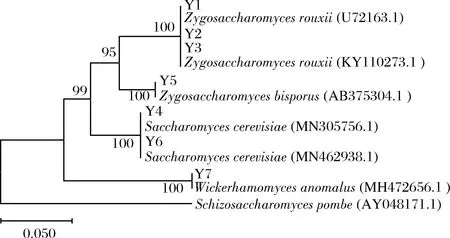
图3 系统发育树Fig.3 Phylogenetic tree
从图3可以看出,Y1、Y2和Y3与鲁氏接合酵母形成一个分支,验证可信度达到100%,Y4、Y6与酿酒酵母形成一个分支,验证可信度达100%,Y5与二孢接合酵母形成一个分支,验证可信度达100%,Y7与异常威克汉姆酵母形成一个分支,验证可信度达100%,初步确定Y1、Y2、Y3是鲁氏接合酵母,Y4、Y6是酿酒酵母,Y5是二孢接合酵母,Y7是异常威克汉姆酵母。
2.3 耐受性试验
2.3.1 高糖耐受性试验
Y1~Y7七株菌的高糖耐受性试验如表3所示,7株菌的生长趋势基本符合微生物的生长曲线,随着葡萄糖浓度的增大,7株菌的延滞期不断延长且7株菌均不能在900 g/L葡萄糖培养基中生长。Y1~Y7分别在经过了60、48、72、84、72、60 h的延滞期后,可在750 g/L葡萄糖培养基中生长。Y4仅能在经过了24 h的延滞期后,可在450 g/L葡萄糖培养基中生长。

表3 七株供试菌高质量浓度葡萄糖条件下光密度值变化Table 3 Changes in optical density of 7 tested strains under high concentration of glucose
WANG等[17]考察了高糖环境对鲁氏接合酵母生长的影响,发现随着糖含量的增加,鲁氏接合酵母的生长速率降低,培养基中菌体浓度也降低,表明菌种的生长受到抑制;YALÇIN等[18]研究表明,酿酒酵母可以在20~300 g/L高糖环境下生长,初始糖浓度越高,酿酒酵母的干重越低,表明菌种的生长受到抑制程度越高;李梦琦等[19]的研究表明400 g/L葡萄糖对鲁氏接合酵母的生长产生了一定的抑制作用。
2.3.2 低pH耐受性试验
Y1~Y7七株菌的低pH耐受性试验如表4所示,7株菌整体基本符合微生物的生长曲线,随着pH的降低,7株菌的延滞期不断延长,且仅Y6、Y7在经过了96、84 h的延滞期后能在pH 1.5的培养基中生长。Y1、Y2分别在经过了36、12 h的延滞期后,可在pH 2.5的培养基中生长。Y3、Y4、Y5仅能在经过12 h 的延滞期后,在pH 3.0的培养基中生长。
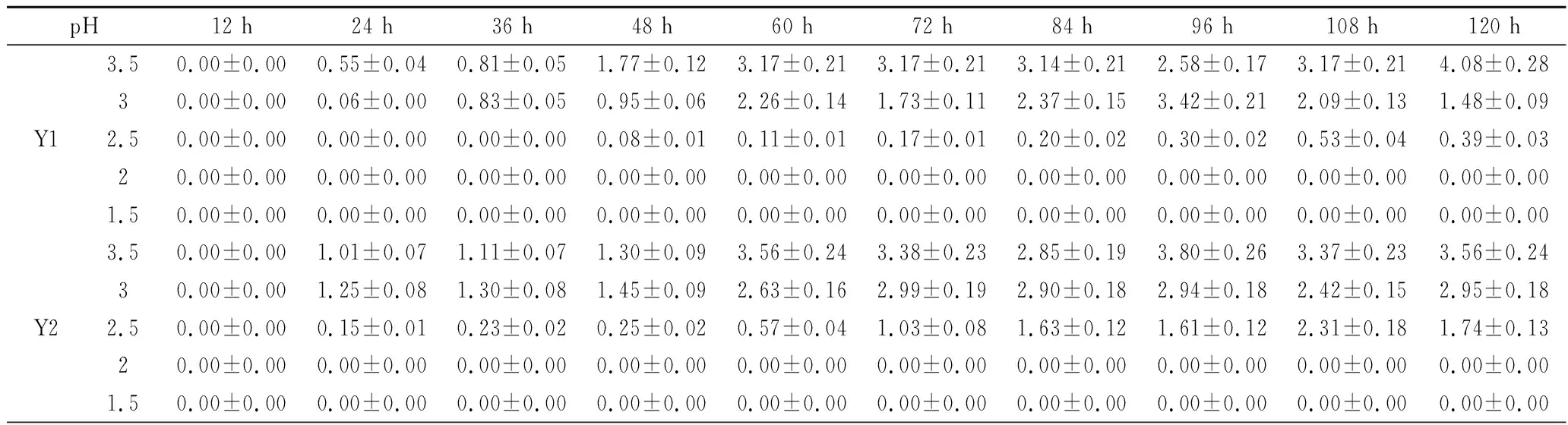
表4 七株供试菌低pH条件下光密度值变化Table 4 Changes in optical density of 7 tested strains under low pH
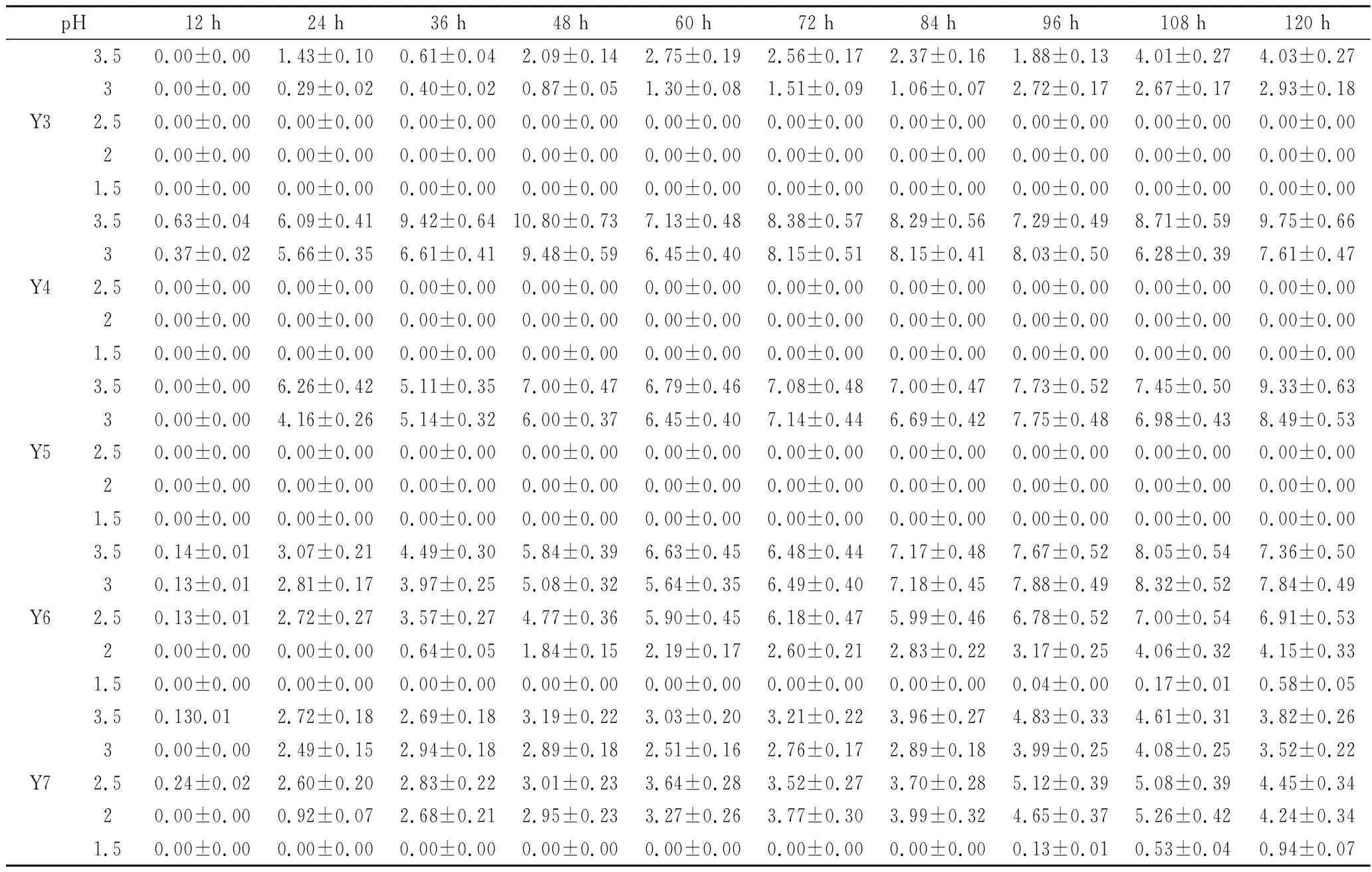
续表4
YAN等[20]发现随着培养基酸度的增加,酿酒酵母的生物量越低;AKINORI等[21]研究表明,培养基pH<2.5,pH越低酿酒酵母的生长受抑制程度越高,其延滞期越长;章之柱等[22]研究表明pH<3.5时,pH对菌株生长影响较大,与本研究结果基本一致。
3 结论
从茶叶酵素中筛选到2株菌Y1、Y2;从铁皮石斛花酵素中筛选到1株菌Y3;从乌饭树叶中筛选到2株菌Y4、Y5;从紫苏酵素中筛选到1株菌Y6;从火龙果酵素中筛选出1株菌Y7。Y1、Y2、Y3与鲁氏接合酵母的同源相似性均高于99%;Y4、Y6与酿酒酵母的同源相似性均高于99%;Y5与二孢接合酵母的同源相似性高于99%;Y7与异常威克汉姆酵母的同源相似性高于99%。Y1、Y2、Y3、Y5的最高耐受初始葡萄糖质量浓度为750 g/L,Y4最高耐受初始葡萄糖质量浓度为450 g/L,Y6、Y7的最高耐受初始葡萄糖质量浓度为600 g/L;初始葡萄糖含量越高,酵母菌的延滞期越长,酵母菌生长受到抑制程度越高,所有菌株均不能在初始葡萄糖质量浓度为900 g/L时生长。Y1、Y2的最低耐受初始pH值为2.5,Y3、Y4、Y5的最低耐受初始pH值为3.0、Y6、Y7的最低耐受初始pH值为1.5,培养基初始pH越低,酵母菌延滞期越长,酵母菌生长受到抑制程度越高。

