改良背主动脉注射法对鸡胚发育与转基因表达效率的影响
韦金鱼,韦茏芹,徐小明,邢青波,肖艳宇,许梦缘,吴文德,李恭贺,郑喜邦
(广西大学动物科学技术学院,广西南宁 530004)
家禽转基因在提高家禽产肉产蛋率、提高抗病能力、建立生物反应器模型等方面具有重要的应用价值[1-3]。相比于哺乳动物生物反应器,禽类输卵管生物反应器具有孵化时间短、世代间隔短、繁殖速度快、生产成本低、产量高等诸多优点[4-9]。目前,转基因鸡研究面临的困难是无法采用核移植手段产生转基因鸡[10-11]。1988年,Perry[12]开发了鸡胚培养体系(System I~III)。在System II 阶段,将来自新鲜受精蛋的供体全胚转移到受体蛋壳中;在System III 阶段,将培养2.5 d 的鸡胚转移到更大的受体蛋壳中,继续培养至出壳。虽然胚盘下腔注射法技术简单,但注射后的鸡胚需要进行2 次换壳,对鸡胚造成较严重的机械性损伤,鸡胚存活率低。传统背主动脉注射法就是通过蛋壳钝端开窗,将外源基因注射到HH14~16 期鸡胚背主动脉中,封闭窗口,继续孵化出壳[13]。背主动脉注射法的优点是无需换壳培养,缺点是壳内注射精准度低,转基因效率也随之下降[14],也不能对转基因鸡胚发育过程进行直视观察。因此,传统背主动脉注射方法有待改进。
本实验采用壳外背主动脉注射与System III 换壳培养相结合,对传统背主动脉注射法进行改良,对比改良背主动脉注射法与其他2 种注射法对转基因鸡胚存活率、孵化率及转基因表达效率的影响。
1 材料与方法
1.1 实验材料和试剂 本实验所用受精蛋及非受精蛋(System II 待用受体)采购于广西南宁富凤农牧有限责任公司;双黄蛋(System III 待用受体)购自南宁良凤农牧有限责任公司;注射用AAV 病毒颗粒(HBAAVCMV-EGFP)购自上海汉恒生物科技有限公司,滴度为1×108转导单位(Transducing Units,TU)/mL。
1.2 实验分组 实验组分别为X 期鸡胚胚盘下腔注射组(以下简称胚盘下腔注射组)、HH14~16 期鸡胚背主动脉注射组(以下简称传统背主动脉注射组),HH14~16 期鸡胚改良背主动脉注射组(以下简称改良背主动脉注射组)。各实验组每次均注射30 枚受精蛋,进行5 次独立实验,各组共注射150 枚受精蛋。空白对照组不做任何处理,每次入孵12 枚受精蛋,总共入孵60 枚受精蛋。
鸡胚孵化期间,每天观察鸡胚发育情况,记录鸡胚存活率。鸡胚孵化出壳后,统计孵化率。对新鲜死亡的雏鸡或引颈处死后的雏鸡,用荧光蛋白手电筒照射观察雏鸡体表和内脏组织是否有绿色荧光蛋白表达,并统计EGFP 阳性率。
1.3 EGFP-AAV 显微注射方法
1.3.1 胚盘下腔注射法 初产受精蛋作为供体,选择比供体重3~5 g 的非受精蛋作为System II 受体,称重并逐一配对,用0.01% 苯扎溴铵溶液清洗受精蛋与受体蛋壳外表面,再用75% 酒精喷洒消毒。用微型电磨机在受体蛋尖端切开直径为32 mm 窗口,弃去内容物,蒸馏水冲洗内、外表面。受体蛋窗口朝下,放置在一个内衬湿润纱布的陶瓷盘里。在超净工作台内轻轻敲破受精蛋蛋壳,将全胚移入System II 受体蛋壳中,使胚盘上浮,用口吸管连接显微注射针,在体视显微镜下,借助冷光源照射,将2 µL EGFP-AAV 病毒注射至胚盘下腔,Saran Wrap 保鲜膜(5 cm×5 cm)封闭蛋壳窗口,窗口朝下,放入鸡胚培养箱中,在37.8℃,相对湿度为60%的条件下培养2.5 d。对于存活鸡胚,选择比相应供体重30~35 g 双黄蛋作为System III 受体。受体蛋壳的处理方法同System II,不同之处就是在受体蛋壳的钝端开窗,直径为42~45 mm。将存活鸡胚转移到System III 受体蛋壳中,Handi-Wrap 保鲜膜封闭窗口,窗口朝上,放入培养箱,继续培养至出雏(图1)。
1.3.2 传统背主动脉注射法 将受精蛋置于孵化箱孵化,孵化条件为温度37.8℃,相对湿度60%。孵化约2.5 d 后,将受精蛋钝端朝上,水平静置1~2 h。使用照蛋器确定气室位置,并用铅笔标记。75%酒精棉球擦拭蛋壳,用镊子在铅笔标识区域中央开一个直径为 1~1.5 cm 窗口,壳膜表面滴加少许灭菌生理盐水,撕破壳膜,口吸管连接显微注射针,将2 µL EGFP-AAV 病毒液注射至鸡胚背主动脉中。使用封口膜(Parafilm)封闭窗口。窗口朝上,继续培养,直至出雏(图2)。

图1 胚盘下腔注射与换壳培养
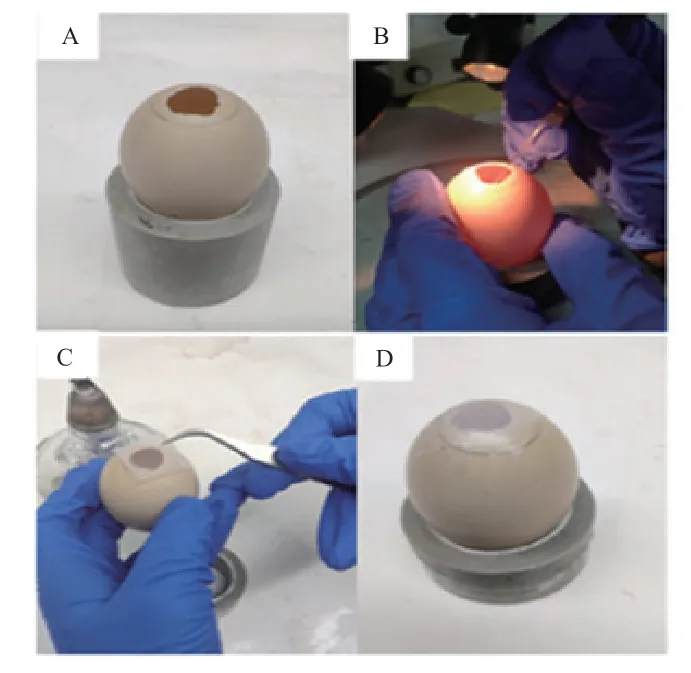
图2 传统背主动脉注射法
1.3.3 改良背主动脉注射法 新产受精蛋用作供体,称量并记录重量,将其放入温度为37.8℃、相对湿度为60%的培养箱中。对发育至HH14~16 期(约2.5 d)鸡胚,选用比相应供体重30~35 g 双黄蛋为受体。受体蛋壳的处理方法同胚盘下腔注射法System III。用75%的酒精擦拭供体蛋壳表面,在超净台内轻轻敲破蛋壳,将全胚倒入一次性称量盘中,鸡胚朝上,口吸管连接显微注射针,在体视显微镜下,2 µL EGFP -AAV 病毒注射至鸡胚背主动脉中。将注射后的鸡胚移入受体蛋壳内,Handi-Wrap 保鲜膜封闭窗口,窗口朝上放入培养箱,继续培养至出雏(图3)。
1.4 统计分析 计算培养至第8、14、18、21 天转基因鸡胚存活率和14 d 至出壳后鸡胚EGFP 阳性检出率。采用SPSS 22.0 单因素方差分析方法分析不同试验组间的差异显著性。P<0.05 表示差异显著,P<0.01 表示差异极显著。
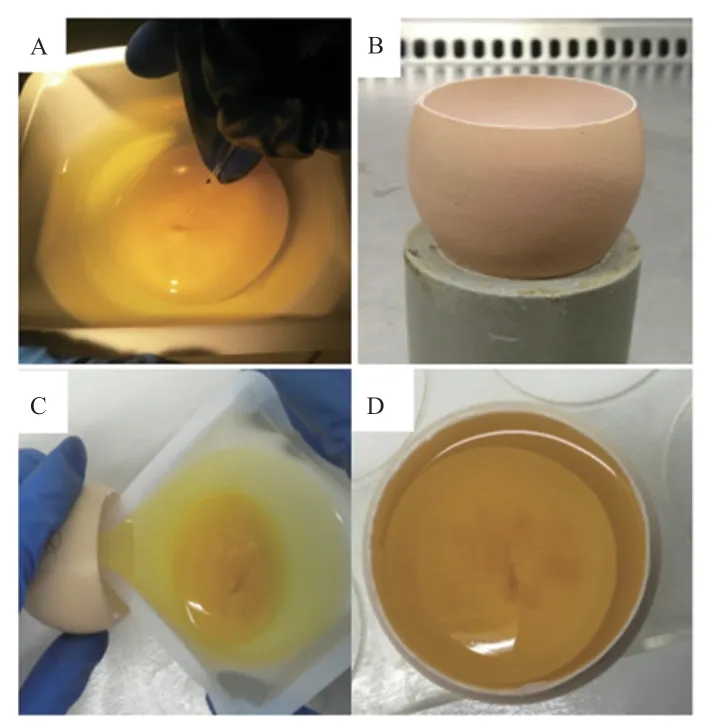
图3 改良背主动脉注射法及换壳培养
2 结果
2.1 不同注射方法对鸡胚发育的影响 如图4 所示,鸡胚发育至8 d 时,胚盘下腔注射组与传统背主动脉注射组的鸡胚存活率无显著差异。然而,改良背主动脉注射组鸡胚存活率高于传统背主动脉注射组(P<0.01)。随着时间推移,鸡胚存活率总体呈现下降趋势。但当鸡胚胎发育至14、18、21 d 时,改良背主动脉注射组的存活率高于胚盘下腔注射组(P<0.05 或P<0.01)和传统背主动脉注射组(P<0.01)。
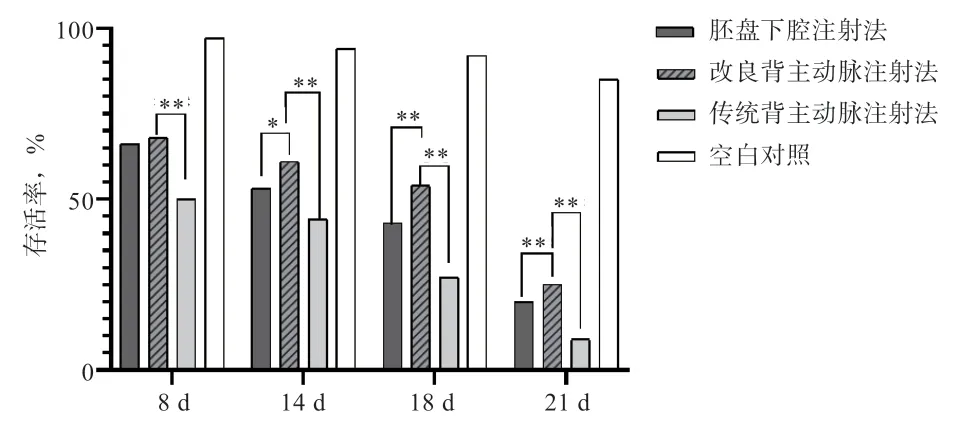
图4 3 种注射方法对鸡胚存活率的影响
2.2 不同注射方法对鸡胚孵化率的影响 如图5 所示,改良背主动脉注射组转基因鸡胚孵化率(37%)高于胚盘下腔注射组(26%)和传统背主动脉注射组(16%)(P<0.01)。
2.3 不同注射方法对鸡胚EGFP 表达效率的影响 对新鲜死亡或引颈处死后的雏鸡,用荧光蛋白手电筒及其适配滤光镜观察绿色荧光蛋白的表达情况。单因素方差分析结果表明,改良背主动脉注射组鸡胚EGFP 阳性率高于胚盘下腔注射组与传统背主动脉注射组(P<0.01)(图6)。EGFP 多在心脏、胆囊、胸骨、皮肤、喙等部位表达(图7)。

图5 3 种注射方法对鸡胚孵化率的影响
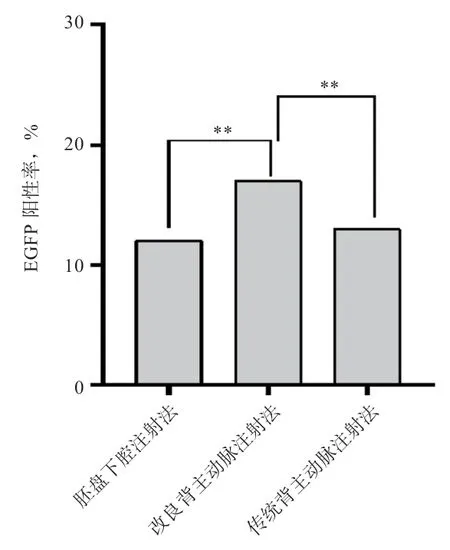
图6 3 种注射方法对鸡胚EGFP 表达效率的影响
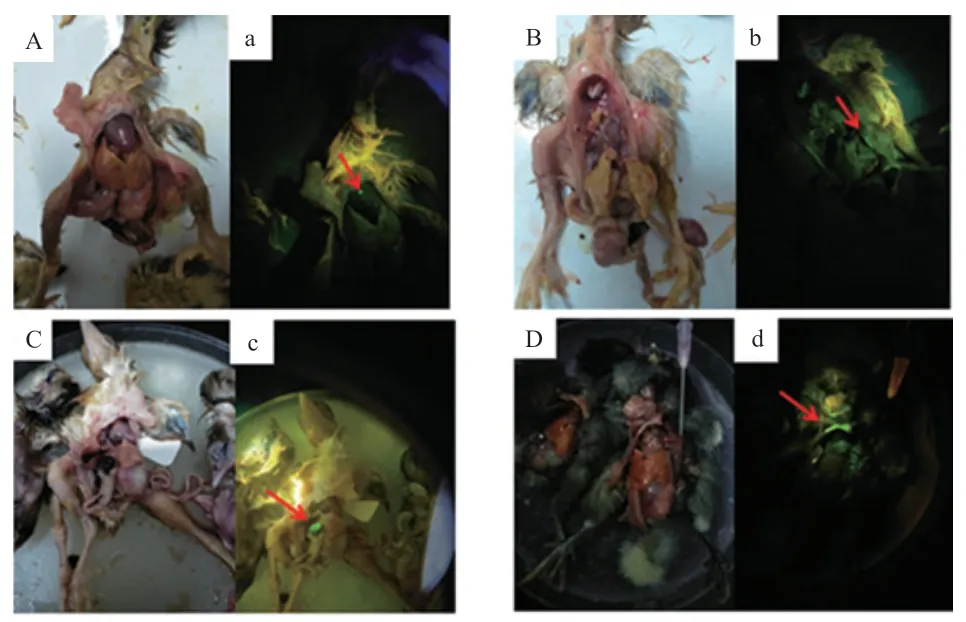
图7 转基因鸡胚EGFP 检测
3 讨 论
换壳培养对禽类胚胎生物学基础研究和转基因家禽研究具有重要作用。本实验中,胚胎从System II 至System III 阶段胚胎存活率逐渐下降的原因之一,可能是由于胚胎换壳操作而引起的胚胎损伤所致[15-16]。另外,胚盘下腔注射和背主动脉注射也对胚胎造成机械性损伤,这也是造成胚胎死亡的原因。本实验中改良背主动脉注射组转基因鸡胚孵化率高于胚盘下腔注射组,是因为前者只需要1 次换壳培养操作,对鸡胚造成的机械性损伤小于后者。
显微注射方法是生产转基因嵌合体鸡最为关键的环节,在不同发育时期进行显微注射可能会直接影响后续胚胎存活率和外源基因的表达效率。作为精子和卵子的前体细胞,原始生殖细胞(Primordial Germ Cells,PGCs)被认为是制备转基因鸡较为理想的靶细胞,通过体内转染或转导PGCs 有希望获得转基因鸡[17-18]。新产受精蛋已经处于鸡胚发育HH 10 期,位于胚盘和卵黄之间的胚盘下腔内已经有5 万~6 万个胚胎细胞,但其中只有40 个PGCs;在HH 14~16 期(约2.5 日龄),当血岛和血管形成时,PGCs 进入血液循环,其数量增加至100~200 个[18]。这也是本实验改良背主动脉注射组转基因鸡胚EGFP 阳性率高于胚盘下腔注射组的原因。相对于传统背主动脉注射法,改良背主动脉注射法实现了壳外背主动脉注射,提高了注射的准确度,进而提高了转基因鸡胚胎组织EGFP 阳性率。
种族亲缘关系的远近(种族发生间隔)也是影响孵化率的另一个因素。分别从鸡、火鸡、珍珠鸡和鸭蛋分离稀蛋清作为受体蛋清,鸡蛋壳作为System III 阶段受体,鸡胚在这些不同受体蛋清和相同受体蛋壳中的孵化率分别为60.4%、55.3%、47.9% 和19.1%[15],证明了鸡胚在鸡蛋清和鸡蛋壳中的孵化率最高。因此,选用亲缘关系较近的禽蛋作为受体进行换壳培养,就可以减少鸡胚死亡率。在本实验的System II 至System III 阶段,均采用鸡蛋清和鸡蛋壳作为受体,在一定程度上降低了鸡胚死亡率。
禽类胚胎在发育过程中高度依赖蛋壳,蛋壳不但可以保护胚胎免受物理应激和微生物感染,还能调节水分和提供矿物质;受体蛋壳的厚度和封口膜材质影响孵化率[19]。通过受体蛋壳改善氧气供应是胚胎体外培养的重要因素,不同受体蛋壳会造成不同孵化率[20]。本实验中,改良背主动脉注射组和胚盘下腔注射组均采用鸡双黄蛋为System III 受体,尽管有显微注射操作造成的机械性损伤,改良背主动脉注射组和胚盘下腔注射组转基因鸡胚孵化率分别达到37%和26%。这可能是因为双黄蛋用作System III 受体蛋壳,其厚度与供体鸡胚蛋壳相等,改善了氧气供应,防止因蛋壳厚度不同而导致的缺氧。封口用塑料薄膜造成的水分蒸发不足和透气性欠佳也会导致鸡胚死亡,进而降低孵化率[21-22]。在System III 阶段,受体窗口封闭时,相对于Saran Wrap 膜,Handi-Wrap 膜封口后的孵化率提高了30%[11]。
位于蛋壳内的绒毛尿囊膜是很重要的膜系统,其与发育鸡胚气体交换和从蛋壳摄取钙等矿物质直接相关。因此,正常膜系统发育是保证禽类胚胎正常孵化的前提条件。在换壳培养体系中,氧气供应不足是一个重要问题。Kamihira 等[20]在胚胎发育后期供氧,使鹌鹑在鸡蛋壳内的孵化率达到35%,减少了胚胎死亡率。但此种做法会提高实验成本,在大规模实验中缺乏可操作性。有研究报道,在无蛋壳体外培养体系中,利用可透气的聚四氟乙烯膜[15]或聚二甲硅氧烷膜[23]用作替用蛋壳能获得稳定的孵化率。这是因为聚四氟乙烯膜和聚二甲硅氧烷膜能够保证各方向的气体交换,同时,其疏水表面有利于绒膜尿囊膜的正常发育[19]。从气体交换和绒毛尿囊膜的正常发育考虑,聚四氟乙烯膜和聚二甲硅氧烷膜可能是适宜的蛋壳替代品[15,19]。本实验采用了Handi-Wrap 保鲜膜作为受体蛋壳窗口封闭材料,不具有疏水和透气特性。如果将透明聚四氟乙烯膜或聚二甲硅氧烷膜作为System III 阶段受体蛋壳封口膜,可能会进一步提高转基因鸡胚孵化率。
总而言之,改良背主动脉注射法实现了对鸡胚的壳外背主动脉注射和对鸡胚发育全过程的直视观察,提高了注射的准确率,进而提高了转基因鸡胚孵化率和转基因表达效率,改良背主动脉注射法对转基因鸡研究具有重要应用价值。

