早产儿缺血缺氧性脑病的CT、MR影像表现及其与D-二聚体、脂蛋白a水平的相关性
翟丽娜,闫丽娟,张晓丽,平莉莉,翟淑芬
缺血缺氧性脑病(hypoxic ischemic encephalopathy,HIE)是因新生儿窒息引起脑供血和能量代谢异常所致的一种脑损伤,临床表现为神经系统异常,是新生儿死亡和导致神经系统遗留后遗症的重要原因。妊娠达28周但不足37周分娩者称为早产儿,此时新生儿尚未完全发育成熟,脑组织更易出现缺血缺氧性损伤,早产儿HIE主要病理改变为原生基质出血、脑室旁出血性脑梗死、脑室周围白质软化和脑梗死[1-3]。计算机断层扫描(CT)和磁共振(MR)是目前临床最常用的HIE影像学检查手段。CT具有辐射,但扫描时间短,对出血检查较敏感。MR为多方位、多序列无辐射成像,对大脑灰白质辨识程度高,对微小出血灶、脑室周围白质软化症、脑梗死、脑水肿等检出敏感度较高。对早产儿HIE的早期诊断和干预治疗可以改善患儿预后,减少后遗症的发生。目前对足月儿HIE研究较多,而早产儿HIE研究相对较少。因此,本研究旨在探讨早产儿HIE的CT、MR影像表现及其与D-二聚体(D-D)、脂蛋白a(ApoA)水平的相关性,报道如下。
1 资料与方法
1.1 临床资料 选取2011年6月—2020年3月河北省邯郸市中心医院新生儿科诊治HIE早产儿57例为病例组,其中男31例,女26例,胎龄31+2~36+3周,中位数34周;出生体质量1.2~2.6 kg,中位数2.0 kg。以同期同胎龄、同出生体质量的颅脑正常早产儿43例作为对照组,男22例,女21例,胎龄31+5~36+1周,中位数34周;出生体质量1.1~2.7 kg,中位数2.1 kg。2组性别、胎龄、体质量等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,患儿父母知情同意并知情签署同意书。
1.2 病例选择标准 (1)纳入标准:所有患儿均符合临床上早产儿HIE[4]诊断标准;均完善CT、MR影像学检查及血清D-D、ApoA检查。(2)排除标准:临床资料不完整或图像质量不符合诊断标准;除HIE外还有其他脑部疾病患儿。
1.3 观察指标与方法
1.3.1 CT、MR检查: 在患儿熟睡后进行CT、MR检查,否则在检查前30 min肌内注射苯巴比妥10~15 mg/kg,患儿由一名家属陪同检查。扫描时用棉花团塞住患儿外耳道以减少噪音,并适当固定患儿头部以减少运动伪影,将铅皮箱遮盖患儿颈部以下部位。采用GE 64排螺旋CT机扫描,取常规颅脑体位及听眶下线,120 kV,100 mA,层厚5 mm,层间距5 mm,并重建1 mm薄层图像,窗宽85~100 Hu,窗位35~45 Hu。采用GE Signal 1.5T MR进行扫描,8通道相控阵头颅线圈,主要包括横断位SE-T1WI、SSFSE-T2WI、DWI,层厚及层间距分别为3.5 mm、1.5 mm,FOV均为160 mm×160 mm;SE-T1WI:TR 380 ms,TE 11 ms,矩阵256×192;SSFSE-T2WI:TR 2500 ms,TE 120 ms,矩阵256×224;DWI:TR 5300 ms,TE 86.5 ms,矩阵130×130,b值为1 000 s/mm2。
1.3.2 血液D-D、ApoA水平 检测:所有患儿均于住院后次日采取空腹肘静脉血4 ml,其中一管血用枸橼酸钠抗凝,离心后取血浆测定D-D,另一管血静置离心后取血清检测ApoA,均采用ELISA法测定。D-D含量测定采用Dade公司提供试剂盒和Sysmex CA-1500血液凝固仪;ApoA试剂盒由福建太阳生物技术公司和美国Biopool Intertional公司提供。所有操作均严格按照说明书进行。
1.4 疾病分度评判标准
1.4.1 HIE临床分度:根据中华医学会儿科学会新生儿学组HIE临床分度标准[4]分为轻度、中度和重度。轻度:意识表现为过度兴奋,兴奋症状在24 h内最明显,3 d内逐渐消失,预后较好;中度:临床表现为嗜睡、迟钝,肌张力减低,原始反射减弱,通常伴惊厥,症状多在1周末消失,10 d后仍不消失者可能遗留后遗症;重度:临床表现为昏迷,肌力松软或间隙性增高,原始反射消失,多见惊厥,常有中枢性呼吸衰竭,瞳孔不对称或扩大,前囟紧张,病死率较高,多在1周内死亡,存活者症状持续数周,遗留后遗症可能性较大。
1.4.2 CT分度[5]:轻度:脑实质内低密度区≤2个脑叶或脑室周围低密度灶;中度:脑实质内低密度区>2个脑叶,但没有累及全部脑叶,常合并颅内出血,可出现脑池、脑沟受压征象;重度:脑实质内弥漫分布低密度影(基底节、丘脑、小脑可除外),多合并颅内出血,脑室受压变小。
1.4.3 MR分度[6-7]:轻度:单个或局灶性、前/后部白质或脑室周围白质损伤,病变脑叶<2个,无颅内脑出血,无脑功能受损;中度:脑室周围白质损伤,可合并脑叶损伤、病灶范围>2个脑叶,呈片状,白质、灰质信号比较模糊,可有颅内出血和脑功能受损;重度:病变范围较广泛,有颅内出血和脑功能受损,此外可表现为基底核对称性T1WI不均匀高信号,T2WI变化不显著,内囊后肢正常高信号消失,为低信号(正常髓鞘化障碍);皮质下囊状改变,弥漫性脑水肿。

2 结 果
2.1 HIE临床分度及CT、MR分度情况比较 HIE临床轻度、中度、重度患儿分别为18例(31.58%)、31例(54.39%)、8例(14.03%)。临床HIE分度(轻度、中度、重度)与CT分度、MR分度比较差异均无统计学意义(P>0.05),见表1。CT、MR分度与临床分度不符合病例分别为14例(24.56%)、12例(21.05%)。
2.2 HIE患儿CT、MR影像学表现
2.2.1 CT表现: 轻度HIE患者21例(36.84%),表现为2个脑叶内低密度灶或脑室周围低密度灶,颅内未见明显脑出血征象;中度HIE患者24例(42.11%),表现为脑室周围白质内低密度灶,其中14例合并脑叶低密度灶,脑室出血9例,蛛网膜下腔出血8例,室管膜下出血7例,混合性出血6例,脑梗死4例;重度HIE患者12例(21.05%),均可见脑室周围白质密度减低并脑叶低密度灶,其中4例表现为脑实质内弥漫性低密度灶,合并脑室出血5例,蛛网膜下腔出血5例,室管膜下出血4例,混合性出血7例,脑梗死4例;中度和重度HIE中分别可见1例和2例脑室周围白质软化,见图1。
2.2.2 MR表现:轻度HIE患儿19例(33.33%),表现为局灶性脑叶或脑室周围白质损伤,单个或多个散在小斑片状稍短T1、稍短或等T2信号,DWI病灶呈高信号或等信号;中度HIE患儿25例(43.86%),均可见脑室周围白质损伤,表现为侧脑室周围白质区对称性或片状稍短T1、稍短或等T2信号,DWI病灶呈高信号或等信号,其中合并脑叶损伤14例,脑室出血8例,蛛网膜下腔出血6例,室管膜下出血5例,混合性出血5例,均表现为T1WI高信号,T2WI低信号,DWI低信号改变,5例可见脑梗死表现,表现为T1WI、T2WI呈不均匀性高信号,DWI呈高信号,相应ADC呈低信号改变,尚可见2例脑室周围白质软化,表现为脑室边缘不光整,T1WI低信号,T2WI高信号;重度HIE患儿13例(22.81%),均可见脑室周围白质及脑叶损伤信号,其中4例合并弥漫性脑白质异常信号,脑室出血5例,蛛网膜下腔出血4例,室管膜下出血4例,混合性出血6例,4例表现为脑室周围白质软化,见图2。
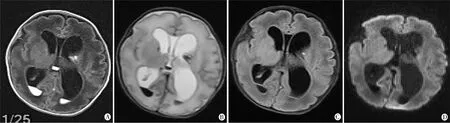
注:A.B.C.双侧大脑半球见多发斑片状长T1长T2信号,边界不清,第三脑室及双侧侧脑室内积血,左侧室管膜下出血,幕上脑室系统稍扩张积水;D.DWI示右额叶弥散受限呈高信号,提示脑梗死
2.3 2组D-D、ApoA水平比较 病例组不同临床HIE、CT及MR分度(轻度、中度、重度)与对照组D-D比较差异均有统计学意义(P均=0.000),HIE患儿血中D-D水平均比对照组高,且随HIE分度严重程度增加水平逐渐增高,但HIE临床、CT及MR分度间比较差异均无统计学意义(P>0.05)。病例组不同临床HIE分度、CT分度、MR分度(轻度、中度、重度)与对照组ApoA水平比较差异均有统计学意义(P均=0.000),HIE患儿血中ApoA水平均比对照组高,且随HIE分度严重程度增加其水平逐渐增高,但HIE临床、CT及MR分度间比较差异均无统计学意义(P>0.05),见表2。

表2 2组血浆D-D和血清ApoA水平比较
2.4 CT及MR分度与D-D、ApoA的相关性 采用Spearman相关性分析显示,CT分度、MR分度与D-D、ApoA均呈正相关,见表3。
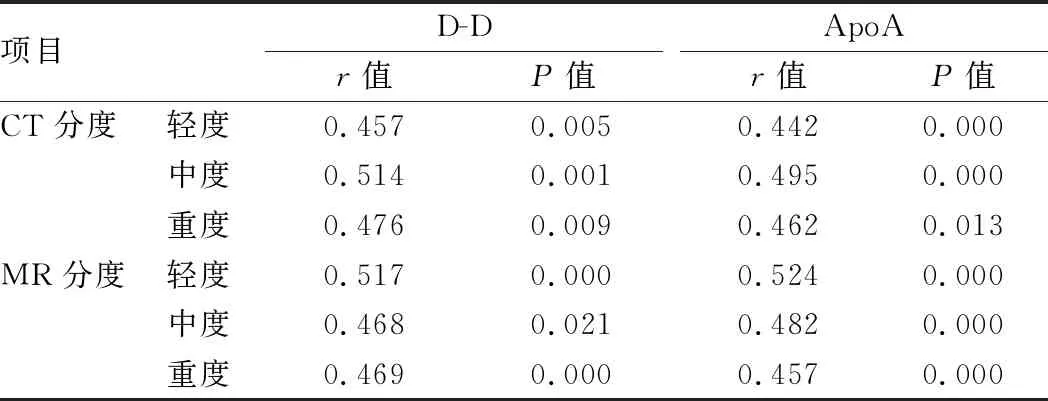
表3 CT及MR分度与D-D、ApoA的相关性分析
3 讨 论
新生儿HIE是新生儿致残和死亡的重要因素,其临床预后主要取决于患儿脑缺血缺氧严重程度,病理改变主要有脑水肿、脑坏死及脑出血等,可使患儿出现不可逆性脑损伤,轻者预后较好,严重者预后会遗留不同程度后遗症甚至死亡,因此,及时、早期、明确地诊断HIE并准确评估患儿病情是改善其预后的关键性措施[8-11]。
临床分度主要依据产科病史,即严重宫内窘迫史、生后新生儿窒息、生后发现神经系统症状及其他相关体征进行诊断和分度,但具有一定主观性[12]。近年来随着影像学技术的发展,目前CT、MR已广泛应用于新生儿HIE的临床诊断中。头颅CT检查可明确HIE的病灶范围及部位,确定是否合并颅内出血及出血部位、出血类型,但对早期HIE的损伤及损伤程度的判断较为困难,且具有一定辐射。MR无辐射,可较准确、敏感评估HIE颅脑损伤的部位、程度及性质,是目前推荐新生儿HIE检查首选成像方法。本研究中,HIE患儿CT、MR主要表现为脑室周围白质密度降低/信号异常,可合并脑叶低密度灶/信号异常、脑室出血、蛛网膜下腔出血、室管膜下出血、脑梗死、脑室周围白质软化等征象,与既往研究报道基本一致[13]。由于脑实质密度与髓鞘发育的情况、水分含量及髓质分化程度相关,随着胎儿胎龄逐渐增大至出生,颅脑髓鞘逐渐形成并发育,而髓鞘的形成与脑实质密度密切相关,髓鞘形成不足时脑实质密度较低[14],此外,HIE因脑组织缺血缺氧导致血管通透性增加,脑组织水肿,脑细胞坏死, CT上表现为密度减低,即病变越重,CT值就会越低,范围也越广泛[15-16],因此CT评价HIE时结合CT值进行判断显得尤为重要。MR对于脑白质损伤具有较好诊断价值,且多模态MR信号分型有助于诊断脑白质损伤病灶的损伤分型,MR波普有助于早产儿HIE的诊断,可为临床提供更多重要的诊断价值信息[17-19]。本研究显示,临床HIE分度(轻度、中度、重度)与CT分度、MR分度比较差异均无统计学意义(P>0.05),提示早产儿HIE的CT、MR分度与临床分度诊断效能基本一致,均可较好地诊断HIE。
D-D是纤溶酶水解交联蛋白形成的特异性降解产物,为血管内皮细胞产生的凝血纤溶标志物,在体内血栓形成和纤溶系统激活中具有较好的评估价值,血浆D-D升高,提示体内高凝状态及血栓的形成[20]。早产儿凝血功能处于不断发展完善成熟阶段,即使检查结果显示某一成分异常时其可能也没有相应的临床表现,可能与早产儿凝血功能不成熟或其为成人参考指标有关[21]。本研究显示,HIE患儿血中D-D水平均比对照组高,且随HIE分度严重程度增加其血D-D水平逐渐增高,提示HIE患儿脑组织缺血缺氧时体内血液重新分布,组织因子暴露,血管内皮细胞受到损伤,内外源性凝血系统被激活,凝血功能亢进,导致血液呈现高凝状态,增加弥散性血管内凝血的可能性,HIE越严重,血中D-D越高,可能与缺血缺氧性脑病脑损伤后脑组织释放组织凝血酶有关,凝血活性升高是导致继发性纤溶活性增高的结果[22]。ApoA为肝脏合成的脂蛋白,是一种急性时相蛋白,对判断是否有炎性反应有重要意义。HIE患儿ApoA和纤溶酶原竞争性结合纤溶酶原受体,并沉积于血管壁,促进血栓形成。本研究中HIE患儿血中ApoA水平均较对照组高,且随HIE分度严重程度增加其ApoA水平逐渐增高,提示HIE越严重时,其存在感染可能性越大,疾病恶化越明显。但HIE患儿ApoA水平升高原因尚不清楚,可能与HIE影响患儿肾功能,而ApoA通过肾脏代谢,因此HIE新生儿肾脏损伤导致对ApoA代谢减少从而使其水平升高有关[23]。D-D和ApoA水平在HIE的诊断、病情评估和指导治疗中具有重要价值。
综上所述,早产儿HIE的CT、MR分度与临床分度诊断效能基本一致,均可较好地诊断HIE,CT、MR分度与D-D、ApoA呈正相关,即随着HIE分度程度的增高,其血清D-D、ApoA水平逐渐增加。
利益冲突:所有作者声明无利益冲突
作者贡献声明
翟丽娜:设计研究方案,实施研究过程,论文撰写;闫丽娟、张晓丽:实施研究过程,资料搜集整理,论文修改;平莉莉:进行统计学分析;翟淑芬:提出研究思路,分析试验数据,论文审核

