SOX 方案化疗辅助胃癌根治术治疗进展期胃癌的临床效果
艾岩,冯盛旺
作者单位:355200 福建省福鼎市医院/福建中医药大学附属福鼎医院肿瘤内科
胃癌作为一种恶性肿瘤,其发病率、病死率均常年位居前三,是导致患者因病死亡的重要原因[1]。胃癌在早期发病较为隐匿,多数患者确诊时已处于疾病的进展期,对进展期的患者直接行手术治疗因肿瘤转移、肿瘤体积过大等因素影响效果不佳,因此临床多采用新辅助化疗+手术治疗的方案进行治疗,以延长患者的生存时间[2]。其中新辅助化疗是一种常见化疗方案,最初用于乳腺恶性肿瘤的治疗中,后来临床发现该方案对胃癌也有一定积极作用,在开展胃癌根治术前以新辅助化疗进行治疗,能有效抑制肿瘤的增殖,控制肿瘤体积,降低肿瘤分期,使肿瘤与周边组织的附着力下降,便于开展手术治疗[3]。SOX、XELOX 作为2 种常见的胃癌化疗方案,药性平和,适合分期较早或进展期、体质较差或年龄较大的患者使用。本研究观察SOX 方案化疗辅助胃癌根治术治疗进展期胃癌的临床效果,报道如下。
1 资料与方法
1.1 临床资料 回顾性分析2015 年3 月-2017 年3 月福建省福鼎市医院收治的进展期胃癌患者65 例的临床资料,按照化疗方案不同分为观察组34 例和对照组31 例。2 组患者性别、年龄、病理类型、病灶位置等临床资料比较差异无统计学意义(P>0.05),具有可比性。见表1。本研究经医院医学伦理委员会核准开展,患者或家属已知晓研究内容并签署知情同意书。

表1 2 组患者临床资料比较
1.2 纳入及排除标准 纳入标准:(1) 病理组织检测结果证实为胃癌,经影像学、临床诊断等确诊属进展期,浸润深度达黏膜下层、肌层、浆膜层及周围组织或器官;(2) 患者在收治后已出现淋巴转移;(3) 入院时未进行任何肿瘤疾病的相关治疗。排除标准:(1) 出现肝、肺、脑等远端转移的患者;(2) 合并消化道出血、胃穿孔、贲门梗阻等患者;(3) 存在化疗禁忌证患者;(4) 合并有其他恶性肿瘤者;(5) 随访期间失联或资料保存不完整者。
1.3 治疗方法 对照组予XELOX 方案化疗:化疗第1 天予注射用奥沙利铂(连云港杰瑞药业有限公司生产,国药准字H20103049)130 mg·m-2·d-1静脉滴注,于2 h 内滴注完成,同时于第1~14 天予卡培他滨片(上海罗氏制药有限公司生产,国药准字H20073023)2 g·m-2·d-1,分2 次口服。
观察组予SOX 方案化疗,化疗第1 天予注射用奥沙利铂,用法用量同对照组;并于第1~14 天予替吉奥胶囊(江苏恒瑞医药股份有限公司生产,国药准字H20113281) 40 mg·m-2·d-1,分2 次口服。
化疗以3 周为1 个疗程,1 个疗程化疗后,停药2~3 周,共化疗3~4 个疗程。结束化疗后,对肿瘤进行MRI、CT 等检测,确认肿瘤的体积大小、浸润情况,以评估患者是否符合胃癌根治术治疗指征,再结合患者身体条件,行择期手术治疗。
1.4 观察指标与疗效评定标准
1.4.1 近期疗效:WHO 对实体瘤的近期疗效评价,其中完全缓解:肿瘤病灶消失;部分缓解:肿瘤的体积较化疗前减少≥50%;稳定:肿瘤的体积减少较化疗前<50%,或肿瘤体积增大较化疗前≤20%;进展:肿瘤的体积增加较化疗前>20%。近期客观缓解率=(完全缓解+部分缓解+稳定)/总例数×100%。
1.4.2 化疗后治疗方案:评估患者身体条件、肿瘤大小、病灶转移等情况,统计化疗后治疗方案选择(胃癌根治术治疗、姑息治疗或其他治疗) 。
1.4.3 不良反应:包括恶心呕吐、骨髓抑制、肝功能异常、神经毒性。参考CTCAE 分级制定不良反应分级标准,其中轻度:症状轻微,仅在检验中可发现,大多无需干预,可自愈;中度:症状较为明显,但不具有致命性,可造成疾病治疗周期延长,需接受局部、较小的干预治疗;重度:症状明显,可具有致命性,需立即接受全方位治疗干预。
1.4.4 随访:进行为期36 个月的随访,记录患者生存情况。
1.5 统计学方法 采用SPSS 22.0 软件对数据进行统计分析。计量资料以表示,组间比较应用t检验;计数资料以频数/率(%) 表示,组间比较应用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 近期疗效比较 治疗3~4 个疗程,观察组患者近期客观缓解率为85.29%,高于对照组的61.29%,差异有统计学意义(χ2=4.838,P=0.028) 。见表2。

表2 2 组患者近期疗效比较 [例(%) ]
2.2 化疗后治疗方案比较 观察组在治疗3~4 个疗程后,符合胃癌根治术治疗指征的患者比例为88.24%,高于对照组的64.52%,差异有统计学意义(χ2=5.139,P=0.023) 。见表3。

表3 2 组患者化疗后治疗方案比较 [例(%) ]
2.3 不良反应比较 观察组肝功能异常、神经毒性不良反应发生率均低于对照组,差异有统计学意义(P<0.05) 。见表4。
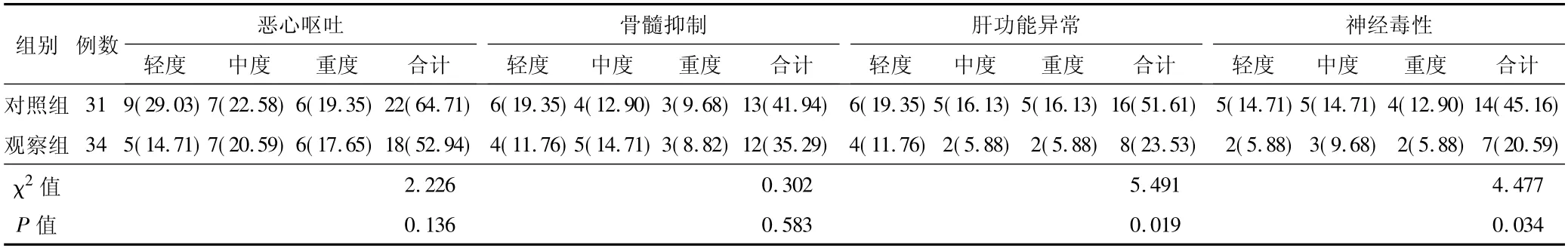
表4 2 组患者不良反应比较 [例(%) ]
2.4 生存时间比较 2 组患者1 年生存率比较差异无统计学意义(P>0.05) ;观察组2 年、3 年生存率均高于对照组,差异有统计学意义(P<0.05) 。见表5。

表5 2 组患者3 年的生存时间比较 [例(%) ]
3 讨论
受国人饮食习惯影响,我国胃癌发病率高,一项统计显示全球近1/2 的胃癌患者在我国[4]。近年来由于胃癌发病率升高的影响,我国胃癌患者的绝对数量明显增加,已成为一项重要的公共卫生安全问题[5]。
对于胃癌的治疗,胃癌根治术是最基础的手术术式,但在淋巴结清扫范围、病灶切除范围等方面还存在一些争议[6]。临床目前普遍认可在手术前进行新辅助化疗可使进展期胃癌患者获益,使其病理分期降低,松动肿瘤,使手术切除难度降低;由于化疗可抑制肿瘤细胞的增殖,对于较小的病灶具有一定清除效果,可提高手术成功率的同时延长患者的生存时间[7-8]。
本研究就SOX 与XELOX 方案的临床效果进行比较,结果显示观察组患者近期客观缓解率为85.29%,高于对照组的61.29%;提示SOX 方案化疗能获得更佳的化疗效果,使肿瘤体积缩小、病理分期降低。同时,观察组符合胃癌根治术治疗指征的患者比例为88.24%,高于对照组的64.52%,提示SOX能获得良好的治疗效果,同时对机体的影响更小,利于开展胃癌根治术治疗。观察组肝功能异常、神经毒性等不良反应发生率均低于对照组,与Takahashi 等[9]报道一致,提示SOX 的化疗使用药物毒性更低,有助于患者降低并发症风险,继而为胃癌根治术的开展创造有利的身体条件。新辅助化疗的方案较多,但仍需不断改进以适应患者的需求,其改进基础是达到良好的抗肿瘤效果,同时也要尽可能减少各类不良反应,保障患者的依从性,使患者身体条件能够满足胃癌根治术的需要[10-11]。SOX 方案对肿瘤的缓解作用与免疫应答相关,在冯道夫等[12]学者的研究中指出经SOX 治疗的患者与未化疗的患者,基因表达差异集中在NK 细胞介导的细胞毒性通路,提示经SOX 治疗差异基因主要高表达于细胞因子相互作用及NK 细胞介导的细胞毒性通路。选择SOX 方案则具有较好的抗肿瘤效果,且对机体的不良影响相对较小。结果还显示,2 组患者1 年生存率比较差异无统计学意义,观察组2 年、3 年生存率均高于对照组,说明采用SOX 方案的患者生存情况更好。而XELOX 方案患者有较多且程度较重的不良反应,对化疗综合效果产生负面影响,甚至可能导致化疗失败。
综上所述,SOX 方案化疗辅助胃癌根治术治疗进展期胃癌的临床效果良好,不良反应小,利于患者后续胃癌根治术治疗的开展,且对患者生存率有积极影响。

