芪明颗粒对糖尿病视网膜病变大鼠炎症反应的改善作用及机制
潘艳杰,张海涛,查俊华,段 柯,刘向玲(.郑州颐和医院眼科,郑州 450000;.河南省人民医院眼科,郑州 450000;.郑州大学第二附属医院眼科,郑州 450000)
糖尿病视网膜病变(DR)是糖尿病(DM)最常见的微血管并发症,也是成人视力丧失的主要原因,严重危害人类的视力健康[1]。通过早期筛查,及早控制血糖,采用药物干预,对于减缓DR发展、维持视力具有积极意义。芪明颗粒(QM)是临床实践中研究出的一种新药,具有益气生津、滋肝养肾、通络明目的功效;主治肝肾不足、气阴两亏、目络瘀滞等症[2-3]。QM采用辨证分型,分期论治,能够减轻视网膜损伤,改善视网膜病变,临床上用于治疗DR,疗效确切[4]。但其具体作用机制研究较少,本研究通过观察其对DR大鼠炎症的改善作用探讨其可能的机制,为临床应用该药治疗DR提供实验依据。
1 仪器、材料与方法
1.1仪器与材料
1.1.1仪器 YZ5E裂隙灯和手持检眼镜,均购自苏州六六视觉科技股份有限公司;One touch血糖仪和血糖试纸,均购自美国强生Lifescan公司;Mini-Protean4电泳仪,购自美国BioRad公司。
1.1.2试药 链脲佐菌素(STZ,美国Sigma公司);芪明颗粒(国药准字Z20090036,浙江万晟药业有限公司,规格:4.5 g×15袋);大鼠白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和C反应蛋白(CRP)酶联免疫吸附(ELISA)检测试剂盒,均购自武汉伊莱瑞特生物科技股份有限公司;多聚甲醛、二甲苯和乙醇,均购自上海阿拉丁生化科技股份有限公司;戊巴比妥钠(上海紫一试剂厂);电化学发光(ECL)试剂盒[翌圣生物科技(上海)股份有限公司];三羟甲基氨基甲烷盐酸盐缓冲盐溶液(TBS,上海源叶生物科技有限公司);二喹啉甲酸(BCA,蛋白检测试剂盒购自上海酶联生物科技有限公司);兔抗大鼠高迁移率族蛋白1(HMGB-1)多抗(美国Cell Signaling Technology公司);兔抗大鼠Toll样受体4(TLR4)多抗、核转录因子κB(NF-κB)多抗、B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)单克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)和末端脱氧核糖核苷酸转移酶介导的缺口末端标记法(TUNEL)凋亡试剂盒,均购自美国Abcam公司。
1.1.3实验动物 SPF级SD大鼠55只,雄性,8周龄,体质量为(200±20) g,由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2016-0006。购入后保持相对湿度为60%±10%,温度为(23±1) ℃,适应性饲养7 d。
1.2方法
1.2.1建模、分组及干预 取100 mg STZ,用0.1 mol·L-1柠檬酸钠溶解,4 ℃保存备用。随机取45只大鼠,禁食不禁水12 h后,采用一次腹腔注射STZ溶液(60 mg·kg-1)诱导DM模型,72 h后,尾静脉测血糖,以血糖值≥16.7 mmol·L-1为建模成功,继续饲喂12周,每周测量大鼠血糖值,考察血糖稳定性。将40只成模DM大鼠随机分为DR组、QM低剂量组、QM高剂量组和阳性对照组,每组10只。按照人与大鼠体表面积折算给药剂量,QM低剂量组和QM高剂量组分别按1.2、2.4 g·kg-1灌胃QM,阳性对照组按照40 mg·kg-1灌胃辛伐他汀,DR组灌胃等体积生理盐水。剩余10只大鼠作为对照组,灌胃等体积生理盐水。所有大鼠干预频次:每日1次,连续6周。
1.2.2检测血清炎症因子水平 末次给药后12 h,腹腔注射戊巴比妥钠(40 mg·kg-1)麻醉大鼠,腹腔静脉采血5 mL,以3 000 r·min-1离心10 min,离心半径为10 cm,取上清,采用ELISA法测定血清中IL-6、TNF-α和CRP水平,经包被、洗涤、封闭、加样、显色和终止反应后,在450 nm波长处用酶标仪测定吸光度值A,根据标准曲线测定样品中IL-6、TNF-α和CRP水平。
1.2.3HE染色观察视网膜病变 采血完毕后处死大鼠,摘取双侧眼球,分离左侧视网膜,于体积分数为4%的多聚甲醛中固定24 h,采用梯度酒精脱水,二甲苯透明,浸蜡、包埋,切片机连续切片,片厚约3 μm,常规HE染色后,滴加中性树胶,盖上盖玻片,镜检。
1.2.4TUNEL法检测细胞凋亡 取视网膜切片,常规脱蜡,用酒精水化,用体积分数为3%的过氧化氢封闭5 min,磷酸盐缓冲液(PBS)冲洗,脱氧核糖核苷酸末端转移酶(TdT)缓冲液湿盒37 ℃反应60 min,抗地高辛抗体湿盒反应30 min,免疫组织化学(SABC)法染色,二氨基联苯胺(DAB)显色,苏木素复染,脱水、透明后进行封片。镜下观察计数视网膜神经节细胞(RGCs)凋亡数,每张切片随机选取5个视野,计算凋亡指数。凋亡指数=凋亡细胞数÷细胞总数×100%。
1.2.5Wetern Blot检测视网膜蛋白表达 分离右侧视网膜,保存于液氮中。取视网膜80 mg,加入裂解液,离心取上清,BCA法测定样品中蛋白含量,加入5倍上样缓冲液,沸水煮5 min使蛋白变性失活,进行SDS-PAGE电泳,蛋白转移至PVDF膜,用5%脱脂奶粉室温封闭2 h,加入一抗,稀释比例:Bcl-2(1∶500)、Bax(1∶500)、HMGB1(1∶1 000)、TLR4(1∶1 000)、NF-κB(1∶1 000),4 ℃摇床孵育过夜,TBS溶液洗膜3次,加入HRP标记的相应二抗(1∶2 000),室温孵育2 h,TBS溶液洗膜3次,加入ECL发光液,曝光、显影,分析数据,比较各条带灰度值,计算目的蛋白相对表达水平,以目的条带灰度值/内参条带灰度值表示。

2 结果
2.1治疗前后血糖比较 与对照组比较,DR组、QM低剂量组、QM高剂量组和阳性对照组治疗前、治疗后血糖水平均升高(P<0.05);与DR组比较,QM低剂量组、QM高剂量组和阳性对照组治疗后血糖水平降低(P<0.05);与QM低剂量组比较,QM高剂量组和阳性对照组治疗后血糖水平降低(P<0.05)。DR组、QM低剂量组、QM高剂量组和阳性对照组治疗前血糖水平比较,差异无统计学意义(P>0.05);QM高剂量组和阳性对照组治疗后血糖水平比较,差异无统计学意义(P>0.05)。见表1。
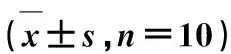
表1 血糖水平比较Tab.1 Comparison of blood sugar levels
2.2血清IL-6、TNF-α和CRP水平比较 与对照组比较,DR组、QM低剂量组、QM高剂量组和阳性对照组血清IL-6、TNF-α和CRP水平均升高(P<0.05);与DR组比较,QM低剂量组、QM高剂量组和阳性对照组血清IL-6、TNF-α和CRP水平均降低(P<0.05);与QM低剂量组比较,QM高剂量组和阳性对照组血清IL-6、TNF-α和CRP水平均降低(P<0.05);QM高剂量组和阳性对照组血清IL-6、TNF-α和CRP水平比较差异无统计学意义(P<0.05)。见表2。
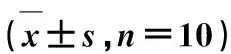
表2 血清IL-6、TNF-α和CRP水平比较Tab.2 Comparison of serum IL-6,TNF-α and CRP levels
2.3HE染色观察视网膜病理学变化 对照组视网膜结构完整,分层清楚,各层细胞排列紧密,RGCs数量较多,形状规则,排列整齐;DR组视网膜结构破坏,RGCs数量减少,部分细胞可见空泡样变性,出现异形细胞,内核层、外核层细胞排列紊乱,数量减少;QM各剂量组及阳性对照组视网膜结构较DR组有所改善,各层细胞排列较规则,RGCs异形细胞减少,内核层和外核层细胞排列较规则,数量较多,其中QM高剂量组和阳性对照组改善效果明显。见图1。
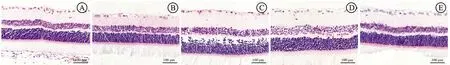
图1 视网膜病理学变化注:A.对照组;B.DR组;C.QM低剂量组;D.QM高剂量组;E.阳性对照组;HE×400。Fig.1 Pathological changes of the retinaNotes:A.control group;B.DR group;C.QM low-dose group;D.QM high-dose group;E.positive control group;HE×400.
2.4RGCs凋亡指数比较 对照组、DR组、QM低剂量组、QM高剂量组和阳性对照组RGCs凋亡指数分别为3.24%±0.75%、22.56%±1.52%、11.27%±1.14%、7.67%±1.07%、7.16%±1.18%。与对照组比较,DR组、QM低剂量组、QM高剂量组和阳性对照组凋亡指数均升高(P<0.05);与DR组比较,QM低剂量组、QM高剂量组和阳性对照组凋亡指数均降低(P<0.05);与QM低剂量组比较,QM高剂量组和阳性对照组凋亡指数均降低(P<0.05);QM高剂量组和阳性对照组凋亡指数比较,差异无统计学意义(P>0.05)。见图2。
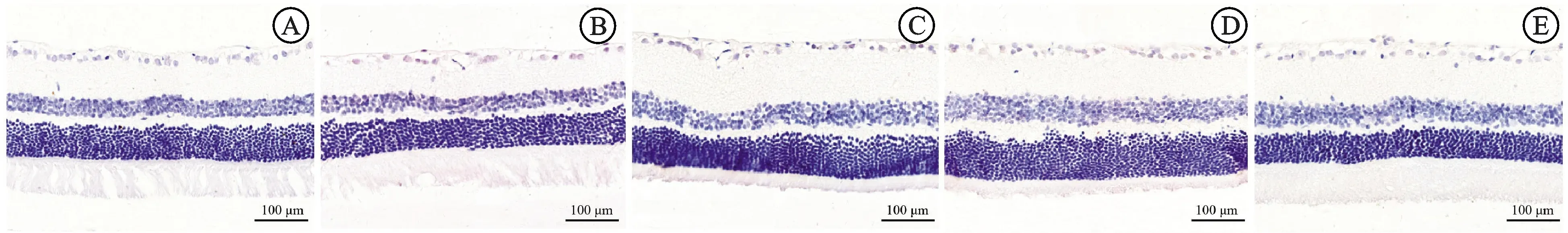
图2 RGCs凋亡情况注:A.对照组;B.DR组;C.QM低剂量组;D.QM高剂量组;E.阳性对照组;TUNEL×400。Fig.2 Apoptosis of RGCsNotes:A.control group;B.DR group;C.QM low-dose group;D.QM high-dose group;E.positive control group;TUNEL×400.
2.5视网膜中凋亡相关蛋白水平比较 与对照组比较,DR组、QM低剂量组、QM高剂量组和阳性对照组视网膜中Bcl-2蛋白表达和Bcl-2/Bax均降低,Bax蛋白表达升高(P<0.05);与DR组比较,QM低剂量组、QM高剂量组和阳性对照组视网膜中Bcl-2蛋白表达和Bcl-2/Bax升高,Bax蛋白表达降低(P<0.05);与QM低剂量组比较,QM高剂量组和阳性对照组视网膜中Bcl-2蛋白表达和Bcl-2/Bax升高,Bax蛋白表达降低(P<0.05);QM高剂量组和阳性对照组视网膜中Bcl-2、Bax和Bcl-2/Bax比较,差异无统计学意义(P>0.05)。见表3和图3。
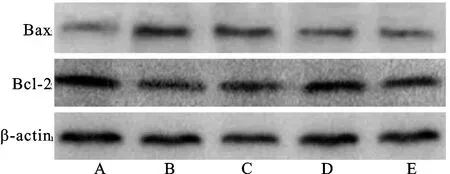
图3 视网膜中Bcl-2、Bax蛋白表达注:A.对照组;B.DR组;C.QM低剂量组;D.QM高剂量组;E.阳性对照组。Fig.3 Bcl-2 and Bax protein expression in the retinaNotes:A.control group;B.DR group;C.QM low-dose group;D.QM high-dose group;E.positive control group.
表3 视网膜中Bcl-2、Bax、Bcl-2/Bax水平比较Tab.3 Comparison of Bcl-2,Bax,Bcl-2/Bax levels in the retina n=10)
2.6视网膜中HMGB1/TLR4/NF-κB通路相关蛋白水平比较 与对照组比较,DR组、QM低剂量组、QM高剂量组和阳性对照组视网膜中HMGB1、TLR4和NF-κB蛋白表达升高(P<0.05);与DR组比较,QM低剂量组、QM高剂量组和阳性对照组视网膜中HMGB1、TLR4、NF-κB蛋白表达降低(P<0.05);与QM低剂量组比较,QM高剂量组和阳性对照组视网膜中HMGB1、TLR4和NF-κB蛋白表达均降低(P<0.05);QM高剂量组和阳性对照组视网膜中HMGB1、TLR4和NF-κB蛋白表达比较,差异无统计学意义(P>0.05)。见表4和图4。
表4 视网膜中HMGB1、TLR4和NF-κB水平比较Tab.4 Comparison of HMGB1,TLR4 and NF-κB levels in the retina
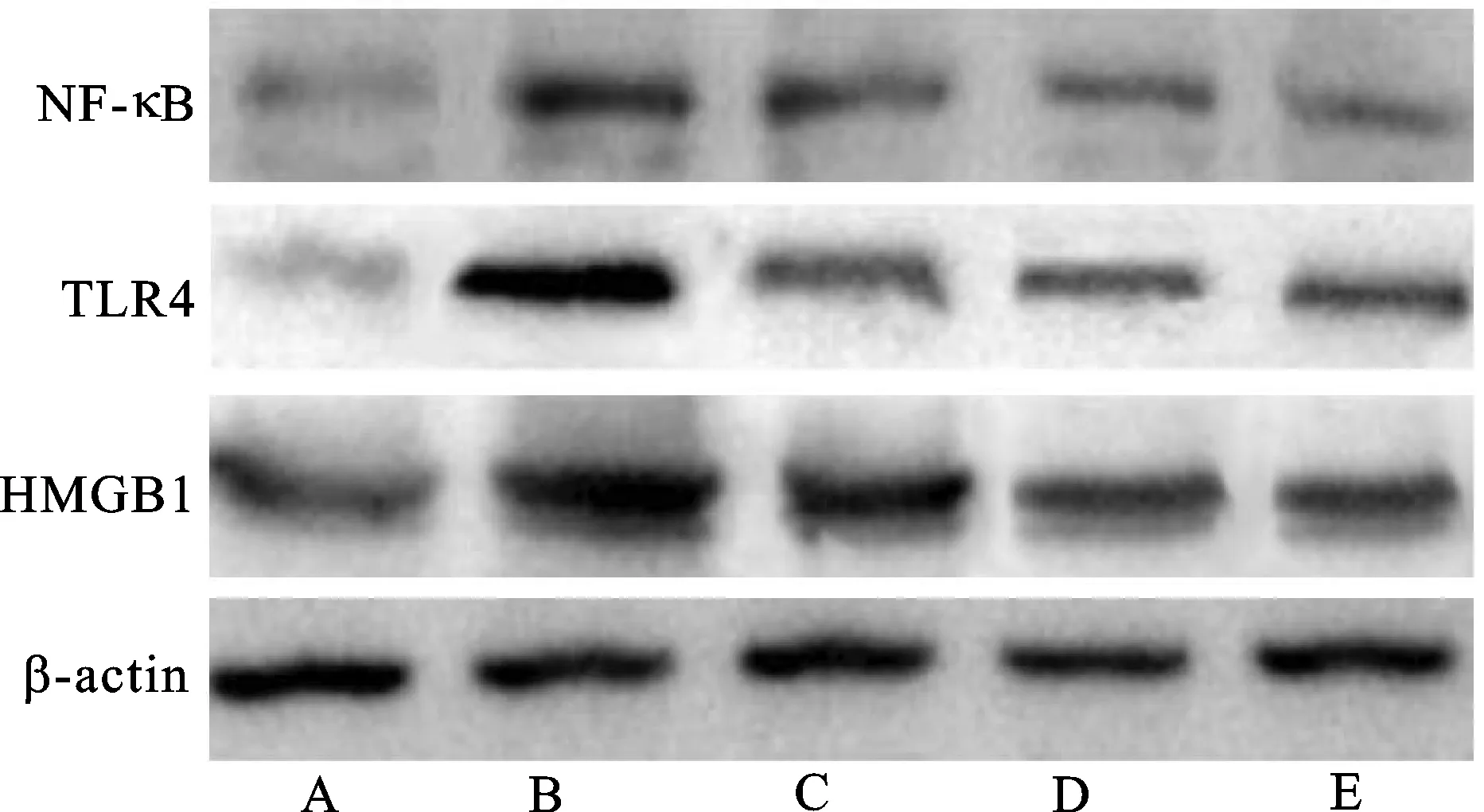
图4 视网膜中HMGB1、TLR4、NF-κB蛋白表达注:A.对照组;B.DR组;C.QM低剂量组;D.QM高剂量组;E.阳性对照组。Fig.4 HMGB1,TLR4 and NF-κB protein expression in the retinaNotes:A.control group;B.DR group;C.QM low-dose group;D.QM high-dose group;E.positive control group.
3 讨论
DR的主要病理学变化表现为RGCs凋亡、视网膜神经功能障碍和新生血管生成等[5-6]。发生DM后,血糖控制不佳,视网膜血流动力学发生改变,导致视网膜局部缺氧,IL-6、TNF-α和CRP表达增加,引起血管内皮生长因子表达,进而导致炎症反应,炎性细胞大量浸润,视网膜结构和功能遭到破坏,最终形成DR[7-8]。DR的发生、发展与炎症密切相关,大量抗炎治疗实验结果表明,降低炎症反应能有效抑制DR发展[9-11]。
单纯控制血糖不能完全阻止DR发展,需要通过药物治疗。中医认为,DM属于“消渴病”范畴,因消渴引起眼部功能改变,导致视力降低甚至丧失,证见头晕耳鸣、目睛干涩和视物昏花等[12]。DR的基本病机为气阴两虚、肝肾不足,因虚致淤导致目络阻滞,治疗该病应补气生津、滋养肝肾,标本兼治[13-14]。QM是临床实践研制的一种新药,由黄芪、葛根、地黄、枸杞、决明子、茺蔚子、蒲黄和水蛭8种中药制成,有滋肝养肾、益气活血作用。黄芪益气升阳、活血化瘀,葛根生津止渴、清热凉血,二者合用益气生津,补而不滞,共为君药。地黄滋阴养血,枸杞补肝明目,为臣药,辅助君药益气养阴。决明子明目助眠,茺蔚子活血补阴,蒲黄通淋化瘀,水蛭破血逐淤,诸药合用,共奏活血止血、祛瘀生新、清热明目之功效。李云等[15]研究表明,QM联合百令胶囊用于早期慢性肾脏病,可抑制炎症反应,改善肾功能。王军媛等[16]研究显示,QM治疗糖尿病肾病早期患者,炎症因子水平及尿蛋白明显低于对照组,疗效确切。本研究采用QM治疗DR大鼠,血糖水平及IL-6、TNF-α和CRP等炎症因子水平明显降低,RGCs细胞凋亡减少,视网膜结构有所改善,且QM高剂量组与阳性药物效果相当,提示QM治疗DR大鼠能减少炎症反应,保护视网膜结构和功能。
HMGB1是炎症反应的重要介质,当机体受到创伤或应激等刺激时,诱导机体产生HMGB1,募集活化免疫细胞,激活机体免疫系统[17]。HMGB1可作为TLR4的内源性配体,释放到胞外后通过与TLR4结合,激活下游NF-κB,诱导炎症反应。临床研究显示,HMGB1/TLR4/NF-κB通路在糖尿病肾病患者中高表达,其释放的炎症因子能够促进级联炎症反应,进一步加重糖尿病视网膜病变[18-19]。实验性脑外伤大鼠中,小胶质细胞激活诱导的炎症反应可通过阻滞HMGB1/TLR4/NF-κB信号通路得到抑制[20]。另外,有研究证实,HMGB1在多种疾病中表达显著升高,本研究中,DR组HMGB1、TLR4和NF-κB表达较对照组明显升高,提示HMGB1/TLR4/NF-κB信号通路参与DR的发生、发展,经QM治疗后,Bcl-2表达及Bcl-2/Bax升高,Bax表达降低,HMGB1、TLR4和NF-κB表达降低,且QM高剂量组与阳性对照组效果相当,提示QM可能通过抑制HMGB1/TLR4/NF-κB信号通路,减轻炎症反应,减少RGCs凋亡,保护视网膜。
综上所述,QM可改善DR大鼠的炎症反应,减少RGCs凋亡,可能是通过抑制HMGB1/TLR4/NF-κB信号通路发挥抗炎作用,为临床治疗DR奠定了基础。

