水杨梅根乙酸乙酯提取物对人肝癌Bel7402细胞凋亡及增殖的影响
王成功,马春月,张瑜,韩宇,李思佳,杨旭东
(牡丹江医学院,黑龙江 牡丹江 157011)
0 引言
中药水杨梅(Adina rubella Hance)属于茜草科水团花属,具有清热利湿、解毒消肿的作用。已有研究表明,水杨梅具有抗氧化、抗病毒、抗肿瘤等生物学功能[1-4],但未见其抗肝癌作用的报告。本实验观察水杨梅根乙酸乙酯提取物(Ethyl acetate extraction from the root of Adina rubella Hance,EARH)对人肝癌Bel7402细胞体外抑制作用,为进一步开发其抑癌成分及作用提供实验依据。
1 材料与方法
1.1 研究材料
水杨梅全草(牡丹江大药房),由牡丹江医学院药物研究中心鉴定;人肝癌Bel7402细胞株(武汉中美科技有限公司);MTT试剂(Sigma公司),胰蛋白酶(上海生工);胎牛血清(Gibco公司);DOMO(Sigma公司);Hoechst33258(碧云天生物技术有限公司);DEME培养基(Hyclone公司);引物核苷酸片段(上海生工)。
1.2 主要仪器
PCR仪(德国,Biometra);荧光显微镜(日本,OLYMPUS);CO2培养箱(日本,SANYO);凝胶成像仪(美国,BIO-RAD)。
2 实验方法
2.1 EARH的制备
称取水杨梅根粉末1kg,用60%乙醇回流提取,提取2次,将提取液合并,离心,取上清,减压挥发乙醇,加入适量乙酸乙酯萃取,减压浓缩干燥得到2.3g EARH。
2.2 细胞培养与分组
在37℃条件下,5%+CO2,Bel7402细胞培养于10%胎牛血清的DEME培养基中。将对数生长期细胞分为4组,实验组:用培养液倍比稀释的1、2和4mg/mL的EARH。对照组:含人肝癌Bel7402的DEME培养液。
2.3 MTT实验
取处于对数生长期Bel7402细胞,将细胞悬液密度调整为1×104个/mL接种于96孔板,每孔接种100μL。按照2.2分别加入相应剂量的EARH,每个剂量设12个平行孔,分别培养12、24和48h后,每孔加入5g/L的MTT溶液20μL,孵育4h后,吸弃培养液,向每孔中加入DMSO 150μL。酶标仪于波长490nm处,测定吸光度值(OD值),将测得的OD值代入公式计算细胞生长抑制率(inhibition rate,IR)。IR=(对照组OD-实验组OD)/(对照组OD-空白组OD)×100%。
2.4 Hoechst33258染色实验检测细胞凋亡率
取指数生长期的Bel7402细胞,胰蛋白酶消化后收集Bel7402细胞,用10%胎牛血清的培养液将细胞悬液密度调整为3×105个/mL,将细胞接种于6孔板中,每孔1mL。细胞于37℃、5%+CO2培养箱中孵育24h后,实验组加入不同浓度的EARH;对照组加相同体积的DEME培养液。细胞培养48 h后,离心收集细胞。检测细胞凋亡时,0.5mL固定液甲醇-冰醋酸(3:1),4℃条件下固定,10min后弃固定液,PBS洗2遍,Hoechst33258染色15min,取出盖玻片盖在已滴好抗荧光淬灭剂的载玻片上,荧光显微镜下观察细胞形态并计算细胞凋亡率。
2.5 RT-PCR测定survivin、p53表达
Trizol法提取Bel7402细胞总RNA,逆转录为cDNA。RT-PCR引物序列见表1,以β-actin作为内参照。PCR反应程序:95℃预变性50s,95℃变性20s,60℃复性30s,72℃延伸60s,共35个循环。琼脂糖凝胶电泳后,凝胶成像系统分析计算survivin/β-actin和p53/β-actin的灰度比值作相对定量。

表1 RT-PCR实验的引物序列
2.6 统计学分析
3 结果
3.1 EARH对Bel7402细胞增殖的抑制作用
经1、2和4mg/mL的EARH分别处理12、24和48h后,EARH对Bel7402细胞增殖起到一定的抑制作用;MTT实验发现,随着药物的浓度增加和作用时间的延长,2和4mg/mL对Bel7402细胞增殖抑制作用显著增强(P<0.01)(见表2)。由此表明,EARH具有抑制Bel7402细胞的增殖的作用。
3.2 EARH诱导Bel7402细胞凋亡情况
Hoechst33258染色实验结果显示:加入不同浓度EARH培养细胞48 h后,EARH各剂量组出现蓝色深染细胞核碎裂的凋亡细胞。对照组、1、2、4mg/mL EARH组细胞凋亡率分别为2.67%,7.29%,13.82%、16.83%。与对照组比较,EARH各剂量组细胞凋亡率显著提高,比较有显著性差异(P<0.01)(见图1、2)。
表2 EARH对Bel7402细胞增殖的影响(±s,n=6)
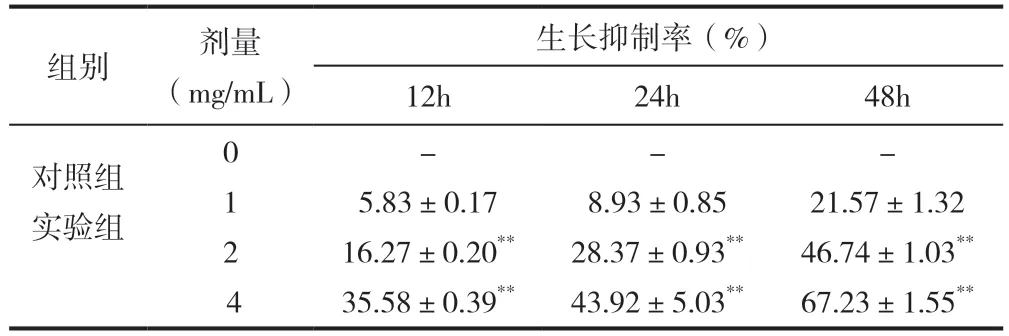
表2 EARH对Bel7402细胞增殖的影响(±s,n=6)
注:与1mg/mL EARH组比较,**P<0.01。
3.3 EARH对Bel7402细胞中survivin和p53基因表达影响
与对照组比较,EARH作用于Bel7402细胞48h后,各剂量EARH组细胞survivin基因表达均显著降低,(P<0.01,P<0.05);与对照组比较,EARH作用于Bel7402细胞48h后,各剂量EARH组细胞p53基因表达均显著升高(P<0.01,P<0.05),见表3。
表3 EARH对Bel7402细胞survivin和p53表达影响(±s,n=6)
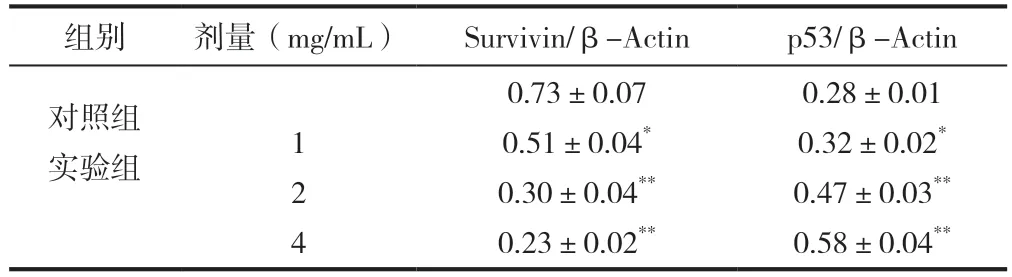
表3 EARH对Bel7402细胞survivin和p53表达影响(±s,n=6)
注:与对照组比较,**P<0.01,*P<0.05
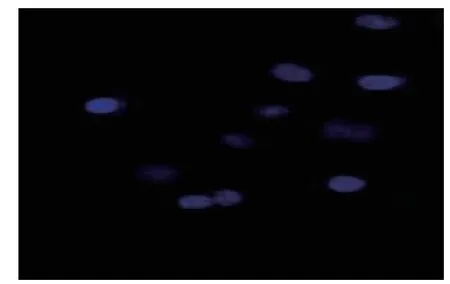
图1 对照组(400×)
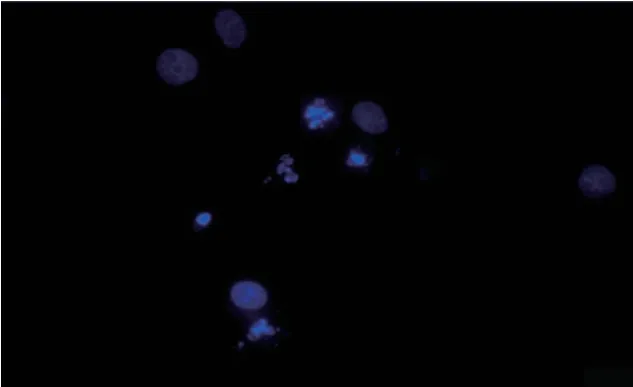
图2 4 mg/mL EARH各剂量组组(400×)
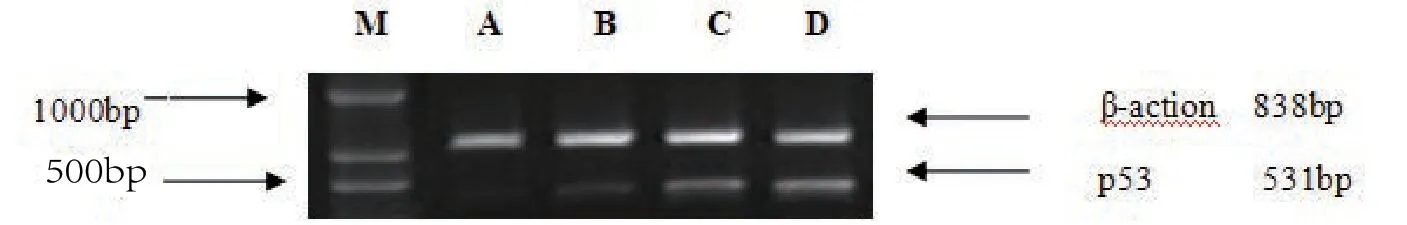
图3 各组细胞p53基因表达
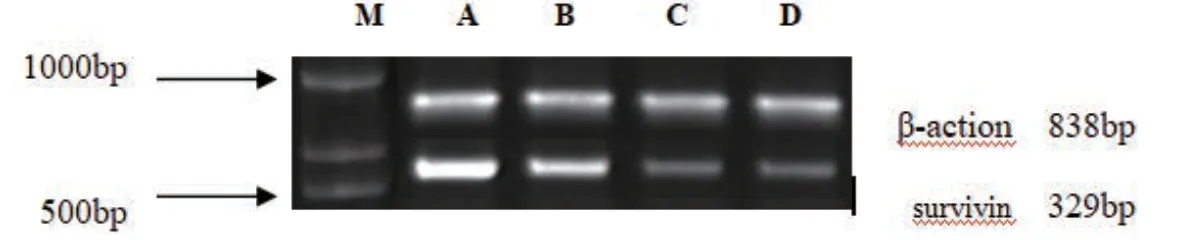
图4 各组细胞survivin基因表达
4 讨论
原发性肝癌是临床上常见的恶性肿瘤之一[5],治疗难度较大,其死亡率仅次于肺癌、胃癌及食管癌,严重威胁人类健康[6]。细胞凋亡是指基因精密控制的细胞自主的有序的死亡,又称为程序性细胞死亡(Programed cell death,PCD)。细胞凋亡的异常与许多疾病的发生发展密切相关,凋亡细胞的减少及细胞的过度增殖在肝癌发生发展过程中起到重要的作用。因此,本实验研究,EARH对Bel7402细胞是否具有抑制细胞凋亡的作用。
Survivin是凋亡抑制蛋白 (inhibitor of apoptosis protein,IAP)家族中重要的一员,表达于胚胎、成人的胸腺、生殖腺及肿瘤中。Survivin具有促进肿瘤细胞的过度增殖、调控细胞周期、促进细胞转化并且抑制细胞凋亡等作用[7-8],是目前发现细胞凋亡的最强抑制因子。通过与蛋白酶caspase-3、caspase-7结合抑制其活性,从而抑制细胞凋亡[9],是肿瘤治疗的重要靶基因。已有研究证实,肝癌患者肝脏中survivin呈现高表达,并与其病理及预后密切相关[10]。本研究显示,EARH可抑制Bel7402细胞中survivin基因表达,促进Bel7402细胞凋亡,浓度越大,作用越显著。p53基因是人体重要的抑癌基因,广泛存在于机体细胞核中,编码生成的p53蛋白由四条氨基酸链构成,活化的p53蛋白作为转录因子可结合靶基因上,进一步增加bax、fas等基因的表达,降低bcl-2、cdc25A等基因表达[11],阻滞细胞周期进程,抑制细胞生长,促进细胞凋亡的作用,从而抑制肿瘤的生长[12],是控制肿瘤细胞存活的关键[13]。
综上所述,EARH对肝癌Bel7402细胞增殖具有抑制作用,4mg/mL EARH组抑制作用最显著,其作用机制可能是通过降低survivin基因表达,上调p53基因表达,抑制癌Bel7402细胞增殖并促进凋亡,为EARH治疗肝癌的进一步开发提供了实验依据。

