“以患者为中心”在医疗器械研发中的价值和应用
尹立强 赵杨升 马伟
1 山东大学公共卫生学院 (山东 济南 250012)
2 烟台正海生物科技股份有限公司 (山东 烟台 264006)
内容提要: 从“以患者为中心”的角度,结合国内医疗器械产业的基本现状、研发存在的问题等背景,介绍了“以患者为中心”的基本理念,从行业实践者的角度,对在研发活动中引入“以患者为中心”的重要性及如何践行进行了陈述。为医疗器械领域尽快引入“以患者为中心”的理念和实践性的纲领文件提供参考。
医疗器械是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件[1]。医疗器械产业近年来发展迅速,2019年行业产值已经突破6000亿元,仍保持15%的年增速。药政当局也不断鼓励创新和研发,以近5年的创新医疗器械为例,已有近200款产品进入创新医疗器械通道[2]。但客观来说,我国的医疗器械产业和欧美发达国家尚存较大差距,仍面临不少问题[3]。
具有真正临床价值的医疗器械研发,是医疗器械产业发展的最核心要素。在医疗行业的价值体系已经在向“以患者为中心”转变的当下,国内医疗器械研发活动中却并没有明确的“以患者为中心”的理念植入和成熟实践,甚至连基本的理论研究文献也未见。各医疗器械厂商对医疗器械的研发工作同样缺乏这种认知。
“以患者为中心”并非空洞的口号,而是将会成为医疗器械研发活动中重要的价值导向和行动纲领,会为我国医疗器械的研发升级带来深远的影响,需要药政当局和产业界不断实践形成共识。本文将从“以患者为中心”这个角度,论述基本概念、价值,总结其如何在医疗器械的研发活动中操作并发挥作用。
1.“以患者为中心”的理解
1.1 医疗界
“以患者为中心”的理解和实践在医疗界广被提及。随着现代医学模式的发展,医学治疗已经从“以疾病为中心”向“以患者为中心”转变[4]。正如国际顶级医疗卫生机构认证委员会JCI对医院所作出的考核指标:医院及全体医护人员要将患者的病情、患者的心理感受、患者的(财政)承受能力、患者家属的要求等因素综合在一起,为患者带来最佳医疗解决方案。
1.2 制药界
“以患者为中心”其基本含义是所有的药品研发开发应该紧密围绕患者,考虑患者的需求甚至建立患者为中心的决策体系。一些制药领域头部企业如阿斯利康、武田制药等,已经将这一理念贯穿在其整个运营活动中。
1.3 药政监管领域
美国食品药品监督管理局(FDA)提出了以患者为中心的药物开发(Patient-Focused Drug Development: Methods to Identify What Is Important to Patients Guidance for Industry,Food and Drug Administration Staff,and Other Stakeholders,PFDD)思路,并发布了相关指南旨在将患者的需求引入到监管流程领域,以便更好地服务于患者。FDA在监管层面起到了引路的作用。
医疗器械和药物的本质一样都是服务患者的,其底层逻辑是相同的。医疗器械研发领域以患者为中心,也应加快理念输入和践行。呼吁监管层面、研发活动过程均应发布相关纲领性文件和推动落地实践。
2.国内医疗器械研发存在的问题
2.1 表象问题遮盖本质
当前,国内医疗器械行业的很多企业规模小、研发投入占比低,仿制为主、创新较少。同时在研发的人员要素上,研发团队的管理也面临诸多挑战[5]。这些问题表面上看是发展阶段的问题,但深层次却是研发意识和理念的问题,与本文提到的“以患者为中心”的缺失关系巨大。规模小并不等于不能创新、可忽视患者真正需求,也不同等于产品品质低。
2.2 形式研发居多
医疗器械的研发目前已经有较为成熟的设计开发(文件)要求可以参考,这些文件概述了医疗器械产品实现的要求[6,7]。国内药政当局的法规文件中,也明确指出了产品设计开发应该建立的工作体系[8]。很多公司根据这些指导性文件,制定了内部的设计开发程序文件并号称制度完善。各公司大致能够做出产品且都声称捕捉到了需求,做出了客户需要的产品。但实际众多的产品却是重复性的、形似的低水平模仿,离真正解决临床患者的需求有较远距离。
从文件、职能和审评问题等方面就能够窥得一些线索,会发现大家仅仅是机械化地应对文件要求,并没有真正的为患者的需求而研发。比如,有的企业缺乏真正的职能认知,生产质量部门承担着设计开发程序制定的职能,研发部门反而成为局外人;有的研发部门闭门造车,没有能够洞察患者需求的专业人员;有的公司错把销售部门当成需求方。又如,不少企业错把法规要求的工作当成研发的全部,所有的产品研究是否推进都要去看法规是否要求。国家医疗器械技术审评中心(CMDE)的审评员常常抱怨很多企业把技术要求当产品性能研究的全部,正是这个问题。
医疗器械研发的一些研究聚焦在研发活动文件体系的完善,技术的改进等方面,却未见谈及以患者为中心这一研发的内核的研究。
3.以患者为中心在医疗器械研发中的价值和应用
除了呼吁尽快在医疗器械研发领域引入“以患者为中心”理念,也有必要从实践角度了解以患者为中心的产品开发是如何操作的。美国FDA在药物领域以患者为中心的思路,可以为医疗器械提供一些思路参考;从实践层面,本文也对医疗器械的以患者为中心如何开展做一些说明,从而为行业带来启发,期待行业能够出现纲领性的文件指引。
3.1 以患者为中心的药物开发思路启示
美国FDA发布的以患者为中心的药物开发(PFDD)是一种系统性方法,可用于捕获患者的经验、观点、需求和优先事项,并将其纳入药物开发和评估中[9]。FDA当局主要开发了几项指导性文件,包括了:收集全面的代表性意见、确定对患者产生重要影响的信息;选择、开发或修改用于开发目的的临床结局评估、将临床结局评估纳入监管决策的终点。FDA正在致力于推动这些举措,使得产品研发可以最大化的尊重患者的意愿,保证患者利益最大化。国内也已经有相似的实践,如“慢性阻塞性肺疾病患者结局报告”[10]。
3.2 以患者为中心在医疗器械研发全程的实践介绍
虽然药物领域已经有了初步的纲领文件和探索,但是医疗器械与药物无论是在发挥作用的机制还是应用的方式上,都存在较大区别。比如医疗器械更加依赖医生的操作,这使“以患者为中心”在医疗器械的实践与药物是不完全相同的,但底层基本逻辑相似。
3.2.1 识别精准患者及需求
如上述,医疗器械的使用比药物更加依赖专业的医疗人士,使得很多研发活动仅关注医疗专业人士,而忽略患者,这显然是不恰当的。比如在耳鼻喉治疗领域鼻腔术后填塞材料的选择上,医疗专业人士能够接受更便宜但舒适度偏差的不可降解产品;而对于生活条件较好的患者群体,取出高分子填塞物时的巨大疼痛使其更愿接受偏贵的可降解产品填塞。因此,需要在医疗器械概念研发期同样引入患者的需求分析。图1提供了一种思路和流程参考。
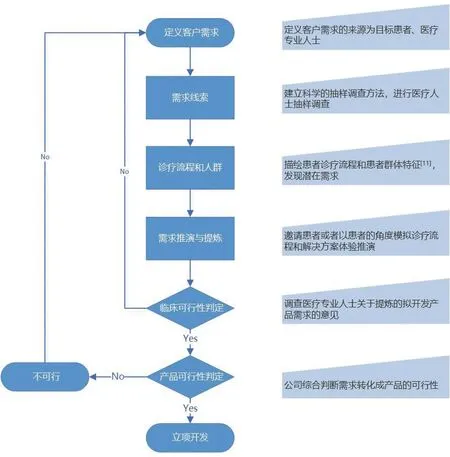
图1. 患者识别和患者需求分析路线表
图1仅仅是提炼了一种思路路线图,这背后需要投入大量的研发精力和资源。比如要有患者才是真正需求端的意识和制度保障;要有能识别需求的专业团队和科学方法,尤其是对患者诊疗全程理解后的需求洞察能力。没有一款产品是适合所有患者的,产品与目标患者群体的精准匹配可以获得最佳的疗效结果,这就是最有价值的患者服务。如果研发理念缺乏患者为中心,不建立相关的工作流程,往往会变成纸面上和口号里的需求分析,医疗器械即使能够上市也会被淘汰,造成极大的资源浪费。
以上仅仅是需求的提炼和开发目标的确定阶段。从某种意义上,企业真正的理解和描绘患者、诊疗,成为了“以患者为中心”的第一步。这是企业研发时特别应该注意的工作。
3.2.2 以患者为中心的产品性能研究
当企业进入产品早期研发阶段,是否能“以患者为中心”成了产品研究水平高低、是否对产品性能真正吃透的本质影响力量。完全仿制的医疗器械产品还可以借鉴已上市产品的性能参数,参考国行标去推进研发。但较新的产品却往往需要企业投入资源和精力去摸索产品的各项性能参数及做大量的研究验证。国家医疗器械审评中心常常要面临来自企业的疑问:产品没有指导原则、某些检项无成熟方法、不清楚是否做降解试验、有些试验投入太多。
投入当然很重要,但绝不能牺牲患者利益或遗留当前认知下本可以规避的风险,而将产品推向应用。如能“以患者为中心”,有些问题就不再是问题。以治疗腹股沟或腹壁疝的疝补片为例,可吸收补片很大的一个应用风险是疝复发。已有的离体研究虽能表明产品的一些安全风险得到了控制,但组织的粘连情况却无法用离体试验去验证,而这恰是产品的关键研究。很多企业把医疗产品当成了冷冰冰的普通商品,偏离了医疗器械研发的本质。企业开发的产品一定要安全可靠,患者获益才是最终目标。相信基于这个目标,很多性能研究就不会能省则省,硬凑法规。研发要以科学为武器,患者为中心为理念,才能真正的研发出好产品。
当然,药政当局也绝不是研究越多越好的导向,他们的政策背后更是患者至上的考虑。CMDE曾发布过决策动物研究的指导原则,旨在为企业提供一种思路的参考[12]。一个主旨思想就是:动物实验是否开展得科学决策。无需开展的尽量避免,必须开展的就要做出意义。
3.2.3 临床为患者而开发
产品进入临床开发阶段的试验对象是人体,引入“以患者为中心”的积极效应更为显性,甚至有些情况下会改变开发路径。临床开发历程中的研究设计及结局评价、试验过程,都有理念植入和践行的必要性。
研究设计及结局评价研究设计对于临床试验的重要性不言而喻,药监局发布了相关的指导性文件从试验目的、设计的基本类型、受试对象、评价指标以及统计学等方面进行了指引[13]。目前业内也有较多的文献对医疗器械临床试验设计进行研究分析。但无论是指导原则还是文献,均聚焦在方法学层面,几乎未从患者的角度进行阐述。表1可以提供一种操作思路。
表1反映的是以患者为中心的思路引导下临床设计决策的一些要点。充分的理解可能带来临床试验路径的改变,从而企业、患者双获益;而基于患者风险考虑的FIH试验,也经常因掌握了产品人体应用的安全与疗效线索,保障了后期临床开发的成功。而没有这个意识的企业,很容易折戟在自我为中心的研发征程上。

表1. “以患者为中心”在临床研究设计与结局评价过程的操作
试验过程经典的临床试验历程由于投入巨大,成功率又低,被人称为向死而生之旅[14]。因此有企业想尽办法做出预期结果,这时候以患者为中心就变成了一个价值观的问题。尽管自2015年药监局明显加大了临床试验核查力度,在企业头上悬起了一把“达摩克里斯之剑”,但真正要解决违规问题仍要靠企业回到患者至上的朴素本质上。企业应旗帜鲜明的主动终止那些疗效或安全性风险无法接受的产品继续推进,而参与人员也应该签署合规条约。
4.总结与讨论
很多企业把“以患者为中心”当成空洞口号,认为其压根不会改变什么。这种想法确有现实代表性,也反映了我国医疗器械的发展任重而道远。国际医疗器械巨头美敦力早已建立了“以患者为中心”的工作模式,无法武断地说明:是因为其公司基因中带有的以患者为中心带来了它的巨大成功,还是因为它巨大成功后才建立了“以患者为中心”的模式。
但“以患者为中心”的时代已经来临,如近年来医疗器械影像设备“全身应用移动式CT”已经投入临床急诊、手术室、病房等场所应用,这是典型的精准捕捉了患者需求的研发成果。临床研究服务领域的巨头精鼎医药联合经济学人智库发表了相关研究报告,该研究首次量化了关键创新对于药物开发的主要成功因素(以患者为中心为其中因素之一)的积极影响,其认为使用这些创新可以将药物的上市概率提高10%~21%,其中肿瘤学领域的药物开发上市概率提高了33%[15]。以患者为中心,已经成为双利好的积极要素。
医疗器械领域由于发展仍处在较早阶段,众多企业的第一要务是期待建立商业成功。但是,“以患者为中心”绝不是嘴上的口号,也并不是商业成功的阻碍,而是促进发展的极大内核力量。当前中国药监局正在积极的推进监管科学工程,尤其是中国成为国际医疗器械监管者论坛(International Medical Device Regulators Forum,IMDRF)轮值主席国以来,国际化的脚步明显加快。随着产业的快速发展,相信药政当局很快就会做出一些纲领性的指引,而企业更要在理念层面迅速转变,把医疗器械的研发真正聚焦到患者身上。
由于医疗器械业内并无可参考的研究也没有药政的指引,本文粗浅的介绍了“以患者为中心”在医疗器械领域的价值和操作,以期待能够在医疗器械领域发出声音,也期待业内能够将此理念融入到研发活动中、早日建立相关的工作模式、出台相关指引性纲领文件,为中国医疗器械研发和产业的发展助力,惠及更多患者。

