MTHFR C677T基因多态性与孤独症谱系障碍易感性关系的Meta分析
张宇昕,盖聪,杨璐平,马浩洁,张锦坤,孙红梅,胡蝶
孤独症谱系障碍(ASD)是一种常见的儿童神经发育障碍,其典型症状包括社交行为和沟通缺陷、兴趣受限和重复行为等[1-2]。ASD 的病因尚不完全明确,其发病受遗传、环境等多种因素的影响[3]。DNA甲基化作为最重要的表观遗传学修饰之一,对大脑的生长、发育和认知功能至关重要[4]。亚甲基四氢叶酸还原酶(MTHFR)为叶酸代谢途径的关键酶,在DNA 的合成及甲基化中具有重要作用[5]。MTHFR基因多态性可通过改变DNA 甲基化和叶酸代谢降低MTHFR 酶活性,可能与ASD 等神经障碍有关[6]。目前已有较多关于MTHFR基因多态性与ASD 风险之间的研究,但结论存在一定争议。因此,本研究采用Meta 分析的方法对已有研究进行统计,以明确MTHFRC677T 基因多态性与ASD 易感性之间的关系。
1 资料与方法
1.1 文献检索 对中国知网(CNKI)、万方数据、PubMed、Embase、Proquest、Web of science等数据库进行全面的文献检索。中文检索词为“亚甲基四氢叶酸还原酶”、“孤独症谱系障 碍”、“ 孤 独 症”、“ 自 闭 症”;英 文 检 索 词 为“methylenetetrahydrofolate reductase”、“MTHFR”、“autism spectrum disorders”、“autism”、“ASD”,检索2020 年6 月30 日之前发表的所有MTHFR基因多态性与ASD易感风险关系的中英文相关出版物。
1.2 文献纳入与排除标准 纳入标准:(1)病例组患者符合《精神障碍诊断和统计手册》(diagnostic and statistical manual of mental disorders,DSM)或儿童孤独症评定量表(childhood autism rating scale,CARS)诊断标准。(2)有关MTHFRC677T基因多态性与ASD 发生风险关系的公开发表文献。(3)病例组和健康对照组的基因型频率符合Hardy-Weinberg 平衡(HWE)。排除标准:(1)重复发表文献、动物研究及综述文献。(2)非病例对照研究文献。
1.3 文献筛选及资料提取 通过阅读文献的标题和摘要进行初筛,而后阅读全文进行二次筛查,最终根据纳入标准决定文献是否纳入,意见不同时通过讨论或第3位研究者协助判断。从每项确定的研究中提取出以下信息:第一作者、发表年份、国家、种族、样本量、基因型信息和所有研究等位基因的频率。如果文献中没有给出上述信息,则通过联系作者获得。
1.4 文献质量评价 由2名研究者独立进行评价,结论出现不一致时讨论协商或第3研究者协助判断解决。计算纳入文献中对照组的基因型频率是否符合HWE,若P≤0.05,代表文献质量较低;若P>0.05,则该文献质量较高。同时使用纽卡斯尔-渥太华量表(NOS)进行文献质量评价,从研究对象的选择、组间可比性和暴露因素的测量3个方面进行评价,共包含8个条目,共计9分,得分≥5分为高质量研究。
1.5 统计学方法 所有的统计分析使用Stata 14.0 软件,MTHFR多态性与ASD 之间的关系采用OR值和95%CI进行评估。分别计算等位基因模型(Tvs.C),显性模型(TT+CTvs.CC),纯合子模型(TTvs.CC)和隐性模型(TTvs.CT+CC)的OR值及其95%CI,并进行种族亚组分析。采用χ2检验判定基因型在对照组的分布是否符合HWE。采用I2检验文献的异质性,检验水准α=0.05,若P>0.05 且I2≤40%,说明异质性小,选择固定效应模型;若P≤0.05 且I2>40%,说明各研究之间存在较高异质性,选择随机效应模型进行分析。通过敏感性分析来检验结果的稳定性,为了控制潜在的发表偏倚,采用漏斗图并通过Egger线性回归检验进行分析;P<0.05为差异有统计学意义。
2 结果
2.1 纳入文献基本特征 经文献筛选后共纳入16篇文献[7-22],其中病例组2 149 例,对照组2 251 例,文献筛选流程及结果见图1,纳入文献的基本资料见表1,NOS质量评分均≥7分。
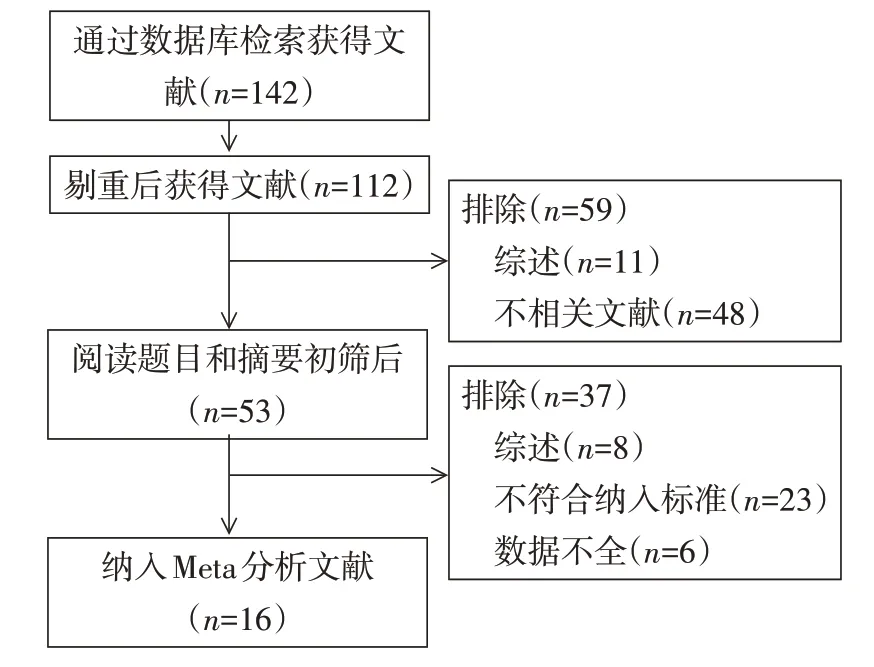
Fig.1 Pictures showed the literature screening process图1 文献筛选流程图
2.2 MTHFR分析结果
2.2.1 MTHFR T 等位基因与ASD 发病之间的Meta分析 各研究结果存在异质性(I2=85.7%,P<0.001),采用随机效应模型进行Meta 分析。ASD 组和对照组携带T等位基因分别为1 528例、2 770例,C等位基因分别为2 770例、3 084例。以T等位基因为暴露因素,C等位基因为非暴露因素进行分析,结果显示,携带T 等位基因者发生ASD 的风险是携带C 等位基因的1.51 倍(OR=1.51,95%CI:1.15~1.99,P=0.003)。种族亚组分析显示,亚洲人携带T 等位基因者发生ASD 的风险是携带C 等位基因人群的1.85 倍(P=0.014);而在高加索人及非洲人组中,携带T等位基因者发生ASD的风险与携带C等位基因无关(高加索人OR=1.20,P=0.102;非洲人OR=2.17,P=0.354),见图2。
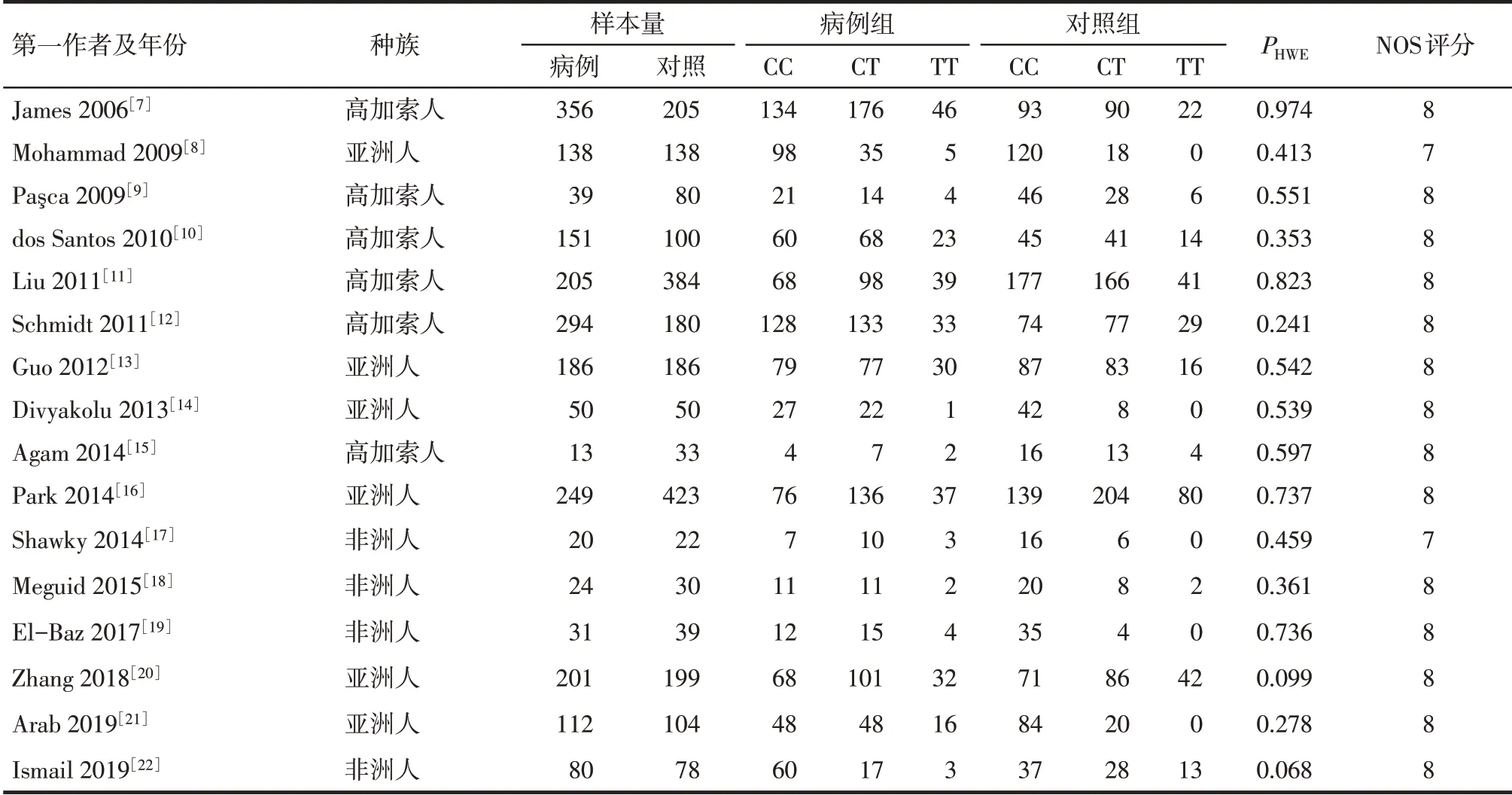
Tab.1 Basic features of MTHFR C677T included in the study表1 MTHFR C677T纳入研究的基本特征
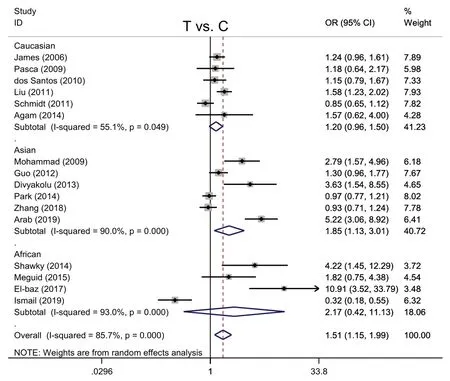
Fig.2 The Meta analysis forest map between MTHFR gene C677T polymorphism(T vs.C)and ASD图2 MTHFR基因C677T多态性(T vs.C)与ASD发病的Meta 分析森林图
2.2.2 显性模型TT+CTvs.CC与ASD发病的Meta分析 各研究结果存在异质性(I2=80.8%,P<0.001),采用随机效应模型进行Meta 分析。ASD 组和对照组TT+CT 基因型分别为1 248 例、1 149 例,CC 基因型分别为901例、1 102例。以TT+CT 基因型为暴露因素,CC基因型为非暴露因素进行分析,结果显示,携带TT+CT 基因型人群发生ASD 的风险是携带CC基因型的1.67倍(P=0.002)。种族亚组分析显示,高加索人携带TT+CT 基因型人群发生ASD 的风险是携带CC 基因型的1.30 倍(P=0.024);亚洲人携带TT+CT 基因型人群发生ASD 的风险是携带CC 基因型人群的1.99 倍(P=0.010);而在非洲人组中,携带TT+CT 基因型人群发生ASD 的风险与携带CC 基因型无关(OR=2.51,P=0.324),见图3。
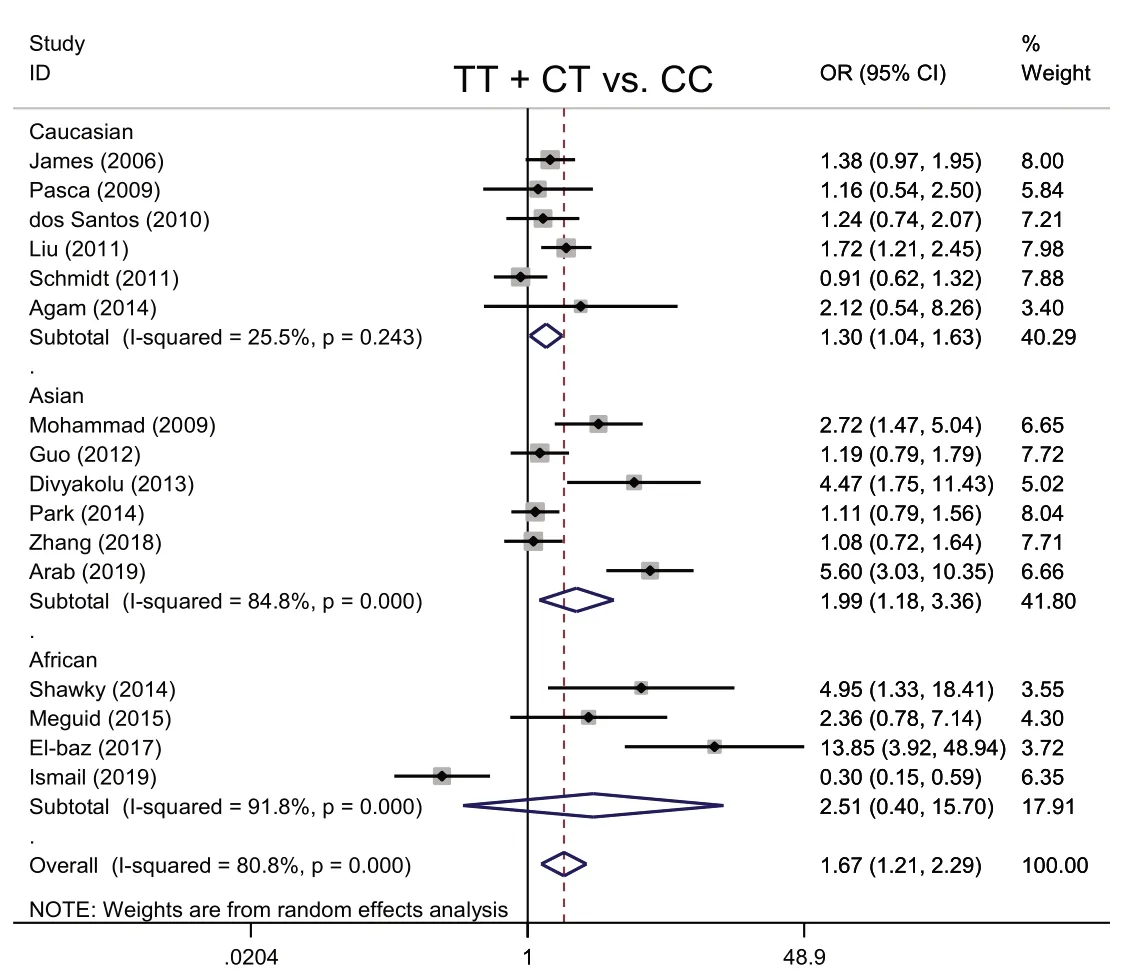
Fig.3 The Meta analysis forest map between MTHFR gene C677T polymorphism(TT+CT vs. CC)and ASD图3 MTHFR基因C677T多态性(TT+CT vs. CC)与ASD的Meta分析森林图
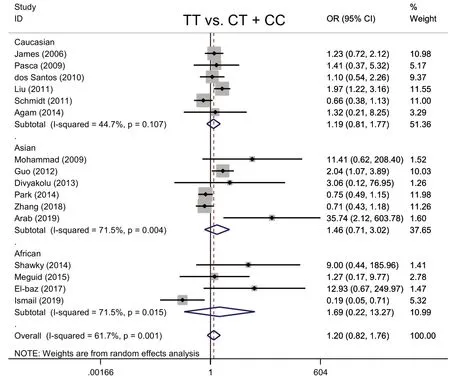
Fig.4 The Meta analysis forest map between MTHFR gene C677T polymorphism(TT vs. CT+CC)and ASD图4 MTHFR基因C677T多态性(TT vs. CT+CC)与ASD Meta分析森林图
2.2.3 隐性模型TTvs.CT+CC与ASD发病的Meta分析 见图4。各研究结果存在异质性(I2=61.7%,P<0.001),因此采用随机效应模型进行Meta 分析。ASD组、对照组TT基因型分别为280例、269例,ASD组、对照组CT+CC 基因型分别为1 869 例、1 982 例。以TT基因型为暴露因素,CT+CC基因型为非暴露因素进行分析,结果显示,携带TT 基因型人群发生ASD的风险与携带CT+CC基因型无关(OR=1.20,P=0.340)。在种族亚组分析中,3组Meta分析结果均显示携带TT 基因型人群发生ASD 的风险与携带CT+CC 基因型无关(高加索人:OR=1.19,P=0.376;亚洲人:OR=1.46,P=0.309;非洲人:OR=1.69,P=0.618)。
2.2.4 纯合子模型TTvs.CC 与ASD 发病的Meta 分析 各研究结果存在异质性(I2=67.5%,P<0.001),采用随机效应模型进行Meta 分析。ASD 组、对照组TT 基因型分别为280 例、269 例,ASD 组、对照组CC基因型分别为901例、1 102例。以TT基因型为暴露因素,CC基因型为非暴露因素进行分析,结果显示,携带TT基因型人群发生ASD的风险与携带CC基因型人群差异无统计学意义(OR=1.43,P=0.113)。种族亚组分析均显示携带TT 基因型人群发生ASD 的风险与携带CC基因型人群差异无统计学意义(高加索人:OR=1.36,P=0.205;亚洲人:OR=1.72,P=0.165;非洲人:OR=2.47,P=0.490),见图5。
2.3 敏感性分析 通过逐一排除研究的方法进行敏感性分析,Meta 分析结果显示各效应量无明显改变,证明结果具有稳定性,见图6。
2.4 发表偏倚 通过漏斗图和Egger线性回归法检验发表偏倚,各基因型漏斗图可观察到各独立研究OR在坐标轴上围绕漏斗图的中心线散开,各基因型Egger检验结果均P>0.05(Tvs.C,t=2.040,P=0.061;TT+CTvs.CC:t=1.923,P=0.076;TTvs.CT+CC,t=1.711,P=0.109;TTvs.CC,t=1.730,P=0.106),提示本研究无明显发表偏倚。见图7。
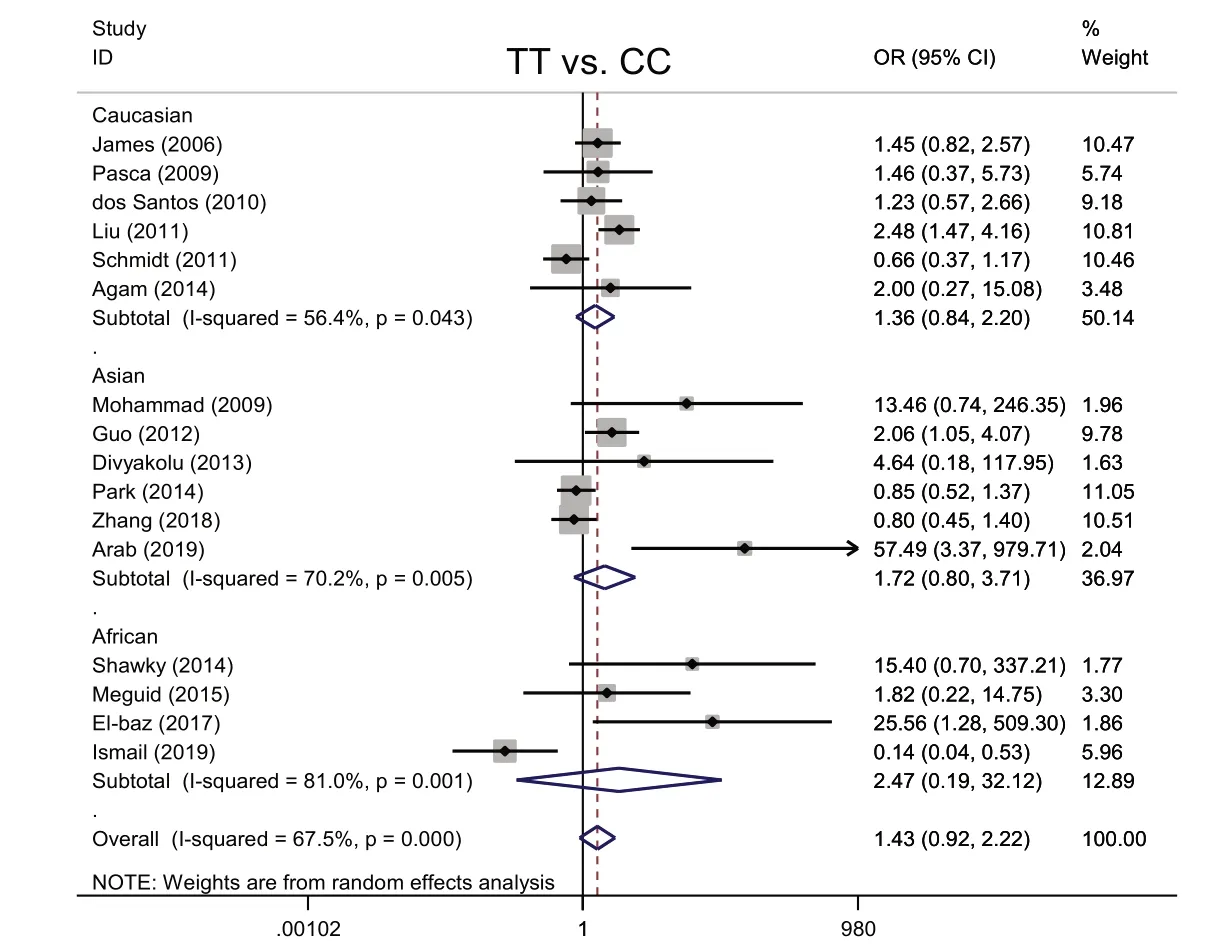
Fig.5 The Meta analysis forest map between MTHFR gene C677T polymorphism(TT vs. CC)and ASD图5 MTHFR基因C677T多态性(TT vs. CC)与ASD的Meta分析森林图
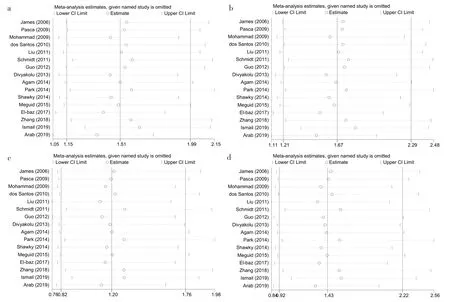
Fig.6 The impact of sensitivity analysis studies in Meta-analysis on the combined results图6 Meta分析中的敏感性分析调查研究对合并结果的影响
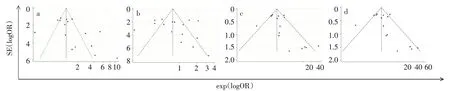
Fig.7 Funnel plot for publication bias test in the four genetic models图7 各遗传模型的发表偏倚漏斗图
3 讨论
叶酸主要参与甲基化循环以及DNA 和RNA 的生物合成,叶酸代谢障碍可导致机体氧化应激易感性,增加ASD的发病风险[23]。MTHFR是单碳代谢过程中叶酸和同型半胱氨酸代谢的关键酶。它将5,10-亚甲基四氢叶酸转化为5-甲基四氢叶酸,并参与DNA 甲基化相关的叶酸和同型半胱氨酸的转化[24-25]。遗传因素与ASD 的发生密切相关,人类MTHFR基 因 定 位 于 染 色 体1p36.3[26],经 鉴 定MTHFR基因有14 个与酶缺陷相关的单核苷酸多态性位点,其中C677T基因位点是研究最多、在临床上最重要的变异之一。C677T的变化是由于胞嘧啶被胸腺嘧啶取代,导致在密码子222 位点的缬氨酸转化为丙氨酸[27],显著降低MTHFR酶的活性和血浆同型半胱氨酸的浓度,导致神经和血管功能障碍,继而影响大脑功能[28],而这种改变可能会增加ASD 的易感性。
近年来关于MTHFR基因多态性与ASD 易感性的研究较多,但结论尚不完全统一,因此笔者收集了相关文献进行Meta 分析。本研究共纳入了16 篇文献,其中6篇表明MTHFRC677T多态性与ASD发生无关[9,10,14,16,18,20],而其他文献表明MTHFRC677T 多态性增加了ASD的易感性[7-8,11-13,15,17,19,21-22]。本研究从等位基因模型(Tvs.C)、显性模型[(TT + CT)vs.CC]、纯合子模型(TTvs.CC)和隐性模型[TTvs.(CT+CC)]进行综合分析,结果显示在等位基因模型和显性模型中MTHFRC677T 多态性与ASD 发生具有相关性。种族亚组分析显示,高加索人仅在显性模型中MTHFRC677T多态性与ASD发生密切相关,而亚洲人在等位基因模型和显性模型中均具有相关性。Sadeghiyeh 等[29]通 过Meta 分 析 也 得 出MTHFRC677T多态性可能会增加ASD易感性的结论。本研究相比于既往的Meta分析,进行了数据更新以完善统计的精确度,且排除了对照组及病例组各基因型分布频率不符合HWE 的研究,使结论更具有说服力。此外,本研究还纳入了有关非洲人种的相关文献,并进行了敏感性分析及发表偏倚检测,其结果也提示分析的结论是较可靠的。
然而本研究还存在不足之处:(1)文献合并分析后异质性较大,进行种族亚组分析后不能明显降低其异质性。Park 等[16]发现男性患病率大于女性,提示异质性来源可能与性别有关,但大部分研究未报道不同性别各基因型的详细数据,无法进行性别亚组分析。(2)纳入的部分研究样本量偏小。
综上所述,MTHFRC677T多态性与ASD易感性具有一定相关性,高加索人仅在显性遗传基因型中MTHFRC677T多态性与ASD发生密切相关,而亚洲人在等位基因模型和显性模型中均具有相关性。

