鸭疫里氏杆菌与鸭坦布苏病毒双重PCR方法的建立
董雯雯 张世栋 王春玲 艾洪新 朱伟 李峰

摘 要:为建立一种能同时快速检测鸭疫里氏杆菌(RA)和鸭坦布苏病毒(DTMUV)的PCR方法,根据NCBI公布的RA dnaB基因和DTMUV PrM基因分别设计并合成两对特异性引物,通过对双重PCR反应的引物浓度和退火温度进行优化筛选。优化引物浓度组合为:RA引物0.5 μmol/L,DTMUV引物为1 μmol/L,最佳退火温度为53 ℃。特异性试验表明,该方法对鹅细小病毒、禽流感病毒、新城疫病毒、番鸭细小病毒、I型鸭肝炎病毒、沙门氏菌、大肠杆菌的核酸扩增结果均为阴性,RA和DTMUV的检测结果为阳性。敏感性测定表明,该双重PCR方法最低能检出RA和DNAV-1的核酸量分别为6.7 pg和3.6 pg。本研究建立的检测方法检测实验室保存的8份临床病料,RA的阳性率为62.5%,DTMUV阳性率为37.5%。综上所述,建立的PCR方法特异性强、敏感性和稳定性良好,为RA和DTMUV的临床病料检测提供了技术支撐。
关键词:鸭疫里氏杆菌;鸭坦布苏病毒;双重PCR;应用
中图分类号:S858.31 文献标识码:B 文章编号:1673-1085(2021)1-0016-05
鸭疫里氏杆菌(Riemerella anatipestifer, RA)为革兰氏阴性小杆菌,主要感染1~8周龄雏鸭,引起雏鸭的纤维素性心包炎、肝周炎、气囊炎等病理变化,又称传染性浆膜炎,该病可经呼吸道和损伤的皮肤传染,呈现慢性或急性败血性过程,该病一年四季均可发生,病死率约为5%~20%[1-4]。鸭坦布苏病毒(Duck Tembusu virus, DTMUV)是黄病毒科黄病毒属恩塔亚病毒群的一种新型黄病毒,为单股正链RNA病毒,可引起雏鸭的共济失调、瘫痪、蛋鸭卵巢出血坏死、严重时可致死。我国于2010年相继在福建、浙江、江苏等地区的蛋鸭中检出本病毒,该病的临床症状类似于鸭瘟、鸭流感,目前已扩大至肉鸭、番鸭、鹅、鸽、麻雀等多种禽类[5]。鸭疫里氏杆菌病和鸭坦布苏病是近年来危害养鸭业的重要病原微生物,也可引起雏鸭混合感染,导致雏鸭大批感染死亡,严重影响我国水禽养殖业的健康发展,并造成巨大的经济损失[6]。
目前针对以上两种常见疾病的实验室诊断方法主要有细菌、病毒的分离鉴定、生理生化鉴定、形态观察、血清中和试验、免疫荧光技术、酶联免疫吸附试验等[7]。这些方法在检测过程中耗时费力,成本较高。多重PCR是在常规PCR基础上改进并发展起来的一种新型DNA扩增技术,在同一PCR反应体系中加入两对或两对以上特异性引物,实现同时扩增出多种病原微生物核酸片段的PCR反应,在临床上混合感染疾病的鉴别诊断方面具有较高的优势和应用价值[8-10]。由于RA和DTMUV均可感染低日龄肉鸭及蛋鸭,且存在混合感染。为此,本研究针对RA和DTMUV的保守序列设计并合成两对特异性引物,通过优化反应参数及体系建立了RA和DTMUV的双重PCR检测方法,为这两种病毒的临床感染快速检测提供技术支撑。
1 材料与方法
1.1 毒株 试验毒株:RA、DTMUV、鹅细小病毒(GPV)、禽流感病毒(AIV)、新城疫病毒(NDV)、番鸭细小病毒(MDPV)、I型鸭肝炎病毒(DHV-I)、沙门氏菌(SE)、大肠杆菌(E.coil)均由本单位保存。
1.2 主要试剂 细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;病毒DNA/RNA提取试剂盒购自北京博迈斯科技发展有限公司;2×Taq PCR MasterMix、DL2000 DNA Marker均购自北京TIANGEN公司;cDNA第一链合成试剂盒购自赛默飞世尔科技(中国)有限公司。
1.3 核酸提取和cDNA合成 RA核酸、DTMUV尿囊液及8份临床疑似病料的核酸提取,按照细菌基因组DNA提取试剂盒及病毒DNA/RNA提取试剂盒说明书进行。
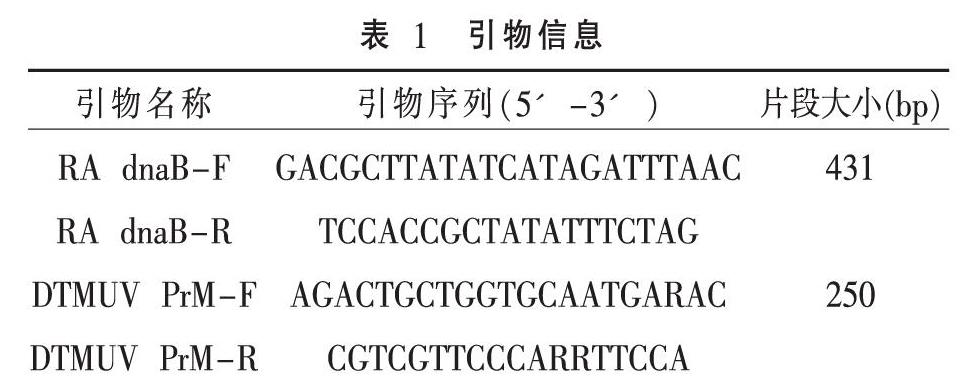
1.4 引物设计 根据NCBI公布的鸭疫里氏杆菌dnaB基因和鸭坦布苏病毒PrM基因的保守核苷酸序列设计引物,引物信息见表1。引物由生工生物工程(上海)股份有限公司合成,置-20 ℃保存备用。
1.5 单一PCR扩增及产物鉴定 分别以RA DNA及病毒cDNA为模板进行单一PCR扩增,反应体系为20 μL:2×Taq PCR Master Mix 10 μL,上下游引物各0.5 μL,模板DNA 1 μL,补充ddH2O至20 μL。反应程序:95 ℃预变性5 min;95 ℃变性45 s,53 ℃退火45 s,72 ℃延伸45 s,扩增35个循环;72 ℃终延伸10 min,4 ℃终止。取反应产物10 μL,以120 V恒压于1%琼脂糖凝胶电泳观察结果,并将扩增条带送往生工生物工程(上海)股份有限公司进行测序。
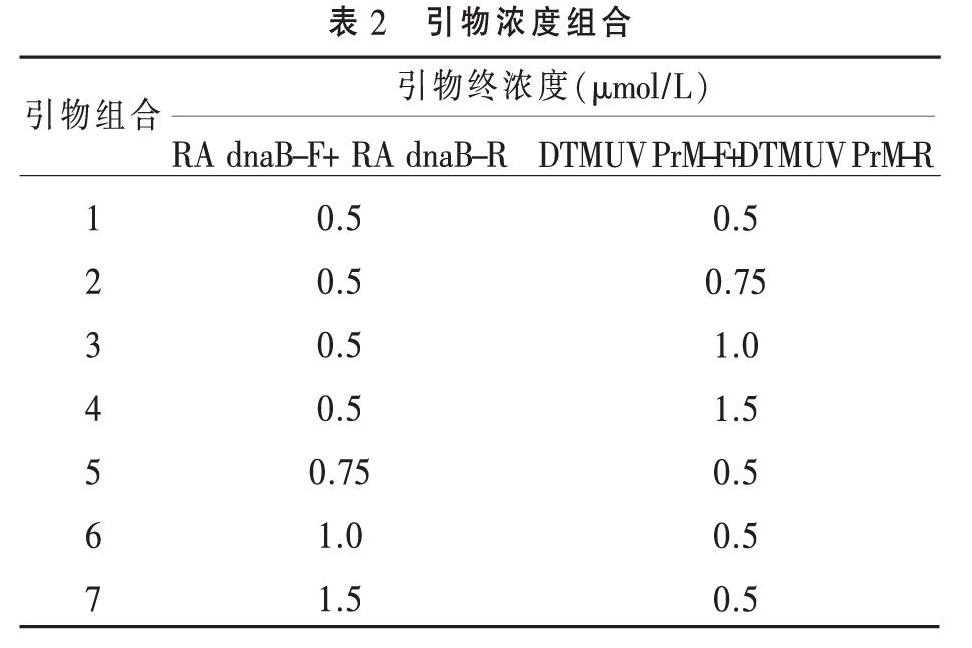
1.6 双重PCR的建立及反应条件的优化 RA和DTMUV cDNA各取0.5 μL混合作为双重PCR模板,分别进行引物浓度和退火温度的优化。退火温度优化反应体系为20 μL:2×Taq PCR Master Mix 10 μL,上下游引物各0.5 μL,混合模板DNA 1μL,补充ddH2O至20 μL,退火温度设置8个温度梯度,分别为49、49.2、49.6、50.5、51.6、53、54.7、56.1 ℃。引物浓度优化反应体系为20 μL:2×Taq PCR Master Mix 10 μL,混合模板1 μL,引物浓度的组合见表2;最后补充ddH2O至20 μL。
1.7 特异性试验 为检测建立方法的特异性,以鸭中常见的GPV、AIV、NDV、MDPV、DHV-I、SE、E.coil核酸作为模板,在建立的双重PCR体系中进行PCR扩增,同时以RA及DTMUV核酸的混合液作为模板设立阳性对照,PCR扩增产物经1%凝胶电泳检测。
1.8 敏感性试验 对提取的核酸分别检测浓度,将提取的RA及DTMUV核酸分别进行2倍倍比浓度梯度稀释:1×20、1×2-1、1×2-2、1×2-3、1×2-4、1×2-5、1×2-6、1×2-7,8个稀释梯度,每个梯度各取0.5 μL混合作为PCR反应模板,然后用优化的PCR反应条件进行检测,PCR扩增产物经1%凝胶电泳,对该方法的敏感性进行检测。
1.9 双重PCR方法的重复性 对RA、DTMUV、RA+DTMUV的核酸进行多次重复性检测,以验证该检测方法的稳定性。
1.10 临床样品的检测 利用已建立好的双重PCR方法,对本单位保存的可疑病料进行检测。
2 结果
2.1 单一PCR扩增 单一PCR扩增结果表明,本试验设计的引物能夠分别特异性扩增出RA dnaB基因和DTMUV PrM基因,扩增片段大小为431 bp和250 bp,与预期结果一致,见图1。
2.2 双重PCR方法的建立及反应条件优化 对双重PCR退火温度和引物浓度优化结果表明,最佳退火温度为53 ℃,见图2。最佳引物浓度组合为:RA dnaB F/R 0.5 μmol/L, DTMUV PRM F/R 1.0 μmol/L,见图3。PCR扩增程序为:95 ℃预变性5 min;95 ℃变性45 s,54.7 ℃退火45 s,72 ℃延伸45 s,扩增35个循环;72 ℃终延伸10 min,4 ℃反应结束。
2.3 特异性试验 通过前期优化的双重PCR反应条件及反应体系分别对RA及DTMUV的混合模板、RA、DTMUV、GPV、AIV、NDV、MDPV、DHV-I、SE及E.coil单一模板进行PCR扩增,结果表明本试验建立的双重PCR方法能够有效检测出RA、DTMUV核酸,且对其他病原微生物核酸检测结果全为阴性,表明建立的双重PCR特异性良好,特异性试验结果见图4。
2.4 敏感性试验 采用前期优化的双重PCR反应条件及体系,以RA、DTMUV核酸为模板,2倍倍比稀释进行PCR扩增,结果表明:RA、DTMUV的核酸最低检出量分别为6.7 pg和3.6 pg,表明本试验建立的多重PCR方法具有较好的敏感性。敏感性试验结果见图5。
2.5 双重PCR方法的重复性 利用前期建立的双重PCR方法对RA+DTMUV、RA、DTMUV核酸进行多次重复性检测,结果表明:以上核酸均能扩增出与预期结果相一致的目的片段,表明该方法稳定性良好,见图6。
2.6 临床样品的检测 采用建立好的双重PCR方法对本单位保存好的临床病料进行检测,结果表明,8份临床病料中RA的检出率为62.5%,DTMUV的检出率为37.5%,见图7。
3 讨论
随着中国水禽养殖规模日益扩大,及时准确检测和诊断水禽病毒病是疫病监测和防控的重中之中。当前,水禽病毒病的检测诊断主要依靠临床症状、病理变化、血清学、常规PCR检测等方法[11],适应于检测单一感染,然而水禽病毒病常常表现为混合感染,常规检测难以准确判定。RA和DTMUV是危害水禽业健康发展的重要病原微生物,不仅存在单一感染,混合感染也屡见报道[2,6,12-17]。同时快速检测这两种病原微生物具有重要的临床意义,而本试验建立了一种双重 PCR 方法,对反应体系和反应条件均经过优化,敏感性高,最低能检出 6.7 pg RA和3.6 pg DTMUV。
相较于单一PCR,多重PCR由于在同一反应体系中加入多对特异性引物和多种核酸模板,因此反应条件要求相对较高[18]。一般来说,多重PCR方法的建立主要受反应体系中的Mg2+浓度、TaqDNA聚合酶浓度、引物浓度、退火温度等几种因素的影响,而引物浓度是多重PCR成功的关键之处,可直接影响到多重PCR的扩增结果。本次试验所建立的双重PCR方法使用的是2xTaq PCR Master Mix,因此,针对本反应体系,仅针对退火温度和引物浓度进行优化筛选即可。本研究中以RA dnaB基因和DTMUV PrM基因保守序列为参考设计引物,PCR扩增大小分别为431 bp和250 bp,两者产物大小差异较为明显,可以在琼脂糖凝胶电泳中进行区分。退火温度从49~56.1 ℃分别进行试验,结果显示退火温度在53 ℃时, RA 引物为0.5 μmol/L、DTMUV 引物为1.0 μmol/L时反应达到最佳效果;在敏感性试验过程中,模板梯度浓度均采取了2倍倍比稀释,经检测,该双重PCR最低能同时检测到RA 6.7 pg和DTMUV 3.6 pg的核酸模板,灵敏度较高。本研究建立的RA和DTMUV双重PCR方法,获得两种产量较高、特异性好、纯度高的产物,操作简单、省时省力,该方法的建立为DTMUV和DPV早期诊断提供了重要的方法,可为这两种病毒混合感染番鸭的临床病例的快速检测提供技术支撑。
参考文献:
[1] Chang F F,Chen C C,Wang S H,et al. Epidemiologyand antibiogram of Riemerella anatipestifer isolated fromwaterfowl slaughterhouses in Taiwan[J]. Journal of veterinary research,2019, 63(1):79-86.
[2] 焦哲,宋彦民,孙秀秀,等.鸭疫里默氏杆菌与鸭源呼肠孤病毒混合感染的病理学诊断[J].中国兽医科学, 2019,49(9):1194-1198.
[3] 孔桂慧,王方昆,孙淑红,等. 一株鸭疫里默氏杆菌的分离鉴定及其免疫原性研究[J].中国预防兽医学报, 2020,42(5):451-456.
[4] 赵巧雅,马秀丽,于可响,等.1株鸭疫里氏杆菌的分离鉴定及生物学特性研究[J].畜牧与兽医,2020,52( 2) : 87-90.
[5] 梁雄燕,余连喜,孙真真,等.鸭坦布苏病毒JZ1801株分离鉴定及其E蛋白系列分析[J].中国家禽,2020,42(10):27-32.
[6] 李婷,徐景峨,杨莉,等.鸭坦布苏病毒病、鸭圆环病毒病与鸭疫里默氏杆菌混合感染的诊断[J].贵州农业科学,2020,48(8):77-81.
[7] 包细明,张益,鲜思美,等.鉴别四种鸭源肠道易感病原菌的多重PCR的建立[J].中国兽医科学,2018,48(12): 1542-1547.
[8] Shi X,Liu X,Wang Q,et al.A multiplex real-time PCR panel assay for simultaneous detection and differentiation of 12 common swine viruses[J]. J Virol Methods, 2016, 236(6): 258-265.
[9] 饶体宇,张益,鲜思美,等.鸭瘟病毒、鹅细小病毒和番鸭细小病毒三重PCR检测方法的建立[J]. 畜牧与兽医, 2019, 51(7):85-89.
[10] 张飞燕,赵玲,金洁,等.多重PCR技术在实验动物病原检测中的应用[J].中国比较医学杂志, 2018, 28(10): 111-116.
[11] Cheng A, Han X, Zhu D, et al. Application of indirect immune-fluorescent staining method for detection and antigen location of duck enteritis virus in paraff in sections[J]. Chin J Vet Sci, 2008, 28: 871-875.
[12] 马犇.鸭坦布苏病毒与新城疫混合感染的分离鉴定[J].上海农业科技, 2016, 4(1): 68-70.
[13] 祖立闯,苗立中,王艳.鸭混合感染病例中鸭坦布苏病毒的分离鉴定与E基因序列分析[J].中国兽医学报, 2015, 35(4): 553-557.
[14] 李志鹏, 曹凤录, 李焕明, 等. 一例鸭病毒性肝炎病毒与鸭坦布苏病毒混合感染的病例报告[J]. 黑龙江畜牧兽医, 2016, 12: 124-125.
[15] 田开丽, 吳立杰. 一例鸭黄病毒与鸭疫里默氏杆菌混合感染的诊治[J].家禽科学,2019,12:39-40.
[16] 陈翠腾,程龙飞,傅光华,等. 一例鸭1型甲肝病毒和11型鸭疫里默氏杆菌混合感染的诊断及其病原的分离鉴定[J].中国畜牧兽医,2016,11:3053-3058.
[17] 闫艳新,孙月萍,刘文华.商品鸭H9亚型禽流感病毒与鸭疫里默氏杆菌混合感染的诊断[J]. 安徽农业科学, 2016,9: 128-130.
[18] 王涛.生鲜猪肉中产肠毒素大肠杆菌多重 PCR检测方法研究[D].杨凌:西北农林科技大学, 2015.
□

