儿童重症百日咳治疗策略研究进展
吴小英 李丽君 姚开虎 许红梅 符州
(1. 重庆医科大学附属儿童医院感染科,重庆 400014;2. 广州市妇女儿童医疗中心呼吸科,广东 广州 510623;3. 国家儿童医学中心/首都医科大学附属北京儿童医院/北京市儿科研究所微生物研究室/儿科学国家重点学科/教育部儿科重大疾病研究重点实验室,北京 100045;4. 重庆医科大学附属儿童医院呼吸中心,重庆 400014)
百日咳是由百日咳鲍特菌引起的一种具有高度传染性的急性呼吸道感染性疾病,重症患者可出现频繁呼吸暂停、重症肺炎、高白细胞血症、肺动脉高压等并发症,甚至死亡[1-2]。近年监测数据显示,儿童尤其是1岁以内婴儿是百日咳高发人群,重症及死亡病例也几乎只发生在这个年龄段[1-3]。目前百日咳是全球第5位疫苗可预防的儿童感染性死亡疾病,2014年世界卫生组织(WHO)估计全球<5岁儿童因百日咳死亡病例约为160 700例[4]。我国西南地区一家儿童医院2015~2019年报告了25例百日咳患儿死亡[2]。虽然针对急重症的治疗措施不断改进与发展,但重症百日咳治疗仍较棘手,病死率仍较高,有文献报道重症百日咳病死率约为7.6%[2],入住ICU患儿高达20%[5-6]。关于重症百日咳的诊断、发生机制和高危因素,已有文章进行了全面总结[7]。本文进一步综述文献报告的重症百日咳治疗措施及其使用适应证、效果等内容,为临床治疗实践和研究提供参考。
1 抗菌药物治疗
重症百日咳的抗菌治疗与普通百日咳无异,强调在进入痉咳期前早期使用阿奇霉素或红霉素等敏感抗菌药物以减轻症状、缩短病程,进入痉咳期后再使用则只能降低传染性,但无论疾病处于哪个阶段,所有百日咳患者都应接受敏感抗菌药物治疗,以尽快清除细菌,减少向他人传播[8]。目前体外药物敏感性检测显示中国百日咳临床分离株对大环内酯类抗菌药物耐药严重[9-10];分离株对复方新诺明普遍敏感,它可用于2月龄以上患儿的治疗[8]。2019年国内一项单中心研究显示哌拉西林-他唑巴坦和头孢哌酮-舒巴坦在体内、体外均具有抗百日咳鲍特菌活性,可作为对大环内酯类耐药菌株的替代选择[11]。目前,在国内继续寻找对大环内酯类耐药百日咳菌株的替代抗生素,是非常重要的。
2 机械通气治疗
重症百日咳常因继发重症肺炎,也可能因肺动脉高压、百日咳脑病等,而出现呼吸衰竭,或因阵发性痉挛样咳嗽引起频繁呼吸暂停,经镇静、吸氧、雾化、吸痰等处理,呼吸功能不能改善时,就需要启动特殊呼吸支持措施,以改善通气、换气、氧合,减少呼吸做功,促进疲劳呼吸肌的恢复,纠正缺氧,又有助于肺动脉高压、脑细胞功能的改善。2018年Evered等[12]首次报道给1例4月龄频繁呼吸暂停的百日咳婴儿服用咖啡因后呼吸暂停消失,从而避免了机械通气,但仅为个案报道,咖啡因治疗百日咳呼吸暂停的有效性和安全性有待进一步研究。研究表明入住ICU的百日咳患儿中约50%需要机械通气,平均通气时间6.2 d,31%需要有创机械通气[13]。综合文献来看,目前缺乏统一的百日咳机械通气适应证,一般是基于临床经验,并参考其他严重疾病的机械通气适应证。仅个别研究明确提供了所使用的有创机械通气适应证[5,14]和终止适应证[14]。白细胞(WBC)显著升高的百日咳患儿更有可能需要机械通气[15]。
3 高白细胞血症的治疗
高白细胞血症是发生重症百日咳及死亡的独立危险因素[2,16-17]。WBC减少可避免或减轻肺动脉高压,有助于改善低氧血症,减缓或阻止病情进展至心肺功能衰竭[18]。目前降低外周血WBC计数主要采用WBC单采术、换血疗法[18-20],此外还可通过在体外膜肺氧合(ECMO)回路上连接WBC滤过装置减少血液循环中的WBC[18]。WBC单采术需训练有素的技术人员操作,开展条件要求较高,操作不当易出现严重并发症;而换血疗法在ICU中可常规开展,是一种更加安全、成熟的治疗方法[21],且在清除血管内聚集WBC的同时,还能置换出血循环中的百日咳毒素(pertussis toxin,PT),能进一步遏制PT引起的WBC增多等病理生理变化[22]。目前最常采用双倍容量换血疗法,换血量一般约为200 mL/kg,联合使用4.5%的白蛋白和浓缩红细胞,以使换血治疗后的红细胞压积达到 40%~45%[18]。
Nieves等[23]调查10例年龄≤120 d接受换血治疗的重症百日咳患儿,结果显示5例(50%)死亡;2015年Winter等[16]研究中11例换血治疗婴儿全部死亡;2018年我国学者总结了2004~2017年国内外多个文献报道共56例行换血治疗的百日咳患儿资料,发现总存活率为67.9%[24]。可见,不同研究报告的存活率差别大。有研究者认为换血治疗需在患儿出现器官衰竭或低血压性休克之前启动,其治疗价值才明显,否则很难改善预后[23]。但是,目前对于重症百日咳换血治疗适应证无统一标准,总体上是依据WBC水平,结合病情进展速度、脏器功能情况而定。2010年Rowlands等[18]认为3月龄内百日咳患儿,在无ECMO治疗适应证时,如WBC>100×109/L,或者 WBC>70×109/L 伴心和肺功能衰竭,或者WBC>70×109/L伴呼吸、心脏之一功能衰竭,但有肺动脉高压,都是紧急换血适应证;WBC>50×109/L就应考虑换血治疗。Nieves等[23]认为4月龄内百日咳患儿,WBC快速增加达到30×109/L,并伴有肺动脉高压、早发肺炎、脉搏持续≥170次/min和呼吸持续≥70次/min时,就应启动换血治疗。2018年Cherry等[25]结合自己的研究数据及大量文献资料,系统地提出了2月龄内婴儿百日咳换血治疗标准及监测标准、再次换血标准,但按此标准进行换血治疗效果还需要后续研究评估,其余年龄段的换血标准尚待研究总结。
4 肺动脉高压的治疗
重症百日咳合并肺动脉高压并不少见,严重、持续的肺动脉高压可导致心肺功能衰竭甚至死亡[26]。现有研究报告几乎均未提及百日咳所致儿童肺动脉高压的治疗适应证,少有提及具体治疗细节。通常,肺动脉高压的基础治疗是针对病因和加重因素,对依据WHO功能分级为Ⅱ~Ⅳ级者(新诊断或经基础治疗后肺动脉高压持续存在且达到此分级标准者),需要加用扩张肺动脉药物以降低肺动脉压,扩张肺动脉药物常使用吸入性一氧化氮(NO),NO-环磷酸鸟苷增强剂如西地那非,前列环素通路激动剂如静脉用前列环素[27]。对于百日咳患儿,基础治疗一般包括供氧纠正低氧血症,换血治疗减轻高白细胞血症,避免或控制烦躁、容量超负荷、贫血等加重因素;紧急降低肺动脉高压的药物最常使用的是吸入性NO[13,16-17,28]。吸入性NO可选择性降低肺动脉压力,典型起始剂量为20 ppm,一旦氧合改善,应相对较快地降至5 ppm,此后缓慢减量,至1 ppm时可直接停用,疗程一般不超过5 d[27,29]。2004年Skladal等[28]报道1例因神经系统症状无法行ECMO治疗的合并肺动脉高压和急性呼吸窘迫综合征的百日咳患儿,机械通气失败后,吸入NO后显效。但更多研究认为:吸入NO治疗,临床获益不明显,甚至可能是百日咳患儿死亡的独立危险因素[13,16-17],因为百日咳杆菌产生的气管细胞毒素可诱导气道上皮细胞产生NO,NO可引起气道上皮细胞自身毒性损害[30],而外源性吸入NO可能加重这种损害。肺动脉高压经基础及扩张肺血管药物治疗后,仍有低心排血量或严重呼吸衰竭,就有启动ECMO治疗的适应证;经综合性药物治疗后,有反复晕厥的功能分级Ⅲ级或Ⅳ级的肺动脉高压患儿,可考虑姑息性房间隔造口术,这可增加等待肺移植期间的生存率;肺移植可能是晚期顽固性肺动脉高压患儿唯一的生存希望[27]。
5 ECMO治疗
ECMO是一种机械心肺支持技术,在具备相应设备和专业技术人员的医疗中心开展,有利于常规治疗无效、有逆转可能的严重急性呼吸衰竭、心力衰竭患者,ECMO支持下的“心、肺休息策略”为基础疾病治疗、心肺功能的恢复赢得时间。ECMO用于百日咳治疗最早是在1990年[31],但至今30年过去,其生存率并无改善趋势,3个相对大样本研究分别总结了1992~2009年、2009~2012年、2012~2015年在体外生命支持组织(extracorporeal life support organization, ELSO) 中登记的ECMO治疗百日咳患儿数据,病死率分别为 69.8%(118/169)[18]、69.4%(34/49)[32]、72.0%(144/200)[33],小于6周婴儿的病死率最高(83.6%)[18],进一步分析发现低月龄、较低的PaO2/FiO2、使用血管活性药物、神经肾脏系统或感染性并发症、肺动脉高压和病情进展快(比如入院后24 h内需要插管、ECMO支持)与ECMO治疗的病死率增加相关[33]。接受ECMO呼吸支持治疗患儿的总体病死率为37.8%,其中以百日咳生存获益最小[32],这可能与百日咳相关的顽固性肺动脉高压导致心肺功能衰竭难以纠正有关。可见,目前在重症百日咳患儿中开展ECMO治疗,生存受益很小。很少有研究说明重症百日咳采用ECMO治疗的具体适应证。有学者建议存在多个ECMO预后不良危险因素的百日咳病例,尤其是存在严重肺动脉高压者,其血液动力学很可能迅速崩溃,应抢在心血管衰竭前启动ECMO,而不应该把它作为晚期补救性措施[34]。此外,临床中也在探索一些联合措施来提高ECMO治疗效果,如有研究表明在ECMO回路中联合WBC滤过装置减少WBC总数,可获得更大生存优势[18,33-34];2017年Krawiec等[35]在ECMO治疗同时采用肺内冲击通气来帮助清除黏稠气道分泌物,从而促进1例4周龄重症百日咳患儿肺复张;Shi等[36]在ECMO治疗期间,采用俯卧位通气策略缓解了1例6月龄重症百日咳患儿的持续气道痉挛,从而增加了氧合、改善了肺顺应性。但这些案例仅为救治成功的个案报告,ECMO启动最佳时机仍无统一认识,ECMO治疗生存率总体仍较低。
6 免疫球蛋白治疗
PT在百日咳发病中起关键作用,使用含抗PT-IgG成分的免疫球蛋白,理论上是有益的,可用百日咳免疫球蛋白(P-IVIG)静脉滴注(15 mL/kg),或者静脉用免疫球蛋白(IVIG)每次400~500 mg/kg,共1~2次[37]。但临床实践中,其疗效尚存在争议,且无统一使用适应证。1991年Granström等[38]对一组3岁以下、病程14 d内的百日咳患儿研究发现,肌肉注射P-IVIG可减轻痉咳、缩短痉咳期,起病7 d内使用效果最佳,认为PT与细胞的快速结合是不可逆转的,因此需早期干预中和PT,但未提及病例的严重程度。2007年Halperin等[39]研究显示P-IVIG对减轻痉咳并无显著效果,但未提及使用时病程、有无其他并发症。2020年国内一篇有关重症婴幼儿百日咳死亡相关因素的报道认为IVIG为死亡的保护因素[2],IVIG含有多种抗其他病原体的抗体成分,可降低继发感染的风险或损害,这可能是减少死亡的原因之一。
7 糖皮质激素
糖皮质激素虽可减轻痉挛性咳嗽[37],但对重症百日咳的生存获益存在争议。2018年Cherry等[25]在对100例4月龄内的婴儿重症百日咳分析中发现,死亡组使用糖皮质激素的比例(4/5)明显高于存活组(18/95);也有研究表明糖皮质激素既不是死亡的危险因素,也不是存活的有益因素[2,16]。再考虑到,糖皮质激素可增加呼吸道分泌物,刺激骨髓造血升高WBC进而可能加重肺动脉高压,增加继发感染等潜在风险,在治疗重症百日咳时应严格把握使用适应证[37]。部分研究中的主要治疗情况详见表1中内容。
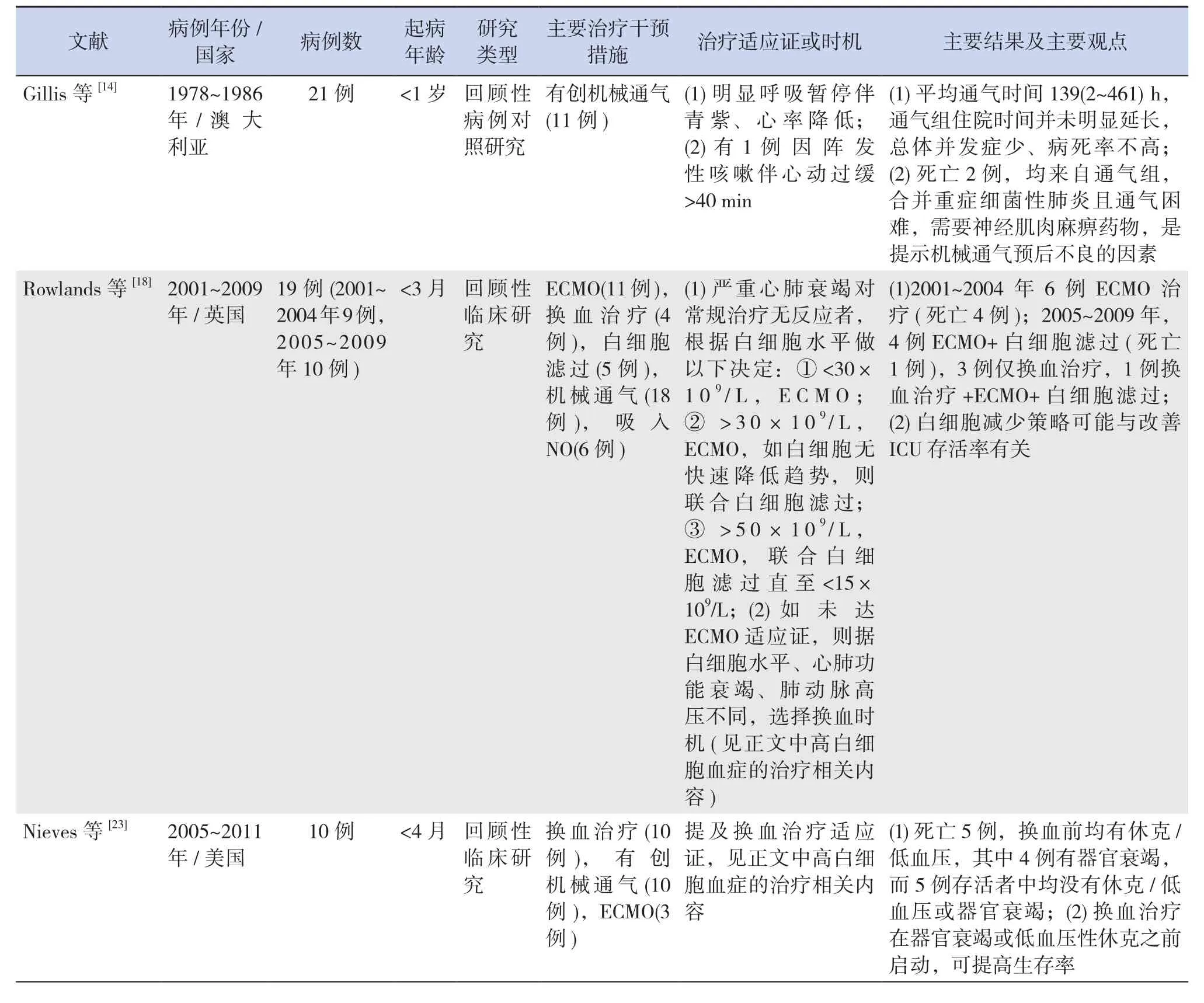
表1 不同研究中儿童重症百日咳主要治疗措施及结果
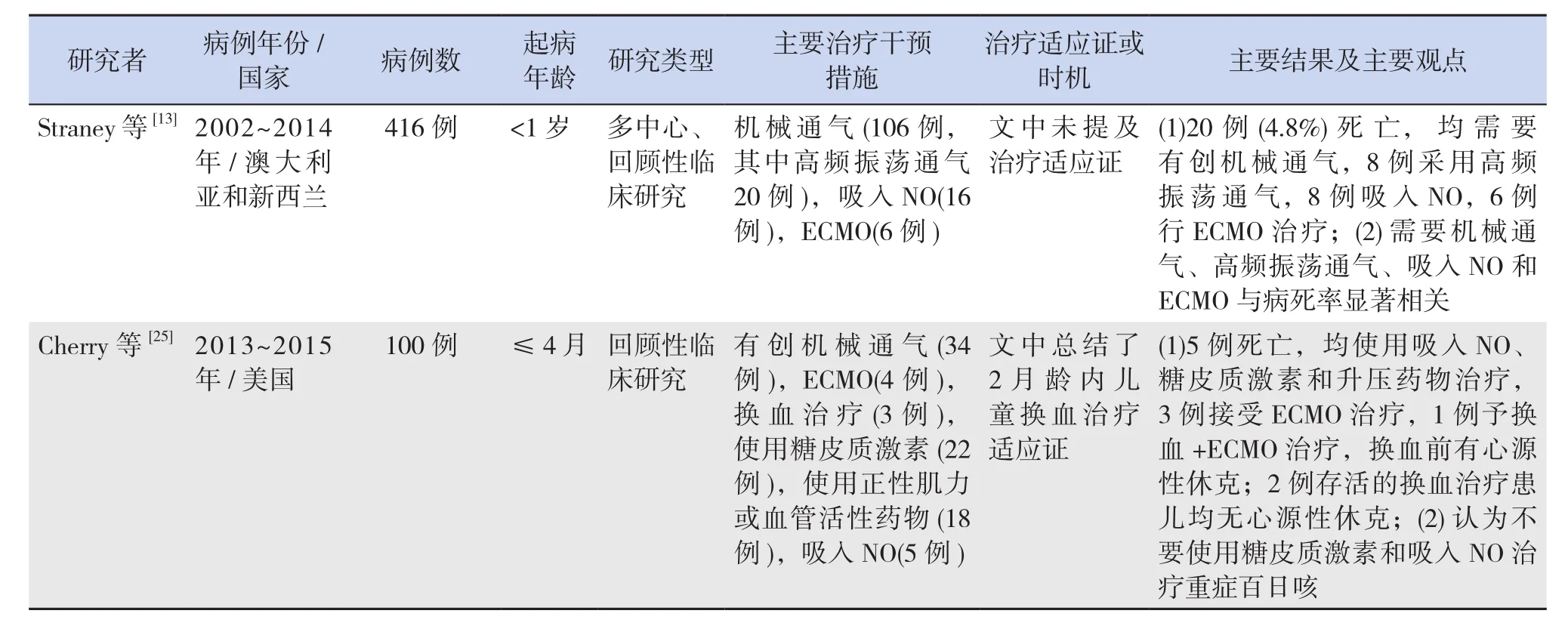
续表1
综上所述,目前临床上对重症百日咳在机械通气、换血疗法、ECMO、吸入性NO等ICU中常见救治措施,以及免疫球蛋白、糖皮质激素等治疗药物的使用适应证、治疗标准、效果评估和停用依据等方面,缺乏统一认识,总体来看疗效也不令人满意。不同研究中治疗措施的标准不统一,在此基础上开展大样本、多中心、回顾性研究来评估不同治疗方案及其疗效的可行性差。当前,重症百日咳治疗难度仍较大,及时接种百日咳疫苗,预防百日咳的发生是减少死亡最经济、有效的策略。

