双重血浆分子吸附系统在儿童急性肝衰竭中的应用
贺杰 张新萍 周雄 蔡姿丽 康霞艳 段蔚 赵文姣 肖政辉
(湖南省儿童医院重症医学科,湖南长沙 410007)
儿童急性肝衰竭(pediatric acute liver failure,PALF)是一组复杂且病情进展迅猛、可危及生命的临床综合征,是多种不同疾病的最终共同转归[1]。各国报道的病死率不一但都较高,德国Kathemann等[2]报道的单中心病死率为37.8%,中国多中心调查结果为58.06%[3],北美和英国联合的国际多中心小儿急性肝衰竭研究小组(PALFSG)报道的病死率为11%[4]。肝移植是目前挽救肝衰竭患者生命最有效的方法,可以显著提高患者的生活质量;然而因供肝难以获得及移植的复杂性,其应用受到限制[5-6]。人工肝支持系统(artificial liver support system, ALSS)因能暂时代替肝脏部分功能,创造条件等待病肝恢复功能,亦或作为等待肝脏移植的“桥梁”,成为部分肝衰竭患者最为重要的治疗手段之一。而血浆置换(plasma exchange, PE)因一方面可以清除致病毒素,另一方面可补充凝血因子等肝衰竭所缺乏的物质,成为ALSS最常用的治疗模式[7]。但目前血浆匮乏,血液制品存在传播疾病的风险。另PE时因使用血浆量大,而血浆中抗凝物质枸橼酸钠代谢后可能导致代谢性碱中毒,从而诱发或加重脑水肿,这些因素都对PE的开展带来一定的限制。而双重血浆分子吸附系统(double plasma molecular absorption system,DPMAS)是通过血浆分离器持续分离血浆,血浆进入胆红素吸附器和树脂吸附器吸附后,再经静脉通路返回体内。治疗过程不需要补充置换液或血浆,能选择性去除胆红素、炎症介质等[8],近年已成为人工肝治疗的新选择。DPMAS目前在成人已经开展较多,在儿童仍较少,目前国内仅有1例报道[9]。湖南省儿童医院重症医学科自2018年起,开展了DPMAS用于儿童PALF的治疗,总结了一定的经验,现报道如下。
1 资料与方法
1.1 研究对象
前瞻性收集2018年3月至2020年6月在湖南省儿童医院重症医学科住院的PALF患儿的资料。PALF诊断标准[10]:(1)既往无肝脏损害,8周内突发严重肝功能障碍;(2)注射维生素K1无法纠正的凝血障碍;(3)凝血酶原时间(PT)>20 s或国际标准化比值(INR)>2.0,可无肝性脑病;(4)肝性脑病合并凝血障碍,PT>15 s或INR>1.5。纳入标准为:(1)符合PALF诊断标准;(2)总胆红素(total bilirubin, TBIL)≥171 μmol/L;(3)凝血酶原活动度(PTA)≤40%,排除其他原因所致的凝血功能障碍;(4)体重≥20 kg。排除标准:(1)血小板计数低于5×109/L;(2)合并肾功能损害需要行肾脏替代治疗;(3)同时使用了ALSS的其他模式;(4)恶性肿瘤;(5)既往有血浆、肝素、鱼精蛋白过敏史者;(6)既往深静脉血栓病史。
采用随机数字表法将符合标准的患儿分为2组,分别为PE组、DPMAS组,每组各18例,研究过程中无病例脱失。所有入组患儿监护人均已签署知情同意书,并且已通过我院伦理委员会知情批准(HCHLL-2020-100)。
两组患儿治疗前性别、入组月龄、体重、儿童终末期肝病评分(PELD)、小儿危重病例评分(PCIS)比较差异无统计学意义(P>0.05),见表1。
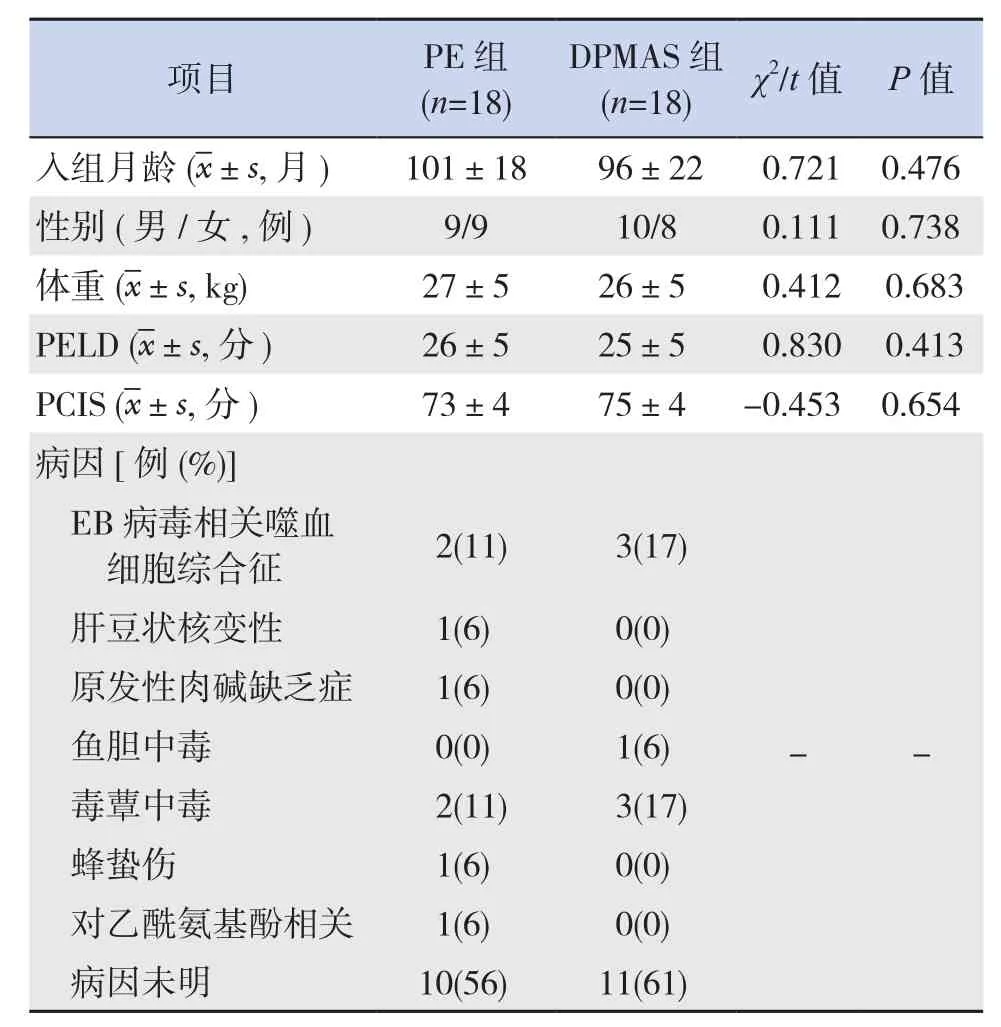
表1 两组研究对象的一般情况
1.2 人工肝主要设备
仪器为Gambro公司的Prismaflex及德国费森尤斯多功能血液净化机(MultiFiltrate);珠海健帆生物科技股份有限公司的阴离子胆红素吸附柱(BS330)和HA树脂血液灌流器(HA330-Ⅱ);血浆分离器、管路均为配套的一次性使用品。
1.3 人工肝方法
所有PALF患儿入院后均常规给予护肝、防治感染、维持水电解质平衡、肝病饮食、卧床休息等内科综合治疗。两组患儿的血管通路均采取单针双腔的股静脉置管。抗凝方式均选取肝素抗凝,抗凝目标值为活化部分凝血活酶时间(APTT)正常值的1.5~2倍或激活全血凝固时间(ACT)在180~220 s,当治疗过程中有出血倾向或APTT、ACT高于目标值时予下调或停止肝素注入。PE组:置换液采用新鲜冰冻血浆,每次置换量为50 mL/kg,时间为2 h;DPMAS组:血流速度为 3~5 mL/(kg · min),分浆率 25%,治疗持续时间为2 h。参考现行儿童人工肝支持系统指标后将TBIL≤85 μmol/L定为人工肝治疗的终点[11]。
1.4 监测指标
(1)临床指标:分别记录两组患儿的人工肝治疗次数、ICU住院时间、12周生存率。
(2)实验室指标:分别记录两组患儿第1次人工肝治疗前后的TBIL、丙氨酸氨基转移酶(ALT)、白蛋白(ALB)、凝血酶原时间(PT)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α),以及首次人工肝治疗后第2天TBIL,比较两组患儿的TBIL反弹率(total bilirubin rebound rate,TBRR)。
TBRR=(治疗后第2天TBIL -首次治疗后TBIL)/(治疗前TBIL -首次治疗后TBIL)×100%。
(3)不良反应:记录人工肝治疗过程中及治疗后的不良反应。
1.5 统计学分析
采用SPSS 22.0统计软件对数据进行分析。符合正态分布的计量资料以均数±标准差()表示,组内比较采用配对t检验,组间比较采用两样本t检验;非正态分布计量资料采用中位数(四分位数间距)[M(P25,P75)] 表示,组间比较采用两独立样本的Mann-WhitneyU检验。计数资料以例和百分率(%)表示,组间比较采用Fisher确切概率法。P<0.05表示差异有统计学意义。
2 结果
2.1 临床指标
DPMAS组人工肝治疗次数、ICU住院时间小于PE组,差异有统计学意义(P<0.05),而两组12周生存率比较差异无统计学意义(P>0.05),见表2。
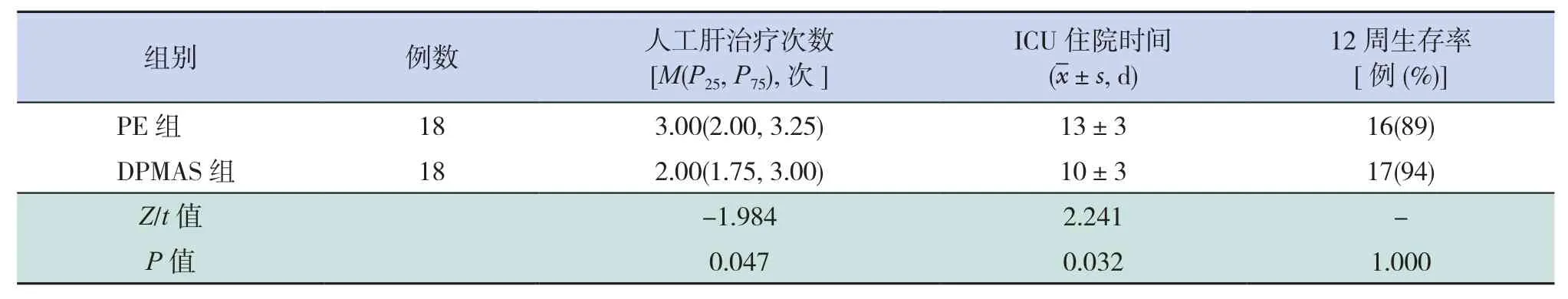
表2 两组患儿临床指标比较
2.2 实验室指标
两组治疗后 TBIL、IL-6、TNF-α均下降,DPMAS组治疗后TBIL、IL-6、TNF-α下降程度优于PE组(P<0.05);两组治疗后ALT均较治疗前下降,差异有统计学意义(P<0.05),但组间比较差异无统计学意义(P>0.05);PE组治疗后ALB上升,DPMAS组较治疗前降低(P<0.05);PE组治疗后PT缩短,DPMAS组较治疗前延长,差异有统计学意义(P<0.05)。两组治疗后TBRR差异无统计学意义(P>0.05)。见表3~4。
2.3 不良反应
两组均有不良反应发生,主要表现为皮疹、寒颤、瘙痒、一过性血压下降、管路凝血等,两组间不良反应总发生率比较差异无统计学意义(P>0.05),见表 5。
表3 两组患儿实验室指标比较 ()

表3 两组患儿实验室指标比较 ()
注: [PE]血浆置换;[DPMAS]双重血浆分子吸附系统;[TBIL]总胆红素;[ALT] 丙氨酸氨基转移酶;[ALB]白蛋白;[PT]凝血酶原时间;[IL-6] 白细胞介素 -6;[TNF-α] 肿瘤坏死因子 -α。
组别 例数 TBIL (μmol/L) ALT (IU/L)治疗前 治疗后 t值 P值 治疗前 治疗后 t值 P值PE组 18 286±80 188±73 -15.306 <0.001 352±125 172±115 -10.232 <0.001 DPMAS组 18 263±66 142±57 -13.643 <0.001 412±183 245±140 -10.551 <0.001 t值 0.900 2.064 -1.121 -1.662 P值 0.375 0.047 0.271 0.106 PT (s)治疗前 治疗后 t值 P值 治疗前 治疗后 t值 P值PE组 18 28±4 30±4 -41.652 <0.001 30±6 19±7 -15.659 <0.001 DPMAS组 18 28±3 27±3 -43.875 <0.001 28±6 32±6 -26.882 <0.001 t值 -0.111 2.193 0.966 -5.589 P值 0.912 0.035 0.341 <0.001组别 例数 ALB (g/L)组别 例数 IL-6 (pg/mL) TNF-α (pg/mL)治疗前 治疗后 t值 P值 治疗前 治疗后 t值 P值PE组 18 41±9 20±7 -12.524 <0.001 15±3 9±5 -8.415 <0.001 DPMAS组 18 43±11 15±6 -9.724 <0.001 14±8 5±4 -5.812 <0.001 t值 -0.398 2.061 0.466 2.098 P值 0.693 0.047 0.644 0.043
表4 两组患儿TBRR比较 ()

表4 两组患儿TBRR比较 ()
注:[PE]血浆置换;[DPMAS]双重血浆分子吸附系统;[TBIL]总胆红素;[TBRR]总胆红素反弹率。
TBRR(%)PE 组 18 286±80 225±79 38±13 DPMAS 组 18 263±66 179±60 32±13 t值 0.900 1.876 1.220 P值 0.375 0.069 0.231组别 例数 治疗前TBIL(μmol/L)治疗后第2天TBIL(μmol/L)
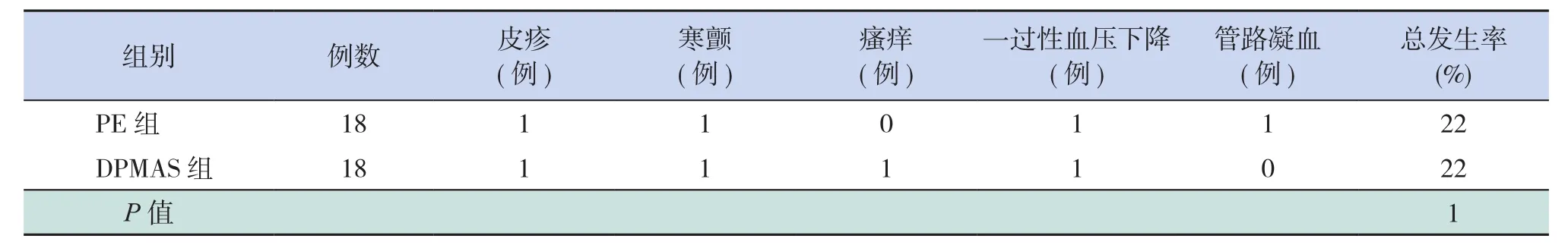
表5 两组患儿不良反应比较
3 讨论
目前,学界大多认为肝衰竭的核心发病机制是“细胞因子风暴”,导致肝细胞变性坏死的主要因素就是细胞因子,且细胞因子还与肝衰竭时肝细胞的再生抑制紧密相关[12-13]。与肝衰竭发生有关并且已经得到证实的细胞因子包括TNF-α、IL-6、白介素-1、干扰素-α等,尤其是TNF-α、IL-6这两个细胞因子被认为是介导肝衰竭发生发展过程的关键分子[14-17]。
TNF-α途径在急性肝损伤中起着关键作用,其通过损伤内皮细胞造成微血栓形成,使肝脏出现微循环异常,最终失调的TNF-α信号触发肝细胞死亡[18-19]。IL-6具有较为广泛的生物活性,大鼠动物实验表明其能够调节机体内的炎症反应程度及促进其他细胞因子的表达,从而加剧肝脏的损伤[20]。因此,降低血液中促炎细胞因子TNF-α、IL-6浓度对于减轻急性肝衰竭患儿肝损伤具有重要意义。
PE是既往临床最常应用的ALSS治疗模式,可以有效地清除脂溶性高及蛋白结合率高的肝衰竭毒素[21-22];而DPMAS是一种逐步在成人开展的新型组合型的ALSS模式,研究结果表明其应用于成年肝衰竭病人可以取得与PE相同的疗效,且能避免使用血浆带来的风险[23]。本研究结果显示,PE和DPMAS均能有效降低PALF患儿血液中TNF-α、IL-6浓度,而DPMAS较PE能更好地降低TNF-α、IL-6浓度,且差异有统计学意义。这个结果与国内常莉等[23]在成人研究结果是一致的,提示DPMAS相对PE能更有效地清除PALF患儿体内的促炎因子。推测这可能有3方面原因:其一是DPMAS单次的治疗剂量为2~3倍血浆容量[24],而PE单次治疗剂量约能清除63%的致病物质[25],显然单次人工肝治疗后DPMAS的清除效率明显优于PE;其二是DPMAS时使用的HA330-Ⅱ为树脂吸附柱,主要吸附100~700 KD分子量范围的物质,而TNF-α、IL-6正好在HA330-Ⅱ的吸附范围内[26],因而可以相对特异性的吸附TNF-α、IL-6,提高清除能力;其三是TNF-α、IL-6均为水溶性细胞因子,而PE对脂溶性高的物质清除能力更强[25],故而DPMAS对TNF-α、IL-6的清除能力更好。
本研究中两组患儿经人工肝治疗后TBIL均有下降,但DPMAS组下降更明显,PE组治疗后ALB有所升高,而DPMAS组治疗后ALB则稍有下降,PE组治疗后PT较治疗前明显缩短,而DPMAS组治疗后PT则稍有延长,差异有统计学意义。上述结果提示DPMAS较PE能更好地清除PALF患儿体内胆红素,但是会损耗血液中部分有益成分如ALB、凝血因子。这与国内许开亮等[27]、钟珊等[28]研究是相符合的。这与DPMAS的组成有关,除了HA330-Ⅱ灌流器外,还有一个特异性胆红素吸附柱(BS330),因此具有强大的吸附胆红素能力。因为血浆吸附系统不能为机体进行凝血因子、ALB等补充,并且由于其具有较强的吸附蛋白结合毒素的能力,因此会消耗体内的一部分ALB和凝血因子。
两组患儿经治疗后ALT均有明显下降,但两组间比较差异无统计学意义,两组间TBRR比较亦差异无统计学意义,与同类型其他研究结果并不完全相符合[27],可能与样本量及原发疾病谱不同有关系,成人肝衰竭多由病毒性肝炎导致,而本研究中入组的患儿肝衰竭原因大多不明确。
两组间均有不良反应发生,但均为可逆性,组间比较差异无统计学意义,而许开亮等[27]的成人研究结果则发现PE的不良反应发生率高于DPMAS,一方面可能与本研究总体不良反应发生少有关,另一方面可能与成人PE时一次需要输入的异体血浆量更大,因而更容易导致机体发生过敏反应有关。
综上所述,DPMAS治疗儿童PALF是有效的,其对胆红素、细胞因子的清除能力优于PE,且并未增加不良反应,总体而言是安全的,并且能避免使用血浆可能导致的风险如血源性感染、血浆过敏等,同时在紧急情况下又不需要受限于血源紧张,可作为儿童人工肝治疗时的一种备选新模式,但其对凝血因子和ALB等物质存在一定的损耗,必要时可以尝试DPMAS序贯PE联合治疗改善其不良影响,这将是我们后续要考虑的治疗模式,期望DPMAS能在儿童肝衰竭的治疗中发挥更好的作用。

