支气管肺发育不良早产儿振幅整合脑电图的临床意义分析
张漪 付佳敏 夏世文
(华中科技大学同济医学院附属湖北妇幼保健院新生儿科,湖北武汉 430070)
近年随着极早产儿和超早产儿存活率逐步上升,支气管肺发育不良(bronchopulmonary dysplasia, BPD)的发生率也随之上升。其中胎龄≤32周的早产儿BPD发生率达18.7%[1]。肺泡成熟障碍和肺部微血管发育不良,间歇性缺氧或慢性缺氧是BPD患儿的主要临床特征。动物实验发现BPD病程中发生的慢性缺氧可造成未成熟脑皮质生成损伤和皮质下白质容量明显降低[2]。临床研究亦发现BPD存活儿发生认知、语言和行为障碍的发生率较正常儿童明显增加[3]。
振幅整合脑电图(amplitude-integrated electroencephalogram, aEEG)是一种利用振幅整合的波谱来研究脑功能的监测技术,能够直观反映脑功能状态,且具有无创、床旁监测、操作简便等特点[4]。aEEG可以连续监测脑功能,已经广泛应用于新生儿重症监护室(NICU)[5]。研究报道,不同胎龄早产儿aEEG的成熟度与神经发育变化相一致[6-12]。本研究拟探讨BPD患儿与同胎龄非BPD患儿aEEG的临床特点,为早期评估BPD患儿脑发育情况提供参考依据。
1 资料与方法
1.1 研究对象
回顾性收集湖北省妇幼保健院新生儿科2018年1月1日至2019年12月31日住院的、出生胎龄≤ 32+6周的早产儿为研究对象,诊断BPD的早产儿设为BPD组,同时采用随机抽样方法选取同胎龄的非BPD早产儿为对照组。BPD组纳入标准:(1)出生胎龄≤32+6周,住院期间诊断BPD;(2)生后7 d内入院;(3)住院时间≥28 d;(4)在纠正胎龄37周后至少完成1次aEEG监测。采用2001年美国国立儿童健康与人类发育研究所制定的分度标准[13]:根据对氧依赖情况进行BPD分度,在纠正胎龄36周或出院时根据需氧浓度分为轻度(未用氧)、中度(FiO2<30%)、重度(FiO2≥30%或需机械通气)。对照组纳入标准:(1)出生胎龄与BPD组相近(±1周)且不符合BPD诊断标准的早产儿;(2)临床情况稳定、神经系统发育正常,住院时间≥28 d。两组排除标准:(1)先天性遗传代谢性疾病及严重先天性畸形;(2)中枢神经系统感染;(3)新生儿重度窒息;(4)≥Ⅲ度颅内出血;(5)胆红素脑病。共纳入BPD组156例,对照组156例。
1.2 相关疾病诊断
BPD和各合并症诊断标准均参照《实用新生儿学(第4版)》[14]。BPD定义为任何氧依赖(FiO2>21%)超过28 d的新生儿。小于胎龄儿(small for gestational age, SGA):出生体重在同胎龄儿平均第10百分位数以下或低于平均体重2个标准差的新生儿。脑白质损伤(white matter damage,WMD)包括脑室旁白质软化和弥散性WMD(脑白质和灰质损伤)。动脉导管未闭(patent ductus arteriosus, PDA):动脉导管持续开放。早产儿视网膜病(retinopathy of prematurity, ROP):视网膜血管阻塞或发育受阻、停止,继而视网膜缺氧继发新生血管形成(2期及以上病例纳入本研究)。坏死性小肠结肠炎(necrotizing enterocolitis,NEC):以腹胀、呕吐、腹泻、便血,严重者发生休克及多器官功能衰竭为主要临床表现,腹部X线检查以肠壁囊样积气为特征(2期及以上病例纳入本研究)。呼吸机相关性肺炎(ventilator-associated pneumonia, VAP):患儿经机械通气至少48 h,同时需结合放射、临床及实验室标准做出诊断。败血症:致病菌侵入新生儿血液循环,并在其中生长繁殖和产生毒素,从而引起的全身炎症反应综合征。
1.3 aEEG监测
采用美国尼高力(Nicolet EEG v32)视频脑电图仪记录aEEG。描记前常规清洁头皮,接通电源,校正仪器电极放置于双顶骨(相当于10~20国际电极安放法电极位置的P3和P4)处,两电极点距离为75 mm,参考电极放置距头顶中央25 mm额中线上[15]。每次连续监测4~6 h,于生后48 h内进行第1次监测,其后每2周监测1次直至出院(或监测至纠正胎龄38~39周)。对aEEG图形按背景连续性、睡眠-觉醒周期(周期性)、下边界振幅和波谱带宽跨度4个方面进行评分和成熟性评估[9-11]。采用Burdjalov早产儿aEEG评分系统[10]计算总分(表1),两组患儿的aEEG结果按照检查时间(纠正胎龄≤28+6周、29~30+6周、31~32+6周、33~34+6周、35~36+6周、37~38+6周)进行分层分析。

表1 Burdjalov早产儿aEEG评分系统
1.4 统计学分析
采用SPSS 22.0软件处理数据。正态分布计量资料用均数±标准差()表示,两组间用两样本t检验,多组间用方差分析,组间两两比较用Dunnett-t检验(非BPD组为对照);非正态分布计量资料用中位数(四分位数间距)[M(P25,P75)]表示,两组间用Mann-WhitneyU检验,多组间用Kruskal-WallisH检验,组间两两比较用Nemenyi法。计数资料用例数和率(%)表示,率的比较用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿一般资料及住院过程中并发症情况
BPD组患儿156例,平均出生胎龄(29.1±1.8)周,平均出生体重(1 231±187)g。两组患儿性别差异无统计学意义(P<0.05)。BPD组SGA、WMD、PDA、ROP、NEC、VAP及败血症发生率高于非BPD组(P<0.05),BPD组有创通气时间及无创通气时间长于非BPD组(P<0.05)。见表2。
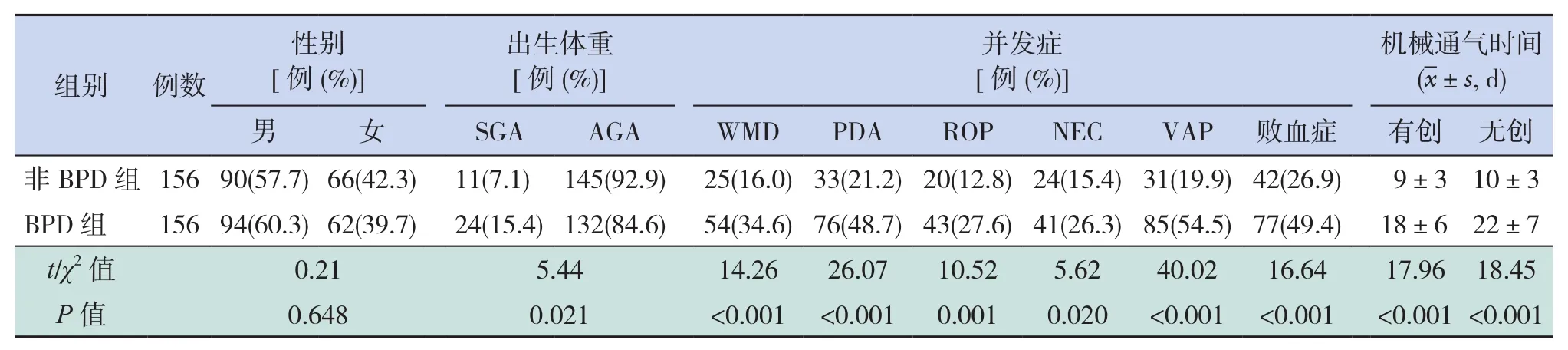
表2 两组患儿的一般资料及并发症情况
2.2 两组患儿不同纠正胎龄时aEEG总评分比较
BPD组患儿aEEG总评分仅在纠正胎龄33~34+6周时低于非BPD组(P<0.001),余不同纠正胎龄两组完成的aEEG总评分比较差异均无统计学意义(P>0.05),见表3。
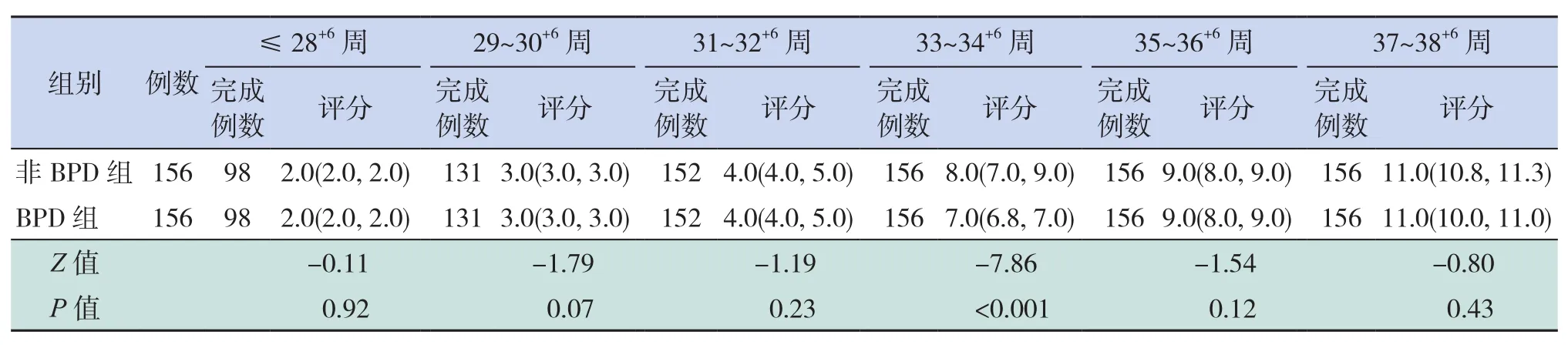
表3 两组患儿在不同纠正胎龄时aEEG总评分比较 [M(P25,P75),分]
2.3 BPD组不同出生胎龄首次aEEG各参数比较
BPD组患儿按出生胎龄≤28+6周、29~30+6周及31~32+6周分组,3组患儿的aEEG连续性、周期性、下边界振幅、波谱带宽跨度、总评分比较差异均有统计学意义(P<0.001)。出生胎龄≤28+6周的患儿aEEG连续性评分低于出生胎龄29~30+6周(P=0.009)和31~32+6周患儿(P<0.001)。睡眠-觉醒周期评分方面,31~32+6周患儿高于出生胎龄≤28+6周和29~30+6周患儿(均P<0.001)。下边界振幅评分方面,出生胎龄≤28+6周患儿评分出生胎龄低于29~30+6周(P=0.004)和 31~32+6周患儿(P<0.001)。波谱带宽跨度评分方面,出生胎龄31~32+6周患儿高于出生胎龄≤28+6周(P<0.001)和29~30+6周患儿(P=0.02)。3组aEEG总评分,两两比较差异均有统计学意义,从小到大依次为出生胎龄≤28+6周、29~30+6周、31~32+6周(P<0.05)。见表4。
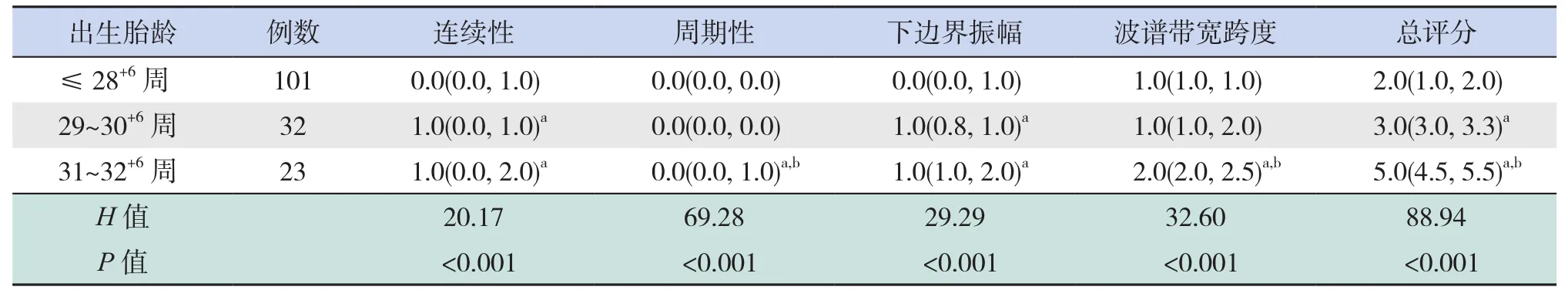
表4 BPD组患儿不同出生胎龄首次aEEG各参数评分的比较 [M(P25,P75),分]
2.4 轻、中、重度BPD患儿与非BPD患儿不同纠正胎龄aEEG总评分比较
比较轻度BPD、中度BPD、重度BPD和非BPD组患儿在各纠正胎龄的aEEG评分,发现 纠 正 胎 龄 31~32+6周、33~34+6周、35~36+6周和37~38+6周4组aEEG总评分差异均有统计学意义(均P<0.001)。其中,轻度BPD组在纠正胎龄33~34+6周的aEEG评分低于对应胎龄的非BPD组患儿(P=0.004);中度BPD组在在纠正胎龄31~32+6周、33~34+6周和 35~36+6周的 aEEG 评分低于对应胎龄的非BPD组患儿(分别P=0.001、P<0.001、P=0.001);重度BPD组患儿在纠正胎龄 31~32+6周、33~34+6周、35~36+6周 和 37~38+6周的aEEG评分低于对应胎龄的非BPD组患儿(分别P<0.001、P<0.001、P<0.001、P=0.005)。见表5。
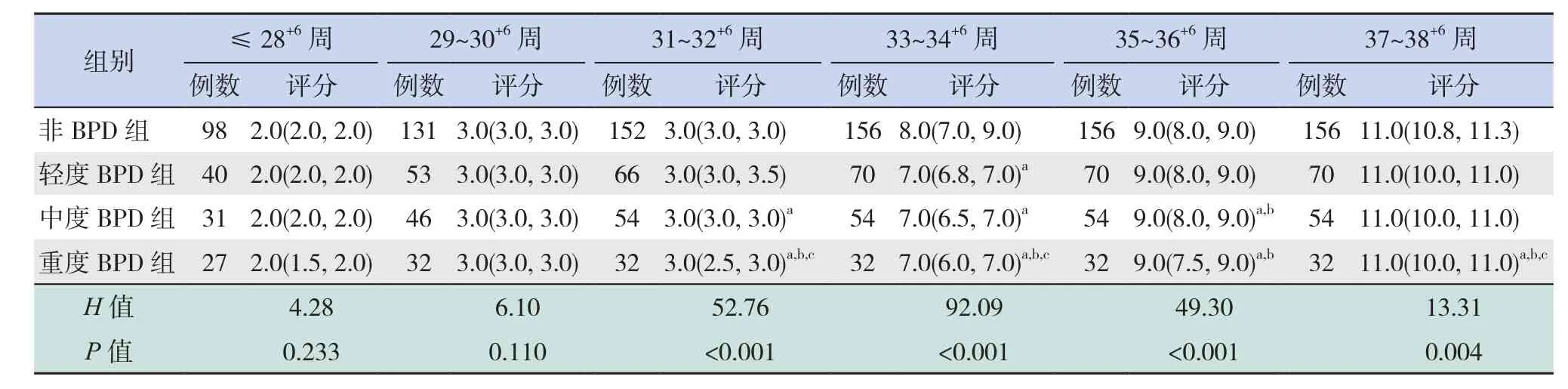
表5 4组患儿不同纠正胎龄aEEG总评分的比较 [M(P25,P75),分]
2.5 随访
BPD组与非BPD组患儿在纠正胎龄40周时各有132例及114例完成了20项新生儿行为神经测定(NBNA)评分。非BPD组NBNA评分高于BPD组(34.4±1.4 vs 33.2±1.5,t=6.30,P<0.001)。非BPD组、轻度BPD组、中度BPD组、重度BPD组的NBNA评分差异有统计学意义(P<0.001),中度BPD组和重度BPD组NBNA评分均低于非BPD组(P<0.05),见表6。
表6 4组患儿NBNA评分的比较
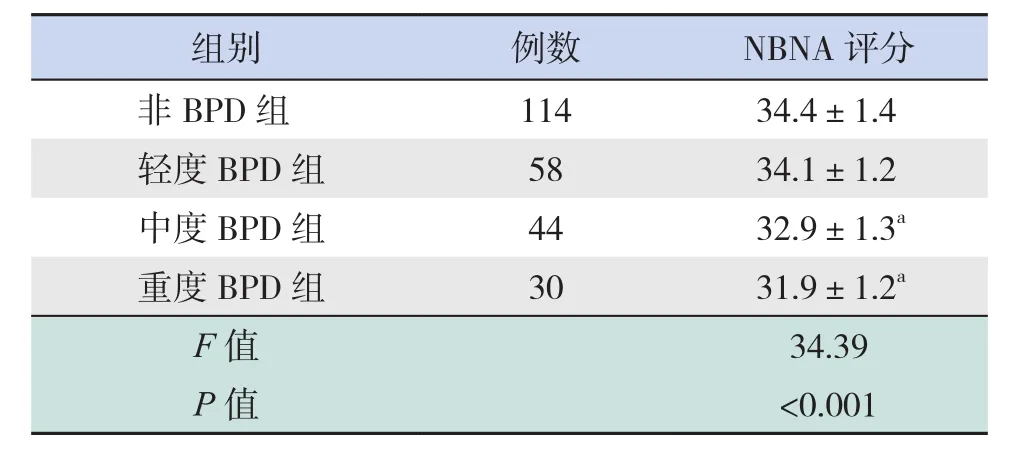
表6 4组患儿NBNA评分的比较
注:a示与非BPD组比较,P<0.05。
组别 例数 NBNA评分非BPD组 114 34.4±1.4轻度BPD组 58 34.1±1.2中度BPD组 44 32.9±1.3a重度BPD组 30 31.9±1.2a F值 34.39 P值 <0.001
纳入本研究的BPD患儿中仅有76例随访至1岁,中、重度BPD患儿中死亡7例,34例随访至1岁。但由于出院后行aEEG检查需留院时间较长,且与其他随访项目不能同时进行,家属多选择做头颅MRI等影像学检查及相关神经行为学随访评估,仅11例接受了出院后aEEG检查,故本研究未能将该结果纳入。
3 讨论
除围生期高危因素、严重脑损伤疾病等可导致早产儿神经发育障碍[16-17],BPD同样可能导致神经细胞发育过程受损、脑瘫等不良并发症风险增加[18]。早产儿脑组织具有丰富的轴突和树突分支,神经胶质分化和髓鞘形成敏感,而病程中长时间用氧可能使BPD早产儿更易出现脑损伤[19]。BPD病程中的慢性缺氧和感染可能是引起BPD患儿脑损伤的重要因素,与非BPD患儿相比,BPD早产儿更易存在神经发育不良的高危风险[20-21]。
通过aEEG图形变化可以定性评价早产儿脑发育,也可以通过aEEG的连续性、周期性、下边界振幅和波谱带宽跨度组成的评分系统,定量评价早产儿脑发育成熟度,结果可靠[22]。本研究对出生胎龄≤32+6周的BPD早产儿生后脑成熟度进行评估,发现出生胎龄越大,aEEG越成熟。既往有较多学者研究了无神经异常的早产儿生后aEEG波形的变化规律,分析了不同出生胎龄和纠正胎龄早产儿aEEG振幅的参考值,并指出随出生胎龄和纠正胎龄增加,连续性及睡眠-觉醒周期的成熟度比例增加,振幅下界逐渐上移,波谱带宽跨度逐渐变窄[23-25]。本研究中BPD组早产儿aEEG特点与此规律一致。目前针对BPD患儿的神经系统问题的研究,主要集中在神经系统晚期发育及预后等方面,缺乏利用辅助手段来预测及早期评估BPD患儿相关神经系统异常的研究[26-28]。有研究发现在纠正胎龄34~35周早产儿中开始出现aEEG高评分,表明34周后可能是睡眠周期和其他指标趋向成熟的起点[29]。本研究利用aEEG图形研究发现BPD组中仅纠正胎龄33~34+6周患儿aEEG评分低于非BPD组,其他纠正胎龄评分差异无统计学意义,表明BPD患儿在纠正胎龄33~34+6周时神经系统发育并不成熟,且落后于非BPD组,约2周后方可追赶上同胎龄的非BPD早产儿。
由于本研究排除了28 d内死亡病例,故未采取2018年美国国立儿童健康与人类发育研究所的分度标准[30],而是按目前临床上应用更普遍的2001年NICHD标准进行BPD分级,将BPD组患儿分成轻、中、重度3组,分别与同胎龄非BPD组患儿进行比较,发现轻度BPD患儿神经成熟情况除纠正胎龄33~34+6周外其余时段无明显差别,而中重度BPD患儿会更早(纠正胎龄31~32+6周)出现神经发育落后,并且神经成熟度的追赶时间延长,重度BPD患儿甚至在纠正胎龄37~38+6周时神经系统成熟度仍未达到同胎龄非BPD早产儿水平。有研究证实,中重度BPD可加重早产儿脑白质损伤程度和脑干听觉神经损伤,增加早产儿6个月时神经行为障碍发生率[31]。本研究亦发现中重度BPD的早产儿脑损伤更严重,与之相符。
此外,本研究仍存在不足,首先,未分析两组患儿母孕期病史,患儿生后的喂养、用药史及体格发育情况,这些可能是影响患儿神经系统发育及aEEG的混杂因素。其次,本研究为回顾性研究,存在部分数据缺失。最后,本研究仅分析了两组患儿的aEEG评分,未结合头颅超声、MRI结果及神经行为学检查等指标,对早产儿神经发育的评估存在一定的局限性。
早产儿神经发育轨迹具有不一致性与可塑性,本研究探讨了出生胎龄≤32+6周BPD患儿的aEEG随着纠正胎龄增长的变化特点及临床意义,提示中重度BPD早产儿更容易出现神经行为发育落后。研究显示,BPD患儿出院时容易发生宫外发育迟缓、头围增长相对缓慢,而且纠正胎龄6月龄及9月龄运动发育落后于非BPD早产儿[26]。在纠正年龄1岁时即表现出认知发育迟缓,在纠正年龄2岁时认知发育迟缓更加显著[28]。提示临床医生需注意动态监测该类患儿的神经系统发育,有助于早期及时干预,而aEEG可以作为早期评估的方法之一。

