自噬基因结肠癌预后模型建立及验证*
王竣立 陶成成 乔玲 游江舟 李昌龙
(四川大学华西基础医学与法医学院生物化学教研室,四川 成都 610041)
根据2018年的全球癌症统计数据,结肠癌的全球发病率排名第三,死亡率在所有癌症中排名第二,且发病率和死亡率都有逐年上升的趋势[1]。临床上影响结肠癌预后的风险因素变化多样,包括患者的年龄、生活习惯、肿瘤发生的部位、其生物学特性及肿瘤的分期。近年来我国结肠癌的发病率呈快速增长趋势,虽然手术、放化疗、靶向治疗等在一定程度上延长了结肠癌患者的生存时间,但治疗后肿瘤局部复发和转移的发生率仍较高。因此,有效预测复发倾向和预后水平在结肠癌治疗中具有重要意义。在肿瘤的发生发展过程中,自噬有着双向调控的作用,根据细胞基因组成和细胞所处环境的变化,自噬既能抑制肿瘤的发生发展,同样也参与了肿瘤的进程与耐药[2-3]。研究通过癌症基因组图库(The Cancer Genome Atlas, TCGA)数据库中提取转录组测序信息,筛选与结直肠癌预后相关的自噬基因,并构建其风险计算模型,以期对临床结直肠癌的预后分析和前期治疗提供靶向治疗思路。
1 资料与方法
1.1 结肠癌差异自噬基因筛选与功能分析 使用TCGA数据库收集结肠癌转录组及生存信息,将转录组原始基因代码转换成基因名称,整合患者年龄、性别、癌症分期、转移状况和生存状况等多项数据。使用R语言wilcox检验筛选出结直肠癌差异自噬基因,筛选条件为P<0.05。在GO以及KEGG pathway 数据库中,对差异表达自噬基因进行信号通路以及功能的富集分析,GO富集分析是对差异表达的自噬基因进行GO分类,基于离散分布显著性、误判率和富集度的分析,得出与样本显著相关的、低误判率的、靶向性的基因功能分类,初步预测差异基因的功能。KEGG pathway 分析是通过KEGG数据库以及Biocarta来进行分类,对通路中的基因进行显著性分析,得到与样本有显著关联的信号通路,预测其功能。
1.2 模型构建 首先对差异表达的自噬基因进行单因素Cox风险回归分析,初步筛选出对结肠癌预后可能具有影响的自噬基因,筛选条件为P<0.05。然后对单因素Cox风险回归分析筛选出的差异表达基因进行多因素Cox比例风险回归分析,依据回归系数(β)及风险比(hazard ratio,HR)来识别保护(HR<1)和危险(HR>1),同时筛选出了高风险自噬差异基因,以上述基因表达量为自变量,患者生存时间与生存状态作为因变量,使用COX-PH函数构建自噬基因预后模型。
1.3 模型验证及临床相关性分析 以患者风险值与生存状态绘制生存曲线;将患者风险值由低到高绘制风险曲线;结合患者生存状态以及参与模型构建的风险自噬基因表达量,综合验证所构建预后模型是否能作为结肠癌预后独立危险因子。将参与模型构建的自噬基因与模型所得危险因子与患者癌症分期、年龄、性别、是否转移进行相关性分析。
1.4WIPI2、RAB7A基因的验证
1.4.1 细胞株和主要试剂 人结肠细胞NCM460与人结肠癌细胞HCT116、RKO(ATCC);胎牛血清(Hyclone,美国);DMEM培养基(Biological Industries,以色列);1%青霉素-链霉素(Hyclone,美国);PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)逆转录试剂盒(TaKaRa,日本);TB Green PCR Mix(TaKaRa,日本);Trizol(碧云天,中国)。
1.4.2 Real-time PCR检测正常结肠细胞与结肠癌细胞中WIPI2、RAB7A基因表达水平,分别使用正常结肠细胞(NCM460),两株结肠癌细胞(HCT116、RKO)。传代培养至密度80%时,提取正常结肠细胞和结肠癌细胞总RNA,使用PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)逆转录试剂盒逆转录为cDNA,以此cDNA为模板,GAPDH基因为内参,进行Real-time PCR。Real-time PCR反应体系为:25μL总反应体系中TB Green PCR Mix 12.5μL,上、下游引物分别为1μL,cDNA模板1μL,dd H2O 9.5μL。反应条件:预变性95℃ 30s;变性95℃ 5s,退火延伸60℃ 30s,共35个循环。按2-ΔΔCt法进行相对定量分析。
引物序列如下:RAB7AForward:5′-GTGATGG TGGATGACAGGCTAG-3′,RAB7AReverse:5′-AG TCTGCACCTCTGTAGAAGGC-3′;WIPI2 Forward: 5′-CGACAACTGCTACTTGGCGTAC-3′,WIPI2 Reverse: 5′-AGTGCCGCTAAAGGACTGTCGT-3′;GAPDHForward:GAGTCAACGGATTTGGTCGT,GAPDHReverse:GACAAGCTTCCCGTTCTCAG。设正常结肠细胞的相对表达量为1。
2 结果
2.1 筛选结肠癌差异表达自噬基因 利用TCGA数据库中收集到的正常样品42例,肿瘤样品482例,进行wilcox检验,筛选出结肠癌相关差异表达自噬基因共34个,其中上调基因16个,下调基因18个(图1A)。红色为高表达基因,绿色为低表达基因;离散程度代表基因差异表达程度。如图1B,红色为高表达基因,绿色为低表达基因,亮度越高,表达差异程度越大,具体的的logFC,P value,FDR(见表1)。其中HSPB8,NKX2-3,NRG2,TP53INP2等上调最为显著,这些上调基因除参与自噬外,与信号传导,基因的异常表达,药物抵抗有着密切相关[4-7],相反CDKN2A,ATG9B等显著下调的基因与肿瘤抑制,细胞周期调节等也有一定相关性[8-9]。
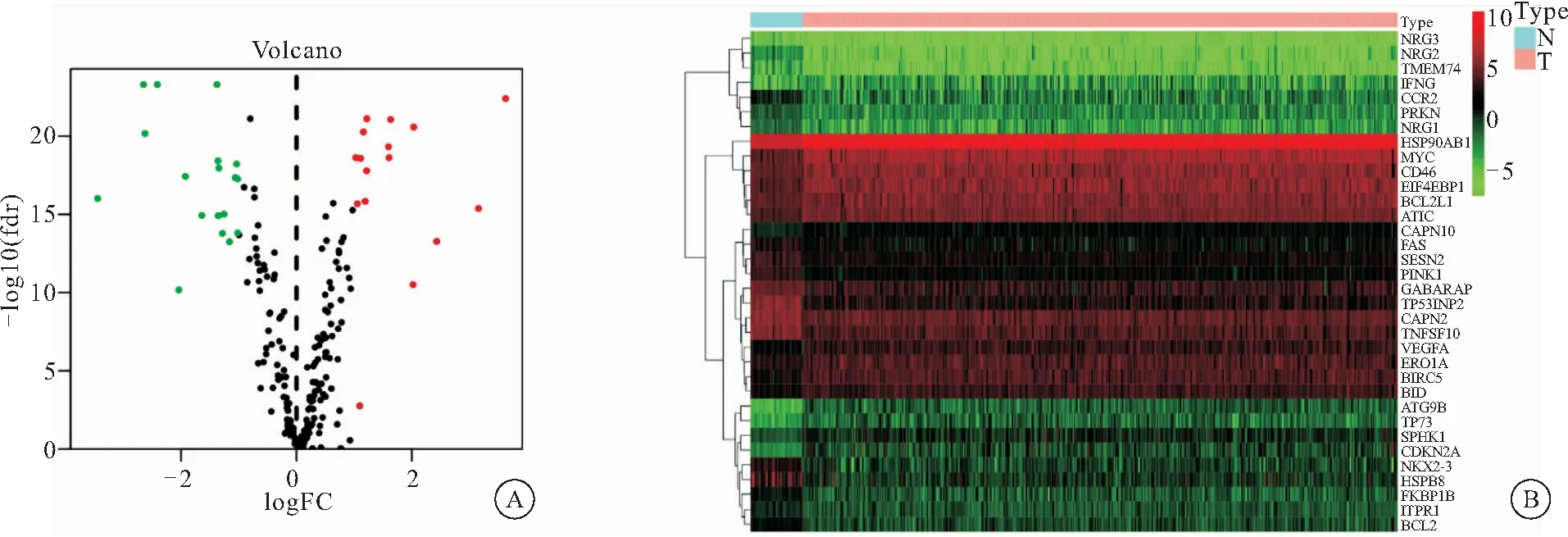
图1 结肠癌差异表达自噬基因
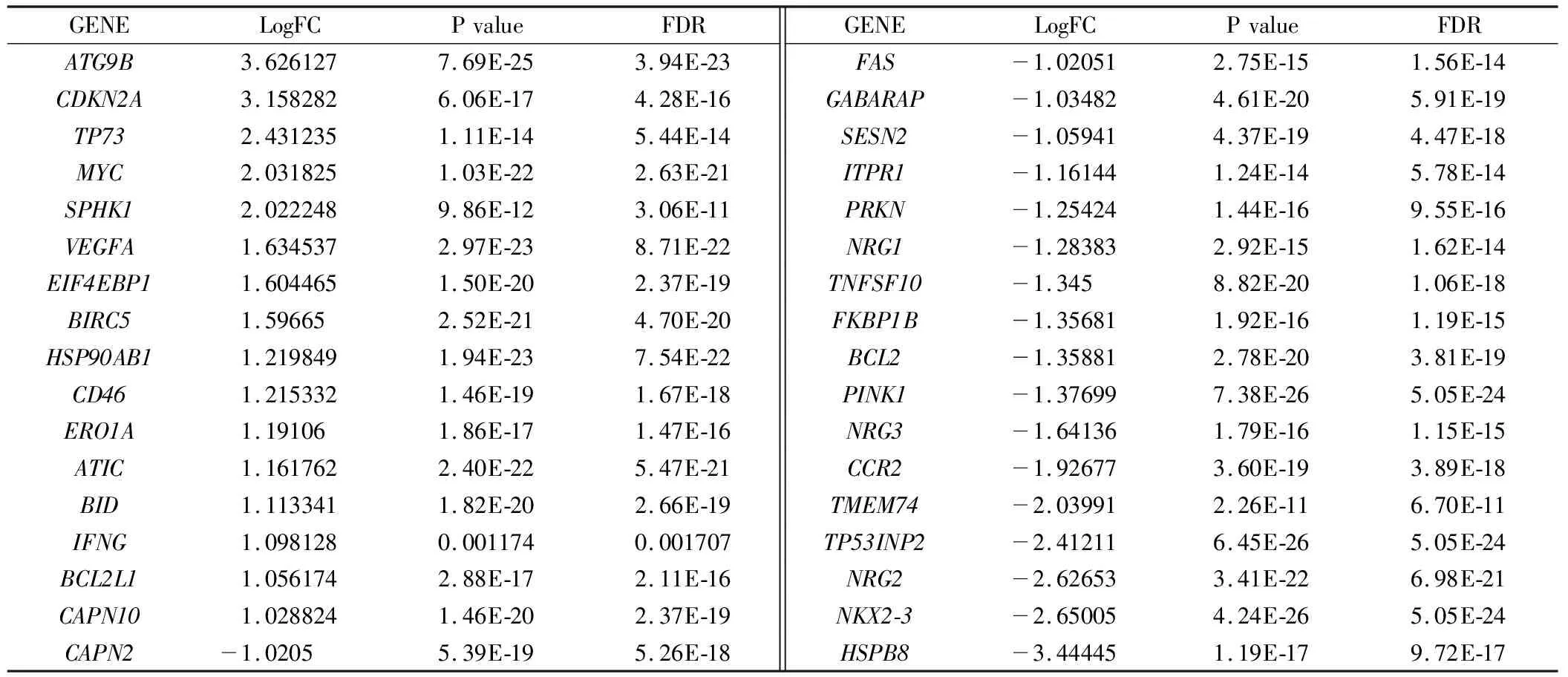
表1 结肠癌相关差异表达自噬基因
2.2 GO与KEGG富集分析 对筛选出的差异表达自噬基因进行GO以及KEGG功能预测。GO分析的结果显示,差异表达自噬基因除主要富集在自噬功能以外,在细胞的氧化应激过程,细胞凋亡过程,线粒体膜反应以及细胞色素c的释放等功能上均有10个以上差异基因的富集(P<0.05),见图2A。KEGG信号通路分析共得到30条有显著差异的信号通路,主要集中在自噬、P53信号通路、凋亡、顺铂类药物拮抗、EGFR酪氨酸酶抑制剂拮抗等(P< 0.05),见图2B。count值代表富集基因数,count值越大,气泡面积越大,富集基因越多;由蓝到红,P值越来越小,下同。
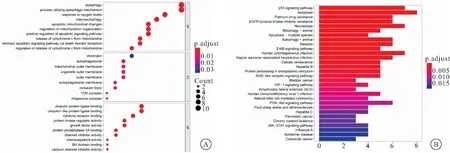
图2 GO与KEGG富集分析结果图
2.3 筛选与结肠癌预后相关的自噬基因
2.3.1 单因素COX分析 通过单因素COX分析,将自噬基因表达量与患者生存时间与生存状态进行联合分析,以P<0.05作为阈值,筛选出与结肠癌患者预后相关的10个自噬基因,见表2。

表2 单因素COX回归分析
2.3.2 多因素COX分析及模型构建 利用多因素COX比例风险回归分析,筛选出5个高风险自噬基因分别为WIPI2,RAB7A,ULK3,PELP1,DAPK1,见表3。HR值小于1的是WIPI2,ULK3,PELP1。HR值大于1的是RAB7A,DAPK1。利用筛选出5个高风险自噬基因构建结肠癌预后COX风险回归模型,见图3。回归系数(Coef)分别为WIPI20.613249,RAB7A1.067329,ULK30.475059,PELP10.338861,DAPK10.298811。其中RAB7A基因对本模型风险值的贡献最大,其次是WIPI-2。
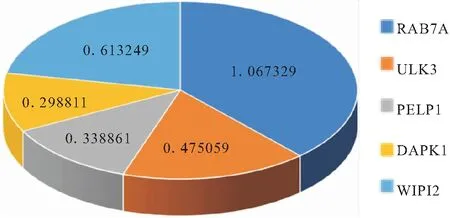
图3 结肠癌预后COX风险回归模型

表3 多因素COX回归分析
2.4 结肠癌预后COX风险回归模型验证 基于所构建的预后风险回归模型,按照中位数将所有患者划分为高低风险两组,并绘制出生存曲线,见图4A。红线代表高风险组,蓝线代表低风险组。结果显示,高风险值患者生存率与低于低风险值患者,且差异有统计学意义(P<0.001)。将风险值从低到高排序,绘制风险曲线、患者生存状态以及模型基因表达量的热图(图4B、C、D)。结果显示,随着风险值的升高,患者死亡比例升高。结肠癌预后风险回归模型中,自噬基因RAB7A的表达与风险值呈正相关,自噬基因WIPI2,ULK3,PELP1,DAPK1的表达与风险值呈负相关。

图4 结肠癌预后COX风险回归模型验证结果
2.5 本模型与临床常见预后评估因素的比较 结合结肠癌临床常见的预后评估因素,如患者年龄、性别、肿瘤分期、是否转移等各项生存指标,对本研究所构建模型得到的患者风险值进行单因素以及多因素的独立预后分析。结果显示,与临床常见预后评估因素相比,本研究所构建模型单因素分析HR值为1.464(P<0.001),多因素分析HR值为1.377(P<0.001),证明其可以作为独立的预后因子,见图5。

图5 本模型与临床常见预后评估因素的比较
2.6 结肠癌预后COX风险回归模型临床相关性分析 将本模型中自噬基因的表达量与患者的年龄,性别肿瘤分期,是否转移等情况进行相关性分析。结果显示,RAB7A的表达量与结肠癌分期呈正相关,与患者年龄呈负相关;WIPI2与癌症分期呈正相关。模型所得危险因子与癌症分期有相关性,见图6。

图6 结肠癌预后COX风险回归模型与临床相关性
2.7 人正常结肠细胞与人结肠癌细胞中WIPI2、RAB7A基因表达水平的变化 Real-time PCR检测结果(图7)显示,与人正常结肠细胞NCM460相比,人结肠癌细胞HCT116、RKO中WIPI2、RAB7A基因的表达水平均升高,且差异有统计学意义(P<0.05)。
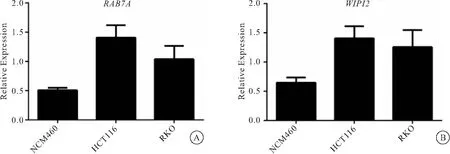
图7 人正常结肠细胞与人结肠癌细胞中WIPI2、RAB7A基因表达水平的变化
3 讨论
近年来,结肠癌的诊断与治疗水平随着直肠镜技术的发展以及各种抗癌靶向药物的研发有了长足的进步[10]。根据加拿大癌症协会的报道,结肠癌发病率位于全球恶性肿瘤中第3,死亡率位于第4[11-12],相对于诊断与治疗水平的较快发展,结肠癌预后的研究仍较为缺乏。最新研究发现,结肠癌与自噬有着密切的关系[13-16],使用免疫组化技术对结肠原发肿瘤进行检测发现了分子伴侣介导自噬(CMA)水平的升高[17-18],在结肠癌细胞系HCT116中,TP53的沉默会导致网状吞噬和有丝分裂吞噬,起到保护肿瘤细胞的作用。现有研究表明,结肠肿瘤的形成与自噬过程降解片段极性蛋白(DVL)后导致WNT信号通路的异常激活有关[19]。以上研究均提示自噬相关信号通路的关键基因可能成为结肠癌诊断、治疗以及预后的重要研究方向。目前,结肠癌预后的判断主要是通过对肿瘤侵袭深度[20]、淋巴结转移[21]、血管浸润[22]、血清癌胚抗原[23]等做出诊断。癌症分期与转移情况被普遍认为是比较好的预后指标,但仍然有特异性不高,鉴别困难等缺点。
本研究就自噬相关基因与结肠癌预后的关系进行生物信息学分析,首先对比482例结肠癌肿瘤样本与42例正常样本的自噬基因表达,发现了35个差异表达的基因;再利用COX比例风险回归分析,筛选出5个高风险自噬基因:WIPI2,RAB7A,ULK3,PELP1,DAPK1。利用这五个高风险自噬基因构建结肠癌预后COX风险回归模型可知:RAB7A基因对本模型风险值的贡献最大,其次是WIPI-2。RAB7A是Ras超家族中的一员,起到调节膜的转运和溶酶体的转运,以及调节生长受体的内吞作用中吞噬体和自噬空泡的产生,转运,成熟过程[24-25]。RAB7A参与许多的细胞过程[26-28],被称为癌症的先导角色[29]。研究表明,抑制RAB7A有效消除了结直肠癌干细胞,并且破坏了癌灶,提示RAB7A可作为结直肠癌靶向治疗的新靶点[30]。WIPI2功能主要是作为自噬体形成的早期蛋白,辅助ATG12-ATG5-ATG16L1复合物的形成,调控新生自噬体膜伸长的过程[31]。
基于所得生存曲线(图4A)可知,高风险组病人生存期较低风险组病人显著缩短(P<0.05),由风险值与病人生存状态所得散点图(图4B)可知,风险值较高的病人,死亡比例明显高于低风险值病人,并且随着风险值的升高,参与构建计算模型的自噬基因表达呈现出明显的趋势,说明模型构建与实际病人生存状况、基因表达状况相符合。同时为了检验本模型相较于传统癌症分期转移等预后指标的临床意义,将常见患者临床预后评估因素,与模型所得风险值进行了单因素以及多因素的独立预后分析。在单因素分析过程中,模型与肿瘤分期与病人预后均显著相关,且均一性更好,误差更小;在多因素独立预后分析中,所构建模型的预后预测作用显著优于其他临床指标,说明本模型可作为结肠癌独立预后因子;构建模型所使用的自噬基因的表达,多与癌症分期有着显著地相关性,提示其在结肠癌发生发展过程中可能起到了重要作用,是潜在的结肠癌诊断以及治疗靶点。对在本模型风险值贡献最大的RAB7A基因及WIPI2基因在人正常结肠细胞(NCM460)与人结肠癌细胞(HCT116、RKO)中进行Real-time PCR检测其表达水平,发现RAB7A、WIPI2基因在结肠癌细胞(HCT116、RKO)中高表达,提示RAB7A、WIPI2基因可能还参与了结肠癌的发生发展。
4 结论
本研究利用COX风险回归模型构建了基于自噬基因表达水平的结肠癌预后模型,该模型相对于传统预后预测指标更准确稳定,通过该模型筛选出的差异表达自噬相关基因可作为结肠癌预后的独立危险因子,辅助临床对结肠癌患者预后进行更准确的预测。

