调控微小RNA-17-92表达对血吸虫病大鼠肝纤维化的抑制作用▲
郭忠欣 李兰花 康 慨 李雪飞 吕亚辉 朱 伟
(1 北京师范大学医院公共卫生科,北京市 100875,电子邮箱:gcm580@163.com;2 潍坊医学院公共卫生学院流行病教研室,山东省潍坊市 261053)
血吸虫病是一种临床较为常见的慢性感染性寄生虫疾病,在数十个非洲、亚洲、拉丁美洲国家流行,而在我国血吸虫病主要在长江流域及其以南地区流行[1-2],该病可对患者健康、生活质量造成严重威胁[3-4]。血吸虫病的主要临床表现为发热、咳嗽、胸痛、血痰、腹泻、肝区疼痛、腹痛、侵入部位皮炎等,疾病发展还可导致消化道出血、腹腔积液、肝纤维化等并发症的发生[5-7]。临床上治疗血吸虫病的常用手段为药物治疗,但是尚无特效药物用于治疗血吸虫病所致的肝纤维化,因此寻找治疗抑制血吸虫病肝纤维化的新靶点成为目前临床医学的研究热点之一。本研究建立血吸虫病大鼠模型,并靶向调控微小RNA(mircoRNA,miRNA)-17-92表达,旨在探讨调控miRNA-17-92表达对血吸虫病大鼠肝纤维化的干预作用及相关机制。
1 材料与方法
1.1 实验动物 选取40只SD健康雄性大鼠,由华兰生物工程股份有限公司提供,动物许可证号:SYXK(豫)2018-0014。鼠龄8~11(9.5±1.2)个月,体重230~247(238.5±6.8)g。在相对湿度50%~55%、温度(23.1±1.9)℃的环境中喂养1周,光照12 h/d。
1.2 主要试剂 Lipofectamine 2000试剂购自滁州仕诺达生物科技有限公司(批号:SND464);miRNA-17-92模拟物购自上海易汇生物科技有限公司(批号:CL-0005),miRNA-17-92抑制物购自北京达科为生物技术有限公司(批号:MA-0102);兔抗小鼠透明质酸抗体、兔抗小鼠Ⅲ型前胶原(typeⅢ procollagen,PCⅢ)抗体购自上海广锐生物科技有限公司(批号:2013-11213、2013-1397),兔抗小鼠层粘连蛋白抗体购自上海瓦兰生物科技有限公司(批号:E03551);大鼠抗小鼠白细胞介素(interleukin,IL)-2抗体、大鼠抗小鼠IL-22抗体购自上海科敏生物科技有限公司(批号:bs-4586R、bs-2623R);兔抗小鼠活性氧簇抗体、兔抗小鼠8-羟基脱氧鸟苷(8-hydroxy-2′-deoxyguanosine,8-OHdG)抗体购自上海梵态生物科技有限公司(批号:FT-T21239P、FT-P36089R);RNA提取试剂盒、反转录试剂盒、miRNA-17-92 RT-PCR试剂盒均购自QIAGEN公司(货号:217184、218161、218193);小鼠抗兔miRNA-17-92、转化生长因子β受体Ⅲ(transforming growth factor β receptor type Ⅲ,TGFβRⅢ)抗体购自亚科因(武汉)生物技术有限公司(批号:A25022-1、ABP57480);大鼠抗小鼠Smad2、Smad3抗体购自武汉菲恩生物科技有限公司(批号:FN-ER0645、FNab07994);大鼠抗小鼠磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)、蛋白激酶B(protein kinase B,Akt)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抗体购自武汉菲恩生物科技有限公司(批号:FN-ER1910、ER1857、ER1520);山羊抗兔IgG购自上海晶风生物科技有限公司(批号:TF-0295G-SA)。
1.3 建模、分组和干预方法 采用随机数字表法选取10只大鼠作为正常组,不做处理。其余30只大鼠建立血吸虫病模型:将大鼠腹部小块区域被毛去除,采用生理盐水湿润裸露皮肤,显微镜下计数60条血吸虫尾蚴(购自江苏省血吸虫病防治中心),贴盖在大鼠裸露皮肤处,持续10 min,以皮肤可见多处点状充血为建模成功。20 d后将30只血吸虫病大鼠模型随机分为血吸虫病组、上调组、下调组各10只。利用Lipofectamine 2000试剂将miRNA-17-92模拟物、miRNA-17-92抑制物稀释为5 mmol/L的浓度,然后通过尾部静脉分别注射入上调组、下调组大鼠体内,正常组、血吸虫病组大鼠经尾部静脉注射等量生理盐水,各组的注射剂量均为1 mL/次,间隔12 h注射一次,共2次。注射结束后24 h检测相关指标。
1.4 指标检测
1.4.1 获取标本:对各组大鼠进行麻醉(25%乌拉坦,0.5 mL/100 g,腹腔注射)处理后,颈椎脱臼法处死,取各组大鼠腹部静脉血3 mL,室温下静置2 h,4℃下2 000 r/min离心15 min后分离上清液,在-80℃环境中保存待检,并留取肝脏组织用于后续实验。
1.4.2 观察肝脏组织病理学:取大鼠肝脏组织固定在4%甲醛中,完全浸泡,于24 h后行常规石蜡包埋及连续切片。将切片烤干后进行脱蜡处理,之后顺序置入不同浓度乙醇中各水化3 min。使用苏木精染色15 min后采用TBST清洗3次(5 min/次),使用盐酸乙醇溶液分化处理30 s,充分清洗后使用1%伊红染色,使用不同浓度乙醇进行脱水处理后进行脱蜡处理,封片后使用显微镜(深视光谷仪器有限公司,型号:SGO-KK209)进行观察。
1.4.3 检测血清中肝功能、肝纤维化指标水平:使用全自动生化分析仪(深圳市新产业生物医学工程股份有限责任公司,型号:VDVIA3500)检测血清中肝功能指标,γ-谷氨酰转移酶(gamma-glutamyltransferase,GGT)、ALT、AST水平;采用放射免疫分析法,使用相应试剂检测血清中肝纤维化指标,透明质酸、PCⅢ、层粘连蛋白水平。严格按照试剂说明书步骤进行操作。
1.4.4 检测血清中氧化应激、炎症反应指标水平:将血清标本、稀释液以及检测卡平衡至24℃,对检测卡进行编号后置于平台之上,配制标准液并按照1 ∶10比例对待测标本进行稀释。酶标板中添加100 μL血清标本或标准液,混合均匀后在恒温箱(37℃)中静置0.5 h,采用TBST缓冲液洗板3次(5 min/次),每孔中添加50 μL一抗以及50 μL蒸馏水,混匀后37℃环境中静置0.5 h。采用TBST缓冲液洗板3次(5 min/次)后每孔中添加100 μL酶标抗体,37℃环境中静置10 min,采用TBST缓冲液洗板3次(5 min/次)后每孔中添加100 μL底物液,37℃、阴暗环境中静置15 min后每孔中添加100 μL终止液混匀,使用酶标仪(赛默飞公司,型号:Varioskan LUX)检测波长为450 nm处的吸光值。
1.4.5 实时PCR法检测肝组织miRNA-17-92的相对表达水平:提取肝脏组织总RNA,检测RNA纯度、含量,反转录处理后获得cDNA。使用Primer5.0软件设计引物。miRNA-17-92上游引物序列为5′-GTGCAGGGTCCGAGGT-3′,下游引物序列为5′-GTGTTCAAAGTCTTACCGTGC-3′;内参U6上游引物序列为5′-GGGGACATCCGATAAAATTGG-3′,下游引物序列为5′-GATTTGTGCGTGTCATCATCCTTG-3′。PCR仪购自杭州朗基科学仪器有限公司(型号:T30D)。配置反应体系,包括0.4 μL上下游引物、1 μL cDNA模板、10 μL SYBR Green,加蒸馏水至20 μL。反应条件为97℃预热8 min、95℃变性5 s、60℃退火31 s,共进行40个循环。采用2-△△Ct方法计算出miRNA-17-92的相对表达量。
1.4.6 蛋白免疫印迹法检测TGF-β/Smads通路、PI3K/Akt通路的蛋白相对表达水平:将各组大鼠肝脏组织剪碎后加入裂解液裂解30 min,然后3 000 r/min离心处理10 min(离心半径3 cm),取上清液,提取50 μg蛋白,煮沸5 min使蛋白变性后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,然后依据蛋白分子大小把凝胶切开并转移至聚偏二氟乙烯膜上,采用Western封闭液室温封闭90 min;按比例稀释一抗(待测蛋白抗体按1 ∶1 000,内参抗体按1 ∶2 000)后4℃孵育过夜,使用Western洗涤液洗涤5次,10 min /次;加入稀释山羊抗兔IgG(1 ∶5 000),室温水平摇床孵育60 min,Western洗涤液洗涤5次,10 min /次。经过增强型化学发光试剂显色和曝光后,使用Image J图像分析系统检测条带的灰度值,以待测蛋白与内参条带灰度值的比值作为目的蛋白的相对表达量。
1.5 统计学分析 使用SPSS 26.0软件进行统计学分析。计量资料以(x±s)表示,多组比较采用方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 4组大鼠的肝组织病理学变化 正常组大鼠肝组织细胞排列整齐且紧密,结构较为清晰,大小均一;血吸虫病组大鼠肝组织细胞排列杂乱且疏松,出现部分细胞坏死、结构损坏、纤维结缔组织增生、炎性细胞浸润状况;下调组大鼠肝组织细胞排列杂乱且疏松,出现明显细胞坏死、结构损坏、纤维结缔组织增生、炎性细胞浸润状况;上调组大鼠肝组织细胞排列较为整齐,结构较为清晰,细胞坏死、结构损坏、纤维结缔组织增生、炎性细胞浸润状况均较血吸虫病组明显减轻。见图1。
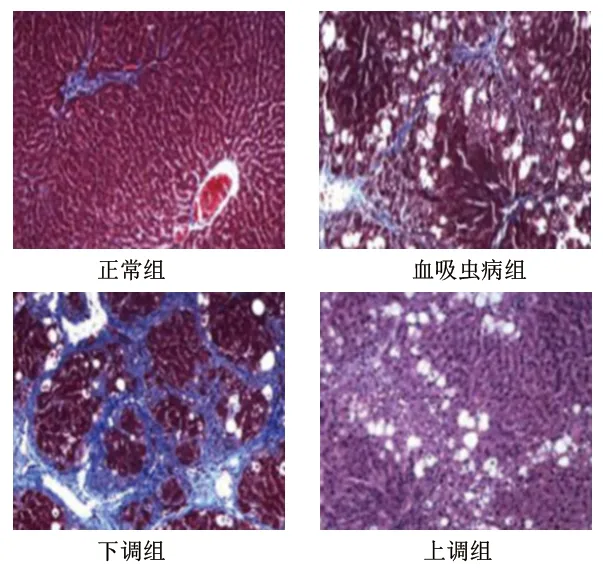
图1 4组大鼠的肝组织病理学变化(苏木精-伊红染色,×100)
2.2 4组大鼠肝功能指标水平的比较 与正常组比较,血吸虫病组、下调组、上调组大鼠的血清GGT、ALT、AST水平均升高;与血吸虫病组比较,下调组大鼠的血清GGT、ALT、AST水平均上升,上调组大鼠的血清GGT、ALT、AST水平均降低;与下调组相比,上调组大鼠的血清GGT、ALT、AST水平均降低(均P<0.05)。见表1。

表1 4组大鼠肝功能指标水平的比较(x±s,U/L)
2.3 4组大鼠肝纤维化指标的比较 与正常组比较,血吸虫病组、下调组、上调组大鼠的血清透明质酸、PCⅢ、层粘连蛋白水平均升高;与血吸虫病组比较,下调组的血清透明质酸、PCⅢ、层粘连蛋白水平升高,上调组大鼠的血清透明质酸、PCⅢ、层粘连蛋白水平均降低;与下调组大鼠比较,上调组大鼠的血清透明质酸、PCⅢ、层粘连蛋白水平均降低(均P<0.05)。见表2。

表2 4组大鼠肝纤维化指标水平的比较(x±s,μg/L)
2.4 4组大鼠氧化应激和炎症指标的比较 与正常组比较,血吸虫病组、下调组、上调组大鼠的血清活性氧簇、8-OHdG、IL-2、IL-22水平均升高;与血吸虫病组比较,下调组大鼠的血清活性氧簇、8-OHdG、IL-2、IL-22水平升高,上调组大鼠的血清活性氧簇、8-OHdG、IL-2、IL-22水平均降低;与下调组大鼠比较,上调组大鼠的血清活性氧簇、8-OHdG、IL-2、IL-22水平均降低(均P<0.05)。见表3。

表3 4组大鼠氧化应激和炎症指标的比较(x±s)
2.5 4组大鼠的miRNA-17-92及TGF-β/Smad通路蛋白相对表达量的比较 与正常组比较,血吸虫病组、下调组、上调组大鼠miRNA-17-92的相对表达量较低,TGFβRⅢ、Smad2、Smad3蛋白的相对表达量较高;与血吸虫病组比较,下调组大鼠miRNA-17-92的相对表达量较低,TGFβRⅢ、Smad2、Smad3蛋白的相对表达量较高,上调组大鼠miRNA-17-92的相对表达量较高,TGFβRⅢ、Smad2、Smad3蛋白的相对表达量较低;与下调组大鼠比较,上调组大鼠miRNA-17-92的相对表达量较高,TGFβRⅢ、Smad2、Smad3蛋白的相对表达量较低(均P<0.05)。见表4。
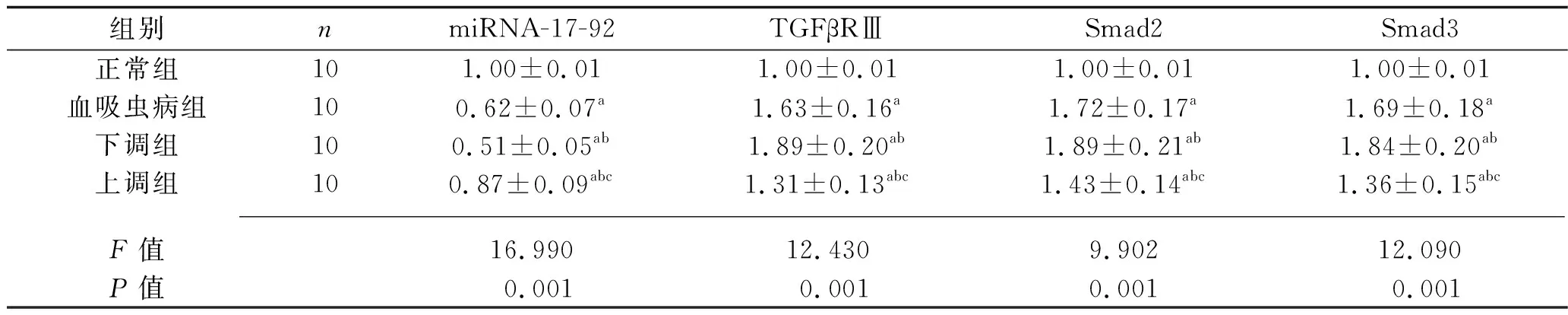
表4 4组大鼠miRNA-17-92及TGF-β/Smad通路蛋白相对表达量的比较(x±s)
2.6 4组大鼠PI3K/Akt通路蛋白相对表达量的比较 与正常组比较,血吸虫病组、下调组、上调组大鼠PI3K、Akt、mTOR蛋白的相对表达量较高;与血吸虫病组比较,下调组PI3K、Akt、mTOR蛋白的相对表达量较高,上调组大鼠PI3K、Akt、mTOR蛋白的相对表达量较低;与下调组比较,上调组大鼠PI3K、Akt、mTOR蛋白的相对表达量较低(均P<0.05)。见表5。
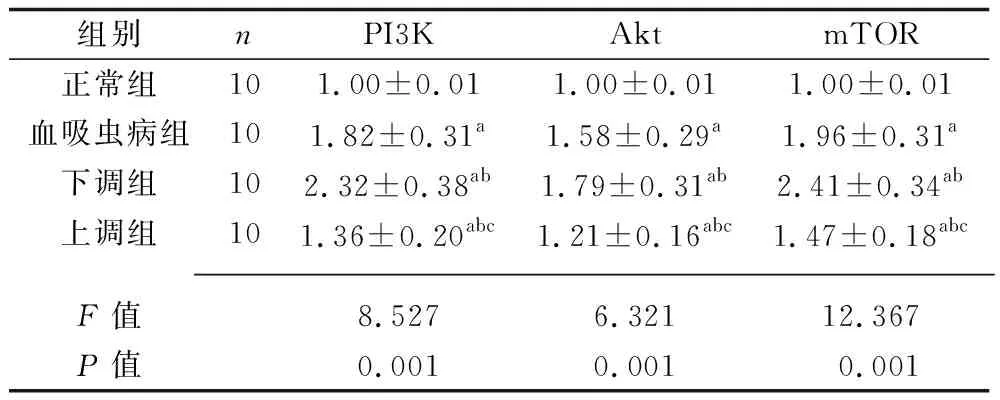
表5 4组大鼠PI3K/Akt通路蛋白相对表达量的比较(x±s)
3 讨 论
作为一种慢性感染性免疫系统疾病,血吸虫病广泛分布于全球数十个国家和地区[8-9]。有研究显示,随着血吸虫病的发展,沉积于机体肝脏组织中的虫卵会导致肝损伤、肝纤维化,可严重影响患者的预后,因此寻找一种安全有效的治疗手段具有重要意义[10-11]。目前临床上尚无一种特效的治疗血吸虫病所致肝纤维化的药物,越来越多的专家学者开始致力于这方面的研究。
血吸虫病的发生、发展可引起肝功能损伤甚至肝硬化等,减轻肝功能损伤的严重程度对血吸虫病治疗、预后改善具有重要意义[12]。miRNA广泛存在于大多数生物中,具有组织特异性、稳定性、保守性等特点,与机体组织细胞增殖、迁移、凋亡等生物学行为密切相关[13-14]。miRNA-17-92作为miRNA家族的重要成员,其表达水平的变化与血管疾病、机体正常生长发育、免疫调节密切相关[15]。有研究显示,miRNA-17-92缺失对肝脏再生具有抑制作用,进而引发了肝功能损伤[16]。但目前鲜有miRNA-17-92在血吸虫病方面的研究。本研究结果显示,血吸虫病大鼠的血清GGT、ALT、AST水平上升,而上调miRNA-17-92表达后血吸虫病大鼠的血清GGT、ALT、AST水平下降,说明血吸虫病大鼠出现一定程度的肝功能损伤,而上调miRNA-17-92表达能够缓解大鼠的肝功能损伤严重程度,改善血吸虫病大鼠的肝功能指标。
肝组织持续的炎症反应会造成纤维结缔组织增生并大量沉积,进而促进肝组织纤维化的发生、发展[17]。有研究显示,虫卵可溶性抗原会对血吸虫患者机体进行持续刺进,进而引发了免疫应答,导致组织损伤、虫卵肉芽肿等慢性炎症的发生,最终引发肝纤维化,严重者可导致死亡,这对患者的预后造成了严重影响[18]。本研究结果显示,血吸虫病大鼠的血清透明质酸、PCⅢ、层粘连蛋白水平升高,肝组织细胞排列杂乱且疏松,出现部分细胞坏死、结构损坏、纤维结缔组织增生、炎性细胞浸润状况;而上调miRNA-17-92表达的血吸虫病大鼠的血清透明质酸、PCⅢ、层粘连蛋白水平下降,且肝组织细胞排列较为整齐,结构较为清晰,细胞坏死、结构损坏、纤维结缔组织增生、炎性细胞浸润状况较血吸虫病组均明显减轻,这说明血吸虫病大鼠出现肝纤维化现象,而上调miRNA-17-92表达能够减轻其肝纤维化程度。研究表明,TGF-β/Smad信号通路在机体组织纤维化发展过程中起到重要作用[19]。本研究结果显示,上调miRNA-17-92表达的血吸虫病大鼠TGFβRⅢ、Smad2、Smad3蛋白表达下调,说明上调miRNA-17-92表达能够靶向调控TGF-β/Smad通路蛋白表达,这可能是其抑制肝纤维化发展、发挥肝脏保护作用的可能机制之一。
肝损伤、肝纤维化的发生和发展伴随着肝组织的氧化应激反应及炎症反应[20]。活性氧簇具有一定氧化性,肝损伤发展过程中活性氧簇大量生成[21],致使氧化产物8-OHdG大量生成。IL-2、IL-22是常用的评价机体炎症反应的指标,二者水平变化与机体炎症反应密切相关[22-23]。本研究结果显示,血吸虫病大鼠的血清活性氧簇、8-OHdG、IL-2、IL-22水平上升,而上调miRNA-17-92表达的血吸虫病大鼠的血清活性氧簇、8-OHdG、IL-2、IL-22水平下调,这说明上调miRNA-17-92表达能够有效地减轻血吸虫病大鼠肝组织氧化应激损伤和炎症反应,从而减轻肝纤维化。
肝脏组织细胞凋亡是慢性肝损伤、肝纤维化发展过程中的主要特征[24-25]。PI3K/Akt信号通路相关蛋白P13K、Akt、mTOR蛋白表达变化与细胞凋亡能力密切相关,靶向调控PI3K/Akt信号通路蛋白表达,能够干预细胞增殖、凋亡[26]。本研究结果显示,上调miRNA-17-92表达的血吸虫病大鼠PI3K、Akt、mTOR的蛋白相对表达水平下调,因此我们推测上调miRNA-17-92表达可能通过靶向调控PI3K/Akt通路蛋白表达,抑制肝脏组织细胞凋亡,从而起到抑制肝纤维化发展的作用。
综上所述,上调miRNA-17-92表达能够改善血吸虫病大鼠模型的肝功能和肝纤维化程度,其作用机制可能是调控miRNA-17-92能够减轻肝组织氧化应激反应和炎症反应,并靶向调控TGF-β/Smad通路、PI3K/Akt通路蛋白从而抑制肝纤维化及肝组织细胞凋亡,这或许可为血吸虫病所致肝纤维化的临床治疗提供一定的理论依据。

